shRNA介導黑素瘤A375細胞Cbl?b基因沉默前后蛋白質組學分析
王小坡 倪娜娜 熊競舒 宋昊 姜祎群 陳浩 曾學思 孫建方
210042南京,中國醫學科學院 北京協和醫學院 皮膚病醫院病理科
Casitas B?lineage lymphoma(Cbl)?b 是 Cbl家族成員之一,屬于環指型泛素連接酶,在腫瘤發病中可通過其N-端酪氨酸激酶結合(TKB)結構域識別并結合底物蛋白酪氨酸激酶,從而啟動底物泛素化降解,參與細胞內信號轉導的負向調控。Fan等[1]發現,Cbl?b可通過泛素化降解黏著斑激酶(FAK)使胃癌細胞解離,從而促進胃癌轉移。Kang等[2]發現,Cbl/Cbl?b可作為連接蛋白與Smad3結合,抑制轉化生長因子(TGF)?β信號通路,從而參與乳腺癌發病過程。我們前期研究發現,黑素瘤組織及細胞中Cbl-b基因mRNA及蛋白表達均明顯高于色素痣組織及正常黑素細胞,并且可促進黑素瘤細胞株A375增殖、侵襲及轉移,但相關的分子基礎及信號通路仍不明確[3]。本研究中我們采用非標記定量蛋白質組學技術,比較Cbl?b shRNA慢病毒載體沉默A375細胞株及陰性對照A375細胞株蛋白表達差異,并對差異蛋白進行基因本體(gene ontology)富集及京都基因與基因組百科全書(Kyoto encyclopedia ofgenes and genomes,KEGG)通路富集分析,探討Cbl?b參與黑素瘤發病的相關蛋白及可能機制。
材料與方法
一、材料
C18 Cartridge、C18上樣柱(EASY column SC001 traps150μM×20mm,RP?C18)、C18分析柱(EASY column SC200 150μM× 100mm,RP?C18)均來自美國Thermo公司,BCA定量試劑盒來自上海碧云天生物技術有限公司,鼠抗人Cbl?b單克隆抗體為美國Santa Cruz公司產品,鼠抗人促紅細胞生成素產生肝細胞受體A2(EphA2)、糖原合成酶激酶3(GSK3)β、蛋白激酶B(AKT)、磷酸化蛋白激酶B(p?AKT)多克隆抗體均為美國Bioworld公司產品。Q?Exactive質譜儀、Easy?nLC 1000納升級液相色譜(美國Thermo Fisher公司)。
A375細胞系(美國模式培養物保藏中心)由本所中心實驗室保存,在以往研究中構建慢病毒shRNA Cbl?b A375細胞系(用shRNA Cbl?b慢病毒載體轉染72 h)及對照A375細胞系(用對照慢病毒載體轉染72 h)[4]。
二、試驗方法
1.轉染后A375細胞蛋白提取及電泳:轉染后72 h提取慢病毒shRNACbl?b沉默組及對照組A375細胞蛋白,蛋白樣品加入200μl SDT裂解液(4%SDS,100 mmol/L 二硫蘇糖醇,100 mmol/L Tris,pH8.5),超聲處理(100W,工作10 s,間歇10 s,循環10次);沸水浴10min;14 000×g離心30min,取上清液;BCA法進行蛋白定量。每組各取20μg樣品加入5×上樣緩沖液,沸水浴5min,14 000×g離心10 min取上清液,SDS?PAGE電泳,考馬斯亮藍染色。
2.蛋白樣品酶解(filter?aided samplepreparation,FASP):每組取192μg蛋白裂解樣品,加入二硫蘇糖醇至終濃度為100 mmol/L,沸水浴5min;加入200μl尿素緩沖液稀釋混勻,14 000×g離心15min(重復1次),棄濾液;加入100μl含50mmol/L碘乙酰胺的尿素緩沖液,振蕩1min,避光室溫孵育30min后14 000×g離心10min;加入100μl尿素緩沖液,14 000×g離心10min(重復2次);加入100μl碳酸氫銨緩沖液,14 000×g離心10min(重復2次);加入40μl含4μg胰酶碳酸氫銨的緩沖液,振蕩1min;37℃酶解16~18 h;換新收集管,14 000×g離心10 min,收集濾液;濾液經 C18?SD Extraction Disk Cartridge脫鹽處理,之后根據吸光度A280對肽段定量。
3.酶解產物的LC?MS/MS分析(上海中科新生命生物科技有限公司協助完成):采用HPLC液相色譜系統EASY?nLC1000分離,流速為400 nl/min。采用Q?Exactive質譜儀進行質譜分析。分析時長120min,檢測方式為正離子,母離子掃描范圍300~1 800質量電荷比(m/z)。多肽和多肽碎片m/z按照下列方法采集:每次全掃描后采集20個碎片圖譜,激活方式為高能量碰撞解離(HCD),隔離窗口為2m/z。一級質譜分辨率200m/z時為70 000,二級質譜分辨率為17 500。
4.數據庫檢索與定量分析:應用MaxQuant軟件(版本號1.3.0.5)對質譜原始文件進行定量分析。主要參數如下:最大容許漏切位點為2,酶為胰蛋白酶,半胱氨酸脲甲基化修飾為固定修飾,甲硫氨酸氧化和蛋白N末端乙酰化為可變修飾,MaxQuant所得查庫文件使用Perseus軟件進行分析(版本號1.3.0.4)。差異蛋白篩選標準為Cbl?b shRNA沉默組/對照組非標定量強度>2或<0.5,同時滿足P<0.05。
5.生物信息學分析:用Cluster 3.0軟件分析差異蛋白,Java Tree View軟件生成層次聚類熱圖。用Blast2GOCommand Line軟件分析基因本體條目生物學過程、分子功能及細胞組分富集情況;用KAAS(KEGG Automatic Annotation Server)軟 件 分 析KEGG通路富集情況。
6.Western 印跡檢測 Cbl?b、EphA2、GSK3β、AKT、p?AKT蛋白表達:方法同文獻[4]。轉染后72 h提取shRNA沉默組和對照組總蛋白,蛋白變性、上樣,SDS?PAGE電泳、轉膜、封閉,分別加入鼠抗人Cbl?b單克隆抗體(1∶500)和EphA2(1∶500)、GSK3β(1∶500)、AKT(1∶800)、p?AKT(1∶800)多克隆抗體及鼠抗人GAPDH抗體(1∶1 000)孵育過夜等。用Image J軟件分析條帶灰度,以對照組條帶灰度值為1,計算目的蛋白相對表達量。
7.統計學方法:采用SPSS 23.0軟件進行統計分析,數據以x±s表示。Cbl?b shRNA沉默組和對照組間蛋白豐度比較采用兩樣本t檢驗(n=3)。基因本體及KEGG富集分析采用Fisher精確概率法檢驗。P<0.05為差異有統計學意義。
結 果
一、細胞蛋白提取及Cbl?b蛋白沉默效果
BCA法檢測陰性對照組蛋白濃度為(3.126±0.108)g/L,Cbl?b shRNA 組蛋白濃度為(6.024 ±0.227)g/L。由考馬斯亮藍圖譜看,各樣品條帶分離清晰,蛋白提取效果良好(圖1)。Western印跡表明,Cbl?b shRNA組Cbl?b蛋白相對表達量顯著降低(圖2)。
圖1 A375細胞提取蛋白十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳圖 M:蛋白分子標記物;1~3:陰性對照組;4~6:Cbl?b shRNA沉默組
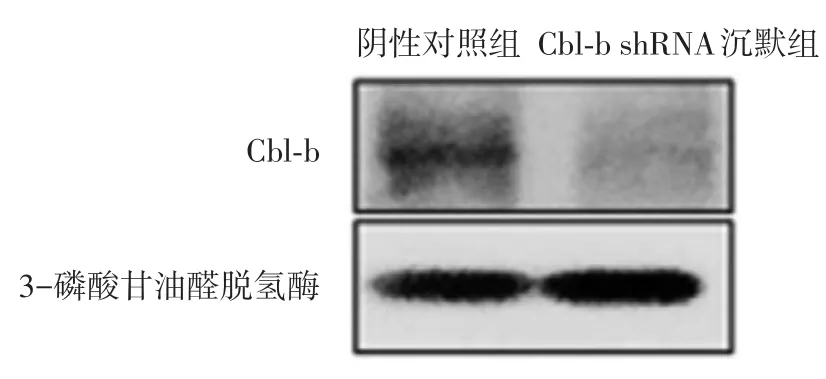
圖2 Western印跡檢測Cbl?b在兩組A375細胞中的表達
二、蛋白質鑒定及差異蛋白分析
本次共鑒定肽段23 579個,蛋白質3 449個。所定量到蛋白質序列信息批量提取自UniProtKB數據庫(版本號:201701)。兩組間差異表達的蛋白質為74個,其中Cbl?b shRNA沉默組較對照組表達上調的蛋白52個,下調的蛋白22個。上調或下調倍數排名前10位的蛋白分別見表1、2。
三、蛋白聚類分析
利用篩選的差異蛋白對Cbl?b shRNA重組慢病毒沉默組和對照組進行層次聚類,結果顯示差異蛋白可以有效區分樣本,即挑選的差異蛋白合理、準確(圖3)。
四、差異蛋白基因本體富集分析
前5位顯著富集生物學過程為整合素介導細胞黏附、單一生物代謝過程、整合素介導細胞黏附調節、蛋白質靶向線粒體調節、核酸代謝過程;前5位顯著富集分子功能為DNA結合、2,2鐵硫簇合物結合、信號受體活性、鈣黏蛋白結合、細胞黏附分子結合;前5位顯著富集的細胞組分為核小體、DNA包裝復合體、光感器連接纖維、DNA-蛋白質復合體、胞外區部分。
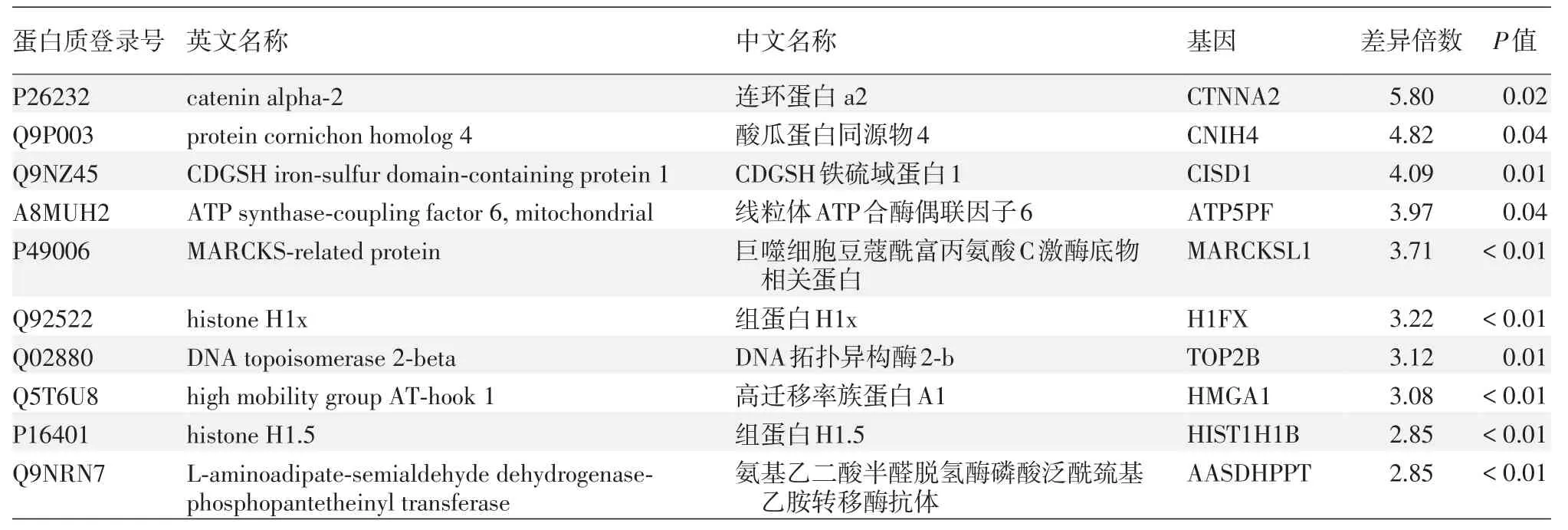
表1 慢病毒Cbl?b shRNA沉默組A375細胞中表達上調的蛋白(n=3,與陰性對照組相比差異倍數排名前10位)
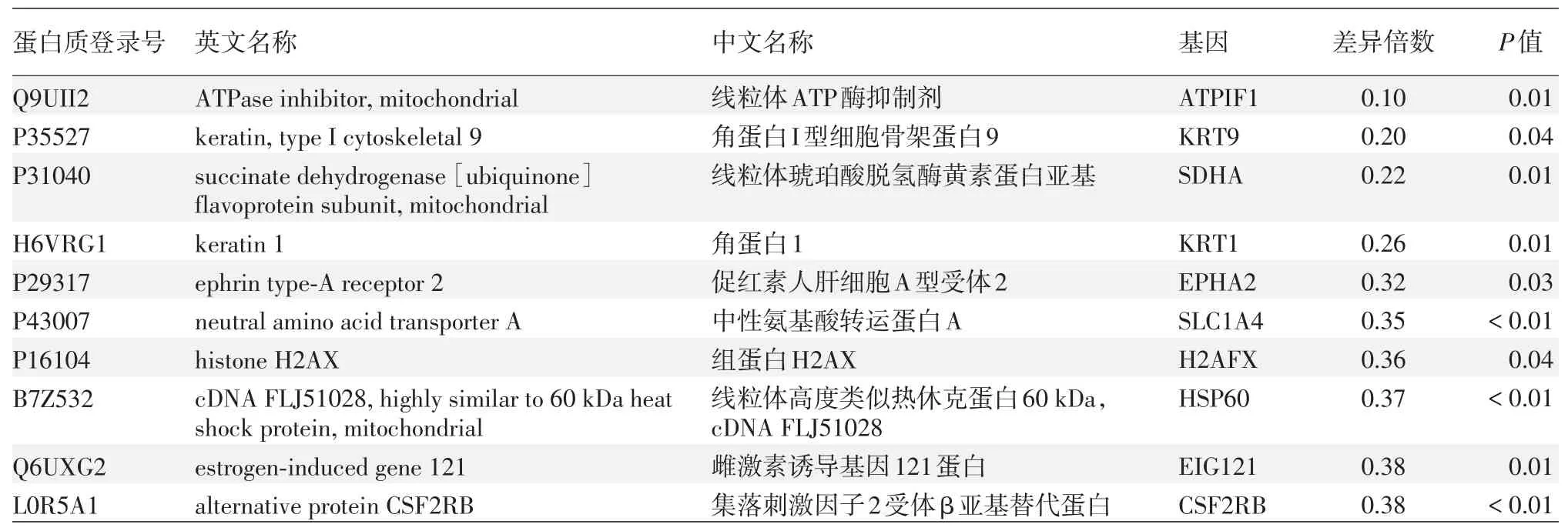
表2 慢病毒Cbl?b shRNA沉默組A375細胞中表達下調的蛋白(n=3,與陰性對照組相比差異倍數排名前10位)
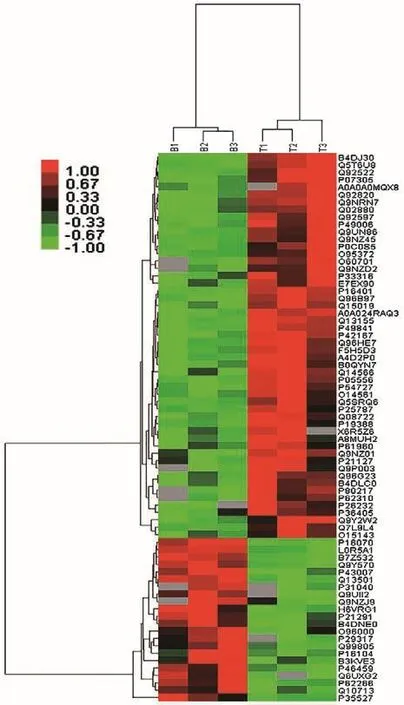
圖3 差異蛋白對Cbl?b shRNA重組慢病毒沉默組和陰性對照組層次聚類熱圖 紅色表示上調,綠色表示下調
五、差異蛋白KEGG富集分析
前5位與黑素瘤相關的顯著富集通路包括葉酸生物合成、軸突導向、細胞外基質受體相互作用、黏合連接、Wnt信號通路(圖4)。
六、Western印跡驗證部分差異蛋白質的表達水平
Cbl?b shRNA沉默組A375細胞EphA2表達下調(0.369),GSK3β表達上調(3.524)(圖5A)。Western印跡檢測結果與LC?MS/MS研究結果一致。
七、沉默Cbl?b表達對AKT、p?AKT表達的影響
Western印跡檢測表明Cbl?b shRNA沉默組A375細胞AKT表達水平與對照組類似(1.04),p?AKT表達水平(0.453)降低,見圖5B。
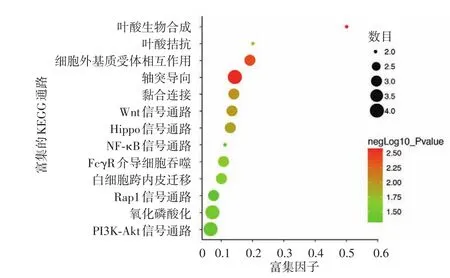
圖4 差異蛋白顯著富集的KEGG條目統計圖 點的大小表示通路中差異表達基因條數多少,點的顏色對應不同的negLog10_Pvalue范圍
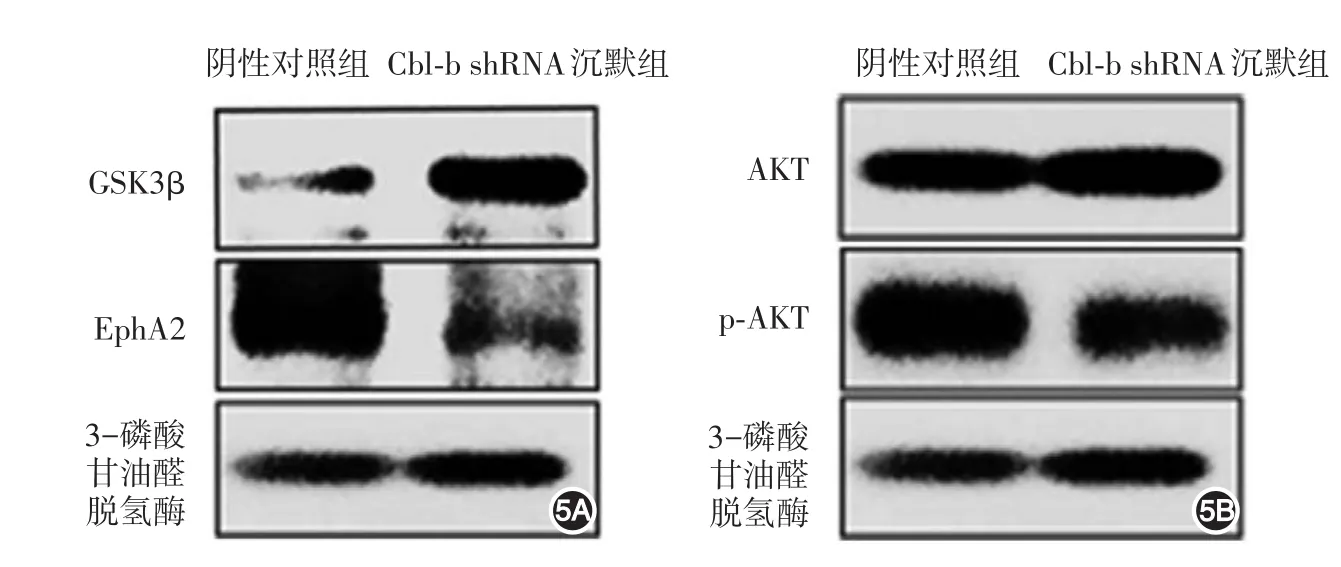
圖5 Western 印跡檢測A375細胞中EphA2、GSK3β(5A)及AKT、p?AKT(5B)蛋白表達 EphA2:促紅細胞生成素產生肝細胞受體A2;GSK3β:糖原合成酶激酶3β;AKT:蛋白激酶B;p?AKT:磷酸化蛋白激酶B
討 論
蛋白質組學通過凝膠電泳、質譜等技術產生的海量數據反映生物體內發生的全部過程及變化。從這些龐大而復雜的實驗數據中尋找生物體的改變以及引起這些改變的源頭和機制,是蛋白質組生物信息學的主要任務。使用siRNA沉默目的基因進行差異蛋白質組學表達分析,可以了解與特定基因功能喪失相關的蛋白質表達的整體變化[5?6]。本研究采用非標記定量蛋白質組學成功鑒定74個在Cbl?b shRNA慢病毒載體轉染A375細胞株與空白慢病毒載體轉染A375細胞株間差異表達的蛋白質,其中52個蛋白質在Cbl?b shRNA沉默組表達上調,22個蛋白質表達下調。
基因本體是生物學的統一化工具,包括3大獨立的本體:分子功能、生物過程和細胞組分。我們對差異蛋白集合基因本體條目富集分析發現,顯著富集分子功能包括DNA結合、2,2鐵硫簇合物結合、信號受體活性、鈣黏蛋白結合等,這與顯著富集的生物學過程細胞黏附及細胞代謝過程相一致,這些過程與功能均在腫瘤的增殖、侵襲中起重要作用。我們對差異蛋白-KEGG條目富集分析發現,黑素瘤相關的顯著富集通路主要包括葉酸生物合成、軸突導向、細胞外基質受體相互作用、黏合連接、Wnt信號通路、Hippo信號通路、葉酸拮抗、氧化磷酸化、PI3K?Akt信號通路等。葉酸生物合成通路及葉酸拮抗劑抵抗通路值得關注,因為膳食葉酸攝入對雌激素受體陰性的乳腺癌有保護作用[7];此外,許多研究表明,葉酸在生物甲基化和核苷酸合成中具有核心作用,可以調節癌變[8]。多種通路與細胞過程和環境信息處理有關,如黏合連接、細胞外基質受體相互作用信號通路與黑素瘤密切相關[9]。另外,信號轉導通路如Wnt、Hippo、PI3K?AKT信號通路與黑素瘤的發生發展密切相關[10?13]。因此,敲除黑素瘤 A375 細胞株Cbl?b可能通過多種信號通路影響黑素瘤細胞的增殖、凋亡、侵襲及轉移。
由于GSK3β可通過Wnt/β聯蛋白和Hedgehog信號通路負性調節癌基因和細胞周期調節因子,因此GSK3β是抑制腫瘤發生和腫瘤進展的抑癌基因。Eph家族是受體酪氨酸激酶家族成員中最大亞族,EphA2是EphA亞家族中的一員。在乳腺癌、卵巢癌和黑素瘤等腫瘤中EphA2均高表達,并且可通過非配體依賴途徑促進腫瘤進展[14?15]。我們選擇這兩個蛋白通過Western印跡驗證蛋白質組學可靠性,結果表明,Western印跡實驗結果與蛋白質組學結果一致。
我們發現,在黑素瘤A375細胞株中,Cbl?b沉默后,EphA2表達下降,因此Cbl?b與EphA2可能共同促進黑素瘤進展。EphA2可通過多種信號通路參與腫瘤發病,如 JAK/STAT、Ras/MAPK、PI3K/AKT和integrins/FAK/paxillin/Rho等[16]。沉默 Cbl?b表達可阻斷AKT的磷酸化過程,從而抑制PI3K?AKT信號通路的過度活化。
綜上所述,我們利用比較蛋白質組學分析Cbl?b沉默A375細胞后差異蛋白表達,共鑒定72個Cbl?b相關蛋白。生物信息學分析發現,差異蛋白涉及多種生物學功能及信號通路。因此推測Cbl?b可能通過多種信號通路參與黑素瘤發病過程,其中Cbl?b激活EphA2/PI3K/AKT信號通路可能是黑素瘤發生發展的重要分子機制之一,其他信號通路仍值得深入研究。

