外側裂-島葉入路與顳葉皮層入路對基底節出血患者的臨床預后及炎性因子水平的影響
王星 隗麟懿
基底節是臨床上最常見的腦出血部位,多由長期高血壓病導致豆紋動脈破裂引起,是神經外科最常見的疾病之一。在歐美國家基底節出血約占全部腦血管病患者的15%,而在中國其比例接近50%,且呈逐年增高的趨勢[1]。基底節是多個神經傳導束和核團共同聚集的部位,該部位出血后患者常出現典型的偏癱、偏身感覺障礙和失語,嚴重者短時間內發生昏迷,甚至死亡,給家庭帶來沉重負擔[2]。目前對于基底節出血的治療手段主要為藥物保守治療和開顱清除血腫治療,而對于血腫>30 mL的患者來說,手術基本上是唯一的選擇[3]。目前臨床采用的血腫清除術主要有顳葉皮層入路和外側裂-島葉入路。本研究回顧性分析了兩種手術入路治療基底節出血的臨床療效,現報道如下。
1 資料與方法
1.1 一般資料
收集的對象為2012年1月-2015年12月在本院接受手術治療的基底節出血患者,共137例,其中男82例,女55例,平均年齡(58.4±14.9)歲,平均發病時間(3.1±1.6) h,行美國國立衛生研究院卒中量表(National Institute of Health stroke scale, NIHSS)評分為(18.61±7.32)分,格拉斯哥昏迷測量表(Glasgow Coma scale,GCS) 評分為(9.21±4.55)分。
1.2 入組和排除標準
入組標準:符合《各類腦血管病診斷要點(第四版)》中有關腦出血的診斷標準[4];年齡40~70歲;顱腦CT診斷為基底節出血,出血量30~70 mL(采用多田公式計算);首次發病;知情同意并簽署同意書。
排除標準:血管畸形引起的腦出血;既往顱內出血史或腦梗死病史;存在精神障礙或患者昏迷,難以評估病情者;嚴重心、肺、腎功能障礙;出血量小且保守治療者。
1.3 分組及治療
患者根據手術方式的不同進行分組:觀察組(采用外側裂-島葉入路)85例和對照組(采用顳葉皮層入路)52例。對照組男52例,女33例,年齡40~69歲,平均年齡(56.8±12.9)歲,病理1.5~4.0 h,平均(2.5±0.9) h,入院后行NIHSS評分為(18.07±10.22)分,GCS評分為(9.03±5.01)分,顱腦CT顯示顱內出血量為31.98~66.63 mL,平均(48.09±12.76) mL;觀察組男30例,女22例,年齡40~70歲,平均年齡(59.8±11.1)歲,病程1.0~5.0 h,平均(3.2±1.2)h,入院后進行NIHSS評分為(19.01±9.94)分,GCS評分為(9.29±4.09)分,顱內出血量為33.23~68.01 mL,平均(47.87±10.08) mL。2組患者的一般資料無統計學差異(P>0.05)。
患者入院后立即控制血壓,并吸氧、心電監護、脫水降顱壓、預防血管痙攣、補液處理,同時積極準備手術治療。外側裂-島葉入路:患者全麻成功后采用翼點入路手術方式開顱,暴露眶上緣和部分顴弓,以額骨顴突為中心銑下約5 cm×3 cm骨瓣,根據顱內壓水平決定是否靜滴甘露醇,剪開硬腦膜,顯微鏡下分離外側裂,銳性分開蛛網膜,排放腦脊液,小心分離外側裂后顯露島葉并局部切開進入血腫腔清除血腫,徹底止血,手術創面覆蓋止血紗布;術后腦組織塌陷,腦搏動良好,硬膜下放置引流管,還納骨瓣。顳葉皮層入路:患者頭偏向病灶對側,根據血腫部位作顳部直切口,長約6~8 cm,用牽開器將顳肌及骨膜向兩側牽開,暴露顱骨,取下骨瓣,直徑5~6 cm,將暴露的硬腦膜放射狀切開并懸吊,切開顳中回2~3 cm,經顳葉皮質進入血腫腔,用腦壓板牽開皮質,進入血腫腔并迅速將血腫清除,徹底止血后硬膜下放置引流管,骨瓣復位。2組患者術后均給予脫水降顱壓、預防血管痙攣、止血及營養神經治療。
1.4 觀察指標
比較2組患者的手術時間;患者術后24 h復查顱腦CT,計算殘存血腫體積,將血腫清除率分為≤80%、81%~90%及>90%,比較2組手術入路的血腫清除率;治療3、7、14 d后采用NIHSS評分和GCS評分記錄患者神經功能恢復情況[5],患者手術前及治療14 d后各抽取靜脈血4 mL,檢測血清中C反應蛋白(C-reactionprotein,CRP)、腫瘤壞死因子(tumor necrosis factors-α,TNF-α)、白細胞介素-6,-8(IL-6,-8)的表達水平。
發病90 d后對患者進行門診或電話隨訪,再次采用NIHSS評分對患者恢復情況進行評估,整個評估過程采用雙盲的方式進行。
1.5 不良反應觀察
定期復查血常規及生化,密切關注患者出現的不良反應,評估治療方式的安全性。
1.6 統計學處理
2 結 果
2.1 2組手術時間及血腫清除率比較
觀察組患者的手術時間明顯短于對照組(P<0.05);觀察組血腫清除率>90%的患者例數顯著多于對照組,而清除率≤80%的患者例數顯著低于對照組(P<0.05)(表1)。

表1 2組患者手術時間及血腫清除率比較
注:與對照組比較,#P<0.05
2.2 2組治療前后神經功能評分比較
手術治療3 d后患者的臨床癥狀未見明顯改變(P>0.05);治療7 d后觀察組患者的神經功能評分較入院時明顯好轉(P<0.05);觀察組患者較對照組患者NIHSS評分和GCS評分改善更加明顯(P<0.05);治療14 d后2組患者臨床癥狀進一步改善(P<0.05);且觀察組患者NIHSS評分和GCS評分明顯優于對照組(P<0.05)(表2)。
2.3 2組患者炎性因子表達水平比較
治療14 d后血清中CRP,TNF-α,IL-6和IL-8的表達水平明顯降低(P<0.05);觀察組患者各項炎癥指標的恢復明顯優于對照組(P<0.05)(表3)。
2.4 2組不良反應比較
觀察組在治療過程中有2例患者出現不良反應,表現為頭痛、惡心;對照組有2例患者出現不適,表現為頭暈、嘔吐,對癥處理后癥狀均好轉;2組患者均未出現顱內或傷口感染情況,2組不良反應比較無明顯差異(P>0.05)。
2.5 隨訪情況
采用門診或電話隨訪的方式,137例患者全部隨訪成功。2組患者發病90 d后NIHSS評分較前進一步好轉(P<0.05);觀察組患者NIHSS評分明顯優于對照組(P<0.05)(表4)。
3 討 論
基底節出血臨床癥狀嚴重,具有典型的偏癱、偏盲、偏身感覺障礙的“三偏”癥狀,出血量大者可短時間內出現昏迷,甚至死亡[5]。基底節出血的臨床癥狀主要是由血腫的占位效應及其繼發性損傷引起,占位效應可引起局部腦組織缺血缺氧,神經元及膠質細胞短時間內發生死亡[6];隨著病情進展,血凝塊中血紅蛋白的降解可觸發腦組織的炎癥反應,加重細胞損傷,引起局部腦水腫,嚴重影響患者的預后[7]。而血腫的體積及持續時間是影響高血壓性腦出血預后的關鍵因素。因此,通過手術方式迅速清除血腫是治療基底節出血的主要手段之一。
基底節出血患者多采用手術方式進行治療,整個手術過程在直視下進行,可快速、有效的清除顱內的血腫且止血效果確切,目前采用的手術方式有傳統的顳葉皮層入路和近年開展較多的外側裂-島葉入路。顳葉皮層入路主要手術過程是定位血腫后通過切口顳葉皮層進入血腫腔清除血腫,而部分患者經顳葉皮質入路距血腫腔較深,清除血腫難以達到滿意效果,常需擴大皮層切口,從而增加腦組織損傷,且易導致血腫殘留較多甚至術后再出血[8]。而外側裂-島葉入路遵循了微創的理念,通過大腦的自然裂隙進入血腫腔,避免對腦組織過度牽拉,有效預防腦組織的二次損傷,且血腫清除過程無死角。另外,通過外側裂進入血腫腔,容易暴露基底節區出血的責任血管-豆紋動脈,便于術中徹底止血。炎癥反應是腦出血后繼發性損傷的重要機制之一,血腫的直接刺激及血腫內的血紅蛋白降解可觸發及加重局部腦組織的炎性反應,炎性介質會進一步對出血部位的腦組織產生損害[9]。另外,炎癥因子表達水平的高低也可以作為評估患者病情嚴重程度及判斷預后的指標之一[10],因此本研究除了采用神經功能評分作為評價患者的療效外,還采用了檢測血清中CRP、TNF-α、IL-6及IL-8的表達水平來評估患者的預后。本研究基底節出血患者接受兩種手術治療,結果發現外側裂-島葉入路治療手術時間短,且對血腫的清除效果更加滿意;可以在短時間內改善患者癥狀;患者各項炎性因子指標明顯優于經顳葉皮層入路患者,說明外側裂-島葉入路對血腫清除更滿意,且二次損傷更小;兩種手術入路的不良反應的概率無明顯差異;發病后90 d隨訪發現接受外側裂-島葉入路的患者恢復明顯優于經顳葉皮層入路患者。

表2 2組治療后神經功能缺損評分的比較,分)
注:與同組治療前比較,*P<0.05;與對照組同時間點比較,#P<0.05
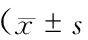
表3 2組患者治療前后炎性因子水平變化情況)
注:與同組治療前比較,*P<0.05;與對照組同時間點比較,#P<0.05
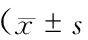
表4 2組患者隨訪NIHSS評分比較,分)
注:與對照組同時間點比較,#P<0.05
綜上所述,經外側裂-島葉入路治療可顯著改善基底節出血患者的臨床癥狀和血清中炎性因子水平,可在臨床推廣應用。

