基底動脈尖區(qū)動脈瘤合并基底動脈尖綜合征介入術相關性分析及治療進展
楊凈松, 趙 衛(wèi), 黃建強
血管內治療后循環(huán)動脈瘤較手術更安全[1-3],其中基底動脈尖區(qū)(tip of basilar artery,TBA)動脈瘤占多數(shù)[4-6]。由于以上動脈存在諸多穿支,介入手術相關的穿支動脈損傷、閉塞可能導致基底動脈尖綜合征(top of the basilar syndrome,TOBS),出現(xiàn)嚴重的并發(fā)癥導致患者重殘、死亡。TOBS是基底動脈尖及分支閉塞而產(chǎn)生一系列臨床綜合征,以丘腦、中腦、顳枕葉等損害為主[7],本文主要對基底動脈尖及其各分支動脈動脈瘤介入術后發(fā)生TOBS相關解剖學基礎、影像特點、介入手術中可能引起TOBS的操作及栓塞技術等潛在危險因素進行分析,并結合近來介入技術的進展,對術中、術后TOBS的預防及處理進行討論。
1 TBA動脈瘤栓塞治療后發(fā)生TOBS
1.1 TBA各穿支分布及穿支閉塞后相關臨床癥狀
基底動脈頂端穿支血管閉塞可能引起中腦頂蓋區(qū)至動眼神經(jīng)核等缺血,導致同側動眼神經(jīng)麻痹、凝視麻痹、復視、瞳孔散大[8]。
大腦后動脈(posterior-cerebral artery,PCA)動脈瘤并發(fā)夾層、巨大動脈瘤可能性較大,P1段+P2段動脈瘤約占全部PCA動脈瘤的70%[9],大多數(shù)的穿通支閉塞損傷等嚴重的術后并發(fā)癥發(fā)生于此,而P3、P4段由于距離遠,微導管難以到位,常選擇閉塞載瘤動脈,且一般無嚴重的并發(fā)癥。PCA近端發(fā)出穿支動脈包括:①丘腦穿動脈(thalamo perforating arteries,TPA):是P1段較為恒定的穿支動脈,約3.1支/側,TPA由1支或多支主干發(fā)出往往提示動脈干周圍小穿支動脈發(fā)出的減少甚至缺失[10],閉塞可能引起對側偏癱、共濟失調、意識障礙、認知功能障礙、眼球運動障礙(動眼神經(jīng)麻痹)以及對側半身舞蹈(紅核綜合征)等[10-12];Percheron 動脈(artery of Percheron,AOP)是一種解剖變異,表現(xiàn)為TPA雙側共干并發(fā)出分支供應雙側丘腦旁正中及中腦嘴部,主干血管起源更加靠近分叉處,阻塞引起供血區(qū)域梗死,可累及丘腦上行性網(wǎng)狀激活系統(tǒng)和丘腦邊緣系統(tǒng)等,出現(xiàn)三聯(lián)癥:垂直凝視麻痹、意識障礙、記憶障礙。由于AOP管徑小,CTA、MRA等很難發(fā)現(xiàn),判斷梗死主要通過臨床表現(xiàn)和典型的MR表現(xiàn),即雙側丘腦腹內側DWI高信號合并或不合并中腦嘴部“V”型高信號[13-14];②旋支(circumflex branches):根據(jù)其終止位置分為短旋動脈(short circumflex arteries,SCxA)和長旋動脈(long circumflex arteries,LCxA),閉塞可能導致后連合、Darkschewitsch核、Cajal核等區(qū)域缺血梗死,引起眼球垂直運動障礙[11-12]。③脈絡膜后內側動脈(medial posterior choroidal arteries,MPChA):缺血可能出現(xiàn)情緒反應異常、低落、偶見短暫的記憶減退[15]。其余PCA穿支如丘腦膝狀體動脈(thalamogeniculate arteries,TG arteries)、大腦腳穿動脈(peduncular perforating arteries)、脈絡膜后外側動脈(lateral posterior choroidal arteries,LPChA)等閉塞可能引起典型的丘腦癥候群(Dejerine-Roussy綜合征)發(fā)生對側偏身感覺異常、丘腦痛、對側痙攣性偏癱、動眼神經(jīng)麻痹、對側面癱、震顫、共濟失調等。
小腦上動脈(superior cerebellar artery,SCA)穿支閉塞可能引起惡心、嘔吐、眩暈、意向性震顫、肌張力降低等,靠近基底動脈的穿支閉塞可能引起腦干癥狀[16]。
1.2 術中、術后出血,炎癥刺激引起血管痙攣
術中血管痙攣主要由于操作不得當如導絲反復置入刺激血管壁、彈簧圈反復調整位置時刺激血管、未及時使用擴張血管藥物及術前抗血管痙攣藥物應用不及時等[17];術后血管痙攣主要由于蛛網(wǎng)膜下腔出血吸收過程中紅細胞破壞引起炎性反應導致腦水腫導致血管受到炎性刺激導致痙攣。張健等[18]認為盡早進行腦脊液外引流可以有效緩解蛛網(wǎng)膜下腔出血后的血管痙攣,但腦脊液外引流也存在增加腦脊液通路發(fā)生醫(yī)院感染等風險。
1.3 基底動脈頂端動脈瘤栓塞后彈簧圈移位及栓塞后占位效應
基底動脈頂端至PCA分叉部由于其特殊的血流動力學及血流切應力等因素,是TBA動脈瘤最常見部位,此處發(fā)生動脈瘤有形態(tài)不規(guī)則、寬瘤頸、常累及周圍血管的特點,特殊的血流及解剖學特點,使得此處動脈瘤的栓塞難度大,發(fā)生并發(fā)癥更嚴重,即使采用支架輔助栓塞,也可能出現(xiàn)彈簧圈團由于壓力過大導致支架塌陷而出現(xiàn)嚴重后果(圖1);基底動脈頂端處周圍有視神經(jīng)、動眼神經(jīng)等重要腦神經(jīng)毗鄰,動脈瘤栓塞后可以形成類似腫瘤的“占位效應”而導致患者出現(xiàn)偏盲、上瞼下垂、雙側瞳孔不等大等癥狀,但相較動脈瘤搏動時引起的壓迫癥狀緩解,且一般在術后6個月~2年內癥狀可以得到緩解。
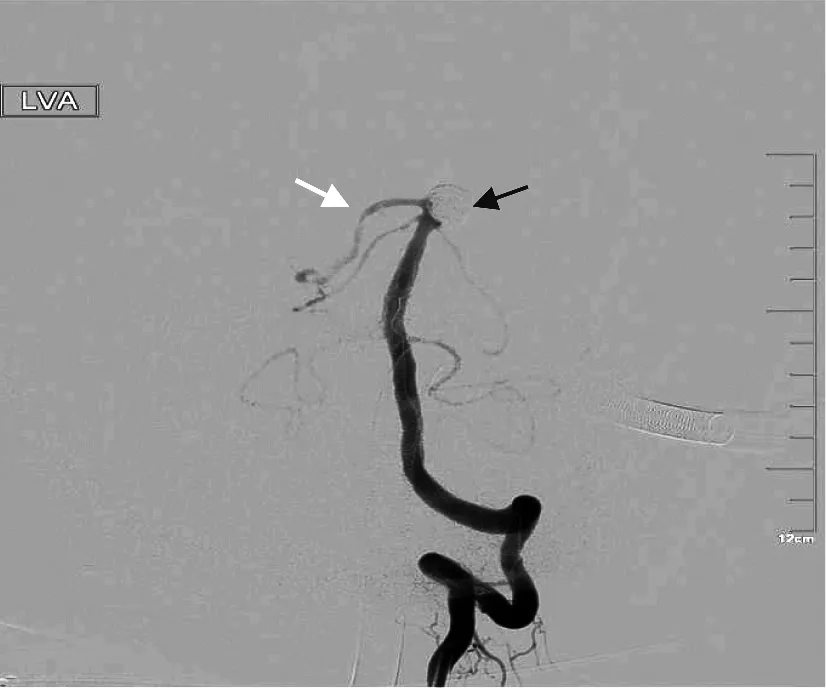
圖1 基底動脈頂端寬頸動脈瘤栓塞并彈簧圈移位
綜上,據(jù)臨床病例分析及相關文獻所載,介入術后發(fā)生TOBS原因主要有:基底動脈頂端及PCA重要穿支血管術中閉塞、損傷;蛛網(wǎng)膜下腔出血導致遲發(fā)腦水腫、炎性反應等引起血管痙攣,基底動脈尖供血區(qū)域缺血梗死;栓塞器材如彈簧圈在基底動脈尖區(qū)域中產(chǎn)生占位效應,壓迫周圍神經(jīng)、血管,導致相應癥狀。
2 基底動脈頂端及分支血管動脈瘤血管內治療進展
2.1 TBA動脈瘤的治療進展和思考
文獻指出造影發(fā)現(xiàn)70%瘤頂朝上,10%~15%瘤頂向前,余向后,動脈瘤栓塞引起的穿動脈閉塞是導致該段出現(xiàn)TOBS的主要原因,在治療時應結合3D-DSA對瘤頂解剖特點進行觀察。
單純彈簧圈栓塞可能并發(fā)彈簧圈突出、脫出、解旋等,引起PCA、SCA穿支閉塞,盡管彈簧圈新技術如Medina?裝置[19]等具有瓣膜覆蓋瘤頸和阻斷動脈瘤血流快速形成血栓的特點,仍可因瘤腔大小不匹配等原因導致壓縮和不完全栓塞,且常需要其他型彈簧圈同用而出現(xiàn)相同問題,對于這種動脈瘤常使用球囊或支架輔助栓塞,席春江等[6]使用超順應性Hyperform分叉球囊進行TBA寬頸動脈瘤栓塞,取得不錯效果,但球囊輔助栓塞可能需要暫時閉塞一側甚至雙側的后循環(huán)血流,可能引起后循環(huán)缺血甚至腦梗死、穿通支動脈閉塞,且在球囊輔助成型后,彈簧圈再移位的可能[20];隨著支架輔助彈簧圈栓塞技術的進展,對于多數(shù)寬頸動脈瘤,支架輔助栓塞已經(jīng)成為首選的血管內治療方法,在長期療效、安全性、防止動脈瘤復發(fā)等方面也得到肯定[20-21]。對于 TBA 寬頸動脈瘤,可使用“Y”型支架技術[20-21],將開環(huán)和/或閉環(huán)支架(雖然選擇開環(huán)或閉環(huán)支架對動脈瘤栓塞效果及并發(fā)癥發(fā)生等無顯著關系[22],但根據(jù)報道[23],Enterprise支架具有更好的順應性和可操作性且配套微導管相對細,使得支架更易到位并釋放,支架尾端可平行放置也可以交叉“kissing”,也有學者認為可以使用Livis支架,但穿網(wǎng)眼相對困難)同時或分別置入兩側PCA,支架輔助可防止彈簧圈解旋,使彈簧圈盤繞得更密,具有血流動力學重建和保護重要分支及穿通支血管的作用[23],改變動脈瘤口部的血流動力學特點,降低動脈瘤復發(fā)出血的風險,多支架的應用,在嚴格規(guī)范的抗血小板凝集治療下并不會增加血栓事件的發(fā)生率[22,24]。 TBA 動脈瘤瘤口常累及分支動脈,為了維持分支動脈血流,在支架輔助栓塞時,常不得不采用成籃技術疏松填塞動脈瘤腔而出現(xiàn)動脈瘤栓塞不完全、復發(fā),且Y型支架的特點使得對于復發(fā)的動脈瘤再次介入治療難度非常高[24]。
TBA動脈瘤的Y型支架輔助彈簧圈栓塞的重要意義不在于使栓塞更致密、更完全,而在其支撐、保護分支血管成型和頂端血流重建作用,避免彈簧圈突入分支導致嚴重的TOBS。PulseRider裝置(Pulsar Vascular)作為一種新型的分叉部動脈瘤輔助栓塞器材,設計理念印證了這一想法,PulseRider技術比Y型支架具有放置過程相對簡單、僅頂端動脈瘤瘤頸支撐部覆蓋金屬、可回收重新放置、對分支血管內膜刺激小的特點,其治療的安全性及有效性也得到肯定[25-26]。
即使有保護裝置,也不代表可以無顧忌地追求動脈瘤完全栓塞,追求完美而進行致密填塞可能會出現(xiàn)過度栓塞、瘤頸處壓力過大,甚至出現(xiàn)彈簧圈整團或部分移位導致支架塌陷、彈簧圈進入支架,造成分支狹窄、血栓形成甚至閉塞(圖1),在動脈瘤頂栓塞后若由于栓塞效果未達到相對滿意,應在之后每次彈簧圈填塞后造影,若出現(xiàn)血管閉塞等并發(fā)癥立即搶救,這種情況可以采用球囊預保護。Guenego等[27]就報道將新型同軸雙腔球囊導管(COP2L)應用于介入栓塞術中發(fā)生的穿支動脈閉塞與血栓形成的搶救,這種導管可以兼容多種支架輸送系統(tǒng),可以作為血栓栓塞或出血事件的預保護措施。
有學者報道將pCONus、pCANvas等應用于分叉部動脈瘤輔助栓塞取得不錯效果[28-29],pCONus支架基于Solitaire AB,遠端由兩股交叉尼龍纖維構成,周圍有4個類似花瓣樣結構,這些瓣在輸送至動脈瘤腔內部后部分分布在瘤頸,起到固定和輔助栓塞的作用,pCANvas支架是在pCONus的遠端瓣上覆膜,以達到阻斷動脈瘤內血流的作用,Perez等[30]通過測量動脈瘤的平均流的振幅比(MAFA)發(fā)現(xiàn)pCANvas相比于pCONus可以明顯減少動脈瘤腔內的血流。其他的分叉部寬頸動脈瘤栓塞裝置如WEB動脈瘤囊內栓塞裝置,在諸多外文報道中發(fā)現(xiàn)其在隨訪過程中出現(xiàn)變形壓縮、瘤頸殘留,對分叉部動脈瘤的栓塞中長期效果不佳[31-32]。
2.2 PCA動脈瘤的治療進展和思考
在P1段寬頸、夾層動脈瘤,多采用支架輔助栓塞,由于P1段存在諸多穿支動脈,且半數(shù)以上的丘腦穿動脈為雙側性分布,故單支穿通支閉塞引起TOBS的發(fā)病率和病損程度由于代償而降低,支架輔助栓塞導致TPA閉塞引起臨床癥狀一般不嚴重,但AOP等存在雙側供血特點,應特別注意動脈瘤瘤頸附近有無Perchreon動脈存在,在進行栓塞時若存在單支AOP發(fā)出諸多小穿支或對側TPA的血供不明確時,不能閉塞該動脈,否則會引起嚴重的TOBS甚至致死,Perchreon動脈較其他穿支粗,可采用導管、導絲保護技術,將微導管/導絲在栓塞前預先置于穿動脈內,再行動脈瘤瘤頂?shù)氖杷伤ㄈ⒁獬苫@方向不要朝穿動脈發(fā)出方向,再使用單或多支架覆蓋瘤頸,這樣既保存穿動脈血供,又降低動脈瘤復發(fā)出血的可能性。支架微導管存在順應性差、不易到位等缺點,LVIS Jr支架可以用于管徑更小的微導管,使得遠端血管的到位及支架放置難度大大降低[33],在發(fā)現(xiàn)動脈瘤瘤頸周圍存在穿支血管時,還可以通過“燈籠”和/或“壓縮”技術,調整支架對于瘤頸及周圍血管的金屬覆蓋率,重塑瘤頸形態(tài)以達到保護穿通支及動脈瘤栓塞的目的,可以應用于P1段及P2段寬頸、夾層動脈瘤,但應注意PCA血管直徑較小,應注意選擇適宜支架,LVIS支架在小血管中會被拉長,改變金屬覆蓋率后可能導致血栓事件及周圍穿支閉塞可能[34],這更強調了術后嚴格抗血小板凝集的重要性,美國食品藥品監(jiān)督管理局(FDA)2010年曾聲明:氯吡格雷代謝減低者,抗血小板治療效益降低[35],故對于顱內支架輔助栓塞的患者,應常規(guī)行CYP2C19基因檢測,對于攜帶功能減少類型基因者,可加量使用氯吡格雷或更換其他抗血小板凝集類型藥物如替格瑞洛[36]。
大部分P2段分支及穿支有豐富的側支循環(huán),閉塞后少有嚴重的缺血癥狀,在微導管無法超選擇或診斷為假性動脈瘤時,通常選擇載瘤動脈閉塞[36-37],但相關文獻并未報道閉塞血管的具體位置(P2A或P2P),根據(jù)相關解剖文獻,丘腦膝狀體動脈多從P2段中后發(fā)出且存在諸多側支,當存在胚胎型大腦后動脈時,原P1段的穿通動脈由何處發(fā)出,是否存在穿通支發(fā)出位置變異等尚無相關解剖學研究,Xu等[38]認為存在胚胎型大腦后動脈時進行閉塞載瘤動脈是非常危險的,應在術前行閉合試驗及造影觀察周圍血管側支及軟腦膜動脈對載瘤動脈供血區(qū)域代償?shù)龋]合試驗也存在假陽性、患者煩躁不配合,有學者在栓塞術前行P2段遠端的搭橋術,但患者依然有可能因供血動脈流量過小而導致腦卒中[39]。有報道在PCA的P2段及遠端PCA使用導管栓塞裝置(pinpeline embolization device,PED),PED裝置對于梭形動脈瘤等是安全有效的,伴較低的分支動脈閉塞率,缺點是其管徑最小2.5 mm,放置后小的血栓形成可能導致嚴重的血栓事件,有報道PED用于伴有胚胎型大腦后動脈的動脈瘤栓塞時,動脈瘤栓塞效果不佳[40]。
2.3 小腦上動脈
由于小腦上動脈與其他小腦供血動脈及基底動脈等存在豐富的側支循環(huán),出現(xiàn)遠端超選擇插管困難等導致無法精確栓塞動脈瘤時,可以行小腦上動脈閉塞,但大多數(shù)SCA動脈瘤位于基底動脈-小腦上動脈起始部,甚至可見SCA發(fā)自動脈瘤瘤頸,故多使用支架輔助彈簧圈后釋放技術栓塞動脈瘤,在栓塞中應注意動脈瘤成籃方向,盡量避免栓塞SCA引起嚴重的腦干癥狀。
TOBS作為TBA及其分支血管動脈瘤血管內治療及手術治療的嚴重并發(fā)癥,在諸多文獻中提及,供應丘腦、腦干、中腦的穿通支血管閉塞是引起嚴重致殘、致死事件的主要原因,術中通過造影(3DDSA等)識別穿動脈并預估穿通動脈損傷和支架輔助栓塞后的抗凝治療十分重要。隨著顱內介入手術技術的發(fā)展和成熟,穿動脈保護愈來愈受到術者重視,對于TBA解剖研究的深入以及介入方法、器材的進步,可以有效減少甚至避免TOBS的發(fā)生,尤其是特殊類型如胚胎型大腦后動脈動脈瘤的介入治療及TOBS的介入治療有望得到解決。

