BMP-2體外誘導小鼠皮膚成纖維細胞向成骨細胞分化的可行性探討
李波翰,趙乾,劉斌,高春正,吳東進,趙延英,潘霄瀚,張穎哲
(1山東大學第二醫院,濟南250033;2山東大學附屬濟南市中心醫院;3日本和歌山縣立醫科大學)
骨不連與骨缺損為骨折愈合過程中較難解決的并發癥之一。組織工程為治療該疾病提供了理想途徑,展現出良好的前景。間充質干細胞因多效性、旁分泌作用和免疫調節特性而成為組織工程和再生醫學的理想干細胞候選體。研究表明,骨形態發生蛋白-2(BMP-2)在韌帶骨化過程中起重要作用[1]。韌帶主要為成纖維細胞,體外實驗應用BMP-2是否能成功誘導成纖維細胞向成骨細胞分化,可為韌帶骨化進程提供相關實驗依據。新生小鼠成纖維細胞能夠自我復制,也在理論上具有多向分化的潛力[2],將成纖維細胞誘導向成骨細胞分化,并能有效表達BMP-2,則可考慮應用成纖維細胞代替間充質干細胞,作為治療骨不連與骨缺損的種子細胞之一[3]。2017年10月~2018年3月,本研究探討了BMP-2體外誘導小鼠皮膚成纖維細胞向成骨細胞分化的可行性。
1 材料與方法
1.1 材料 實驗動物:清潔級新生3 d小鼠(不分雌雄)3只,體質量1~2 g,昆明種,購自山東大學齊魯醫學院動物中心。主要試劑與儀器:DMEM培養基、澳洲胎牛血清、0.25%胰蛋白酶溶液均購自美國Hyclone公司,雙抗(青霉素與鏈霉素)購自山東大學第二醫院,茜素紅S購自Sigma-Aldrich公司,BMP-2、BMP-2兔抗鼠抗體和辣根過氧化物酶標記的羊抗兔抗體購自北京博奧森生物技術有限公司。
1.2 成纖維細胞的培養 每100 mL細胞培養液由DMEM培養基90 mL和10%胎牛血清10 mL組成,培養液內再加入適量1%雙抗溶液。取新生3 d小鼠,應用脊椎脫臼法處死,75%乙醇消毒,剪下小鼠背部皮膚,去除皮下組織,將皮膚剪成大小約2 mm×2 mm的組織塊,然后放入培養皿中,滴加配制完成的細胞培養液,使培養液剛沒過組織塊。然后將培養皿置于37 ℃、5% CO2孵箱中培養。
1.3 成纖維細胞向成骨細胞分化的誘導 將BMP-2加入配制完成的細胞培養液中,調整濃度至50 μg/L。將培養至第4代的成纖維細胞,加入含有BMP-2的細胞培養液[4]。培養12 d,每日觀察細胞形態變化,應用反復貼壁法[5]純化成骨細胞。
1.4 成纖維細胞向成骨細胞分化的鑒定 ①細胞形態觀察:定期觀察培養皿中細胞形態變化,并拍照記錄。②鈣結節檢測:采用茜素紅染色,茜素紅可與鈣鹽結合生成復合物,鈣結節被染色呈深橘紅色。含有BMP-2細胞培養液培養6、8、10、12 d進行茜素紅染色。吸出培養液,用PBS浸洗,用75%乙醇室溫下固定1 h,再次用PBS浸洗,茜素紅溶液室溫下染色20 min,用PBS沖洗多余的染色劑,置于顯微鏡下觀察,并用Image J進行半定量分析。③BMP-2表達檢測:采用免疫熒光法,將成纖維細胞以及誘導后12 d的成纖維細胞分別接種于載有玻片的12孔板上,每孔約1 mL。PBS浸洗,4%多聚甲醛固定細胞爬片15 min,PBS浸洗,0.5% Triton X-100破膜,PBS浸洗,在玻片上滴加山羊血清,室溫封閉30 min,每張玻片滴加一抗并放入濕盒,4 ℃孵育過夜,第2天加熒光二抗,避光孵育,PBST浸洗,濕盒中孵育1 h,PBST浸洗,滴加DAPI對標本進行染核,PBST浸洗,用含抗熒光淬滅劑的封片液封片,熒光顯微鏡下觀察。
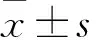
2 結果
2.1 細胞形態觀察 倒置相差顯微鏡下觀察,2 d即有細胞從組織塊邊緣游出,并以組織塊為中心呈放射狀排列。細胞形態呈梭形,細胞核顯示清晰呈圓形或橢圓形,偶見少量扁平多角上皮樣細胞存在,但逐漸消失。加入含有BMP-2的細胞培養液后,細胞形態逐漸發生變化,細胞形態呈梭形、多角形等多種形態,細胞胞質豐富,可見多個黑色顆粒樣物質沉積于胞質內。見圖1、2。
2.2 鈣結節檢測 含有BMP-2細胞培養液培養6 d后茜素紅染色可見極少量被染成深橘紅色的結節樣物質;培養8、10 d后,茜素紅染色被染成深橘紅色的結節樣物質逐漸增多;含有BMP-2細胞培養液培養12 d,茜素紅染色可見大量被染成深橘紅色的結節樣物質。見圖3。含有BMP-2細胞培養液培養6 d后茜素紅染色測定染色面積比例為0.30%;培養8 d后染色面積比例為0.75%;培養10 d后染色面積比例為2.42%;培養12 d后染色面積比例為17.61%。培養12 d后,茜素紅染色面積與其他三個時間點比較,差異有統計學意義(P均<0.05)。
2.3 BMP-2表達檢測 未用含有BMP-2的細胞培養液培養的成纖維細胞免疫熒光檢測,未發現明顯綠色熒光的陽性細胞,藍色為被DAPI染色的細胞核。見圖4。應用含有BMP-2的細胞培養液培養12 d后的成纖維細胞免疫熒光檢測,可見大量含有綠色熒光的陽性細胞,藍色為被DAPI染色的細胞核。見圖5。
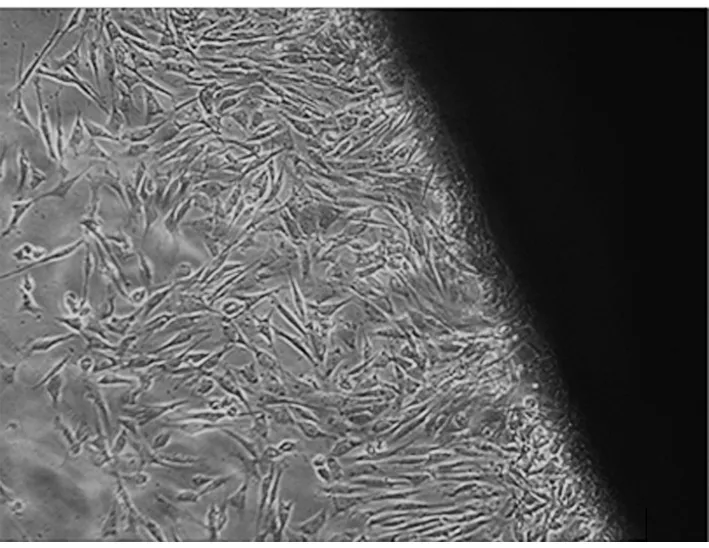
圖1 培養2 d即有大量細胞自組織塊游出(×100)
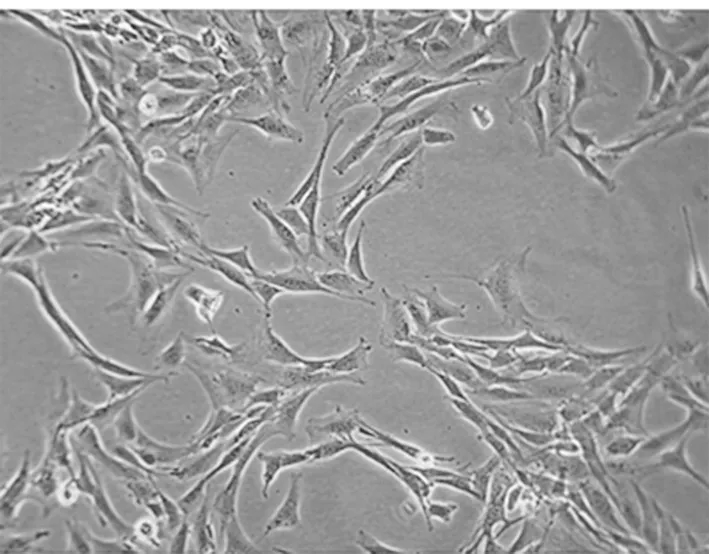
圖2 加入成骨誘導液培養后細胞形態觀察(×100)
注:a為含有BMP-2細胞培養液培養6 d茜素紅染色結果;b為培養8 d茜素紅染色結果;c為培養10 d茜素紅染色結果;d為培養12 d茜素紅染色結果。
圖3茜素紅染色結果(×40)
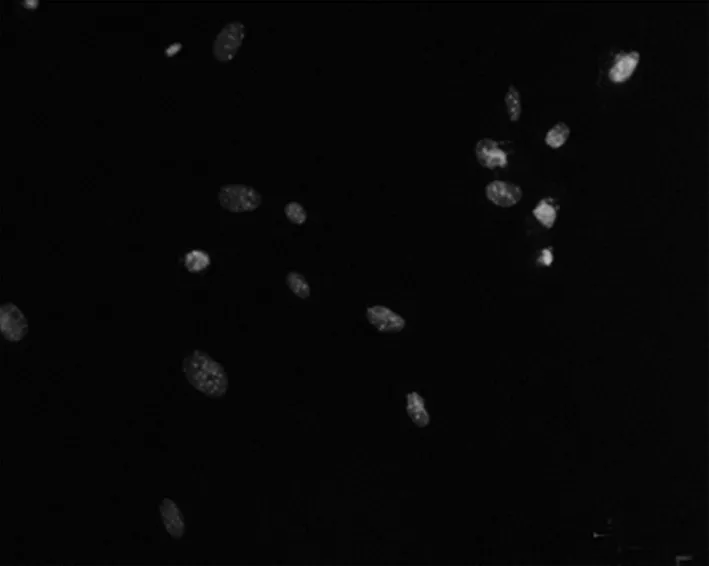
注:未發現明顯綠色熒光的陽性細胞。
圖4未用含有BMP-2的細胞培養液培養的成纖維細胞(×200)

注:可見大量含有綠色熒光的陽性細胞。
圖5用含有BMP-2的細胞培養液培養的成纖維細胞(×200)
3 討論
隨著年齡增長,越來越多人群出現脊柱韌帶骨化現象,并長期飽受疾病痛苦。韌帶骨化的機制仍不十分明確。大多數學者認為,脊柱韌帶骨化是基因與內、外環境共同作用的結果[6]。經過大量實驗研究表明,BMP在體內成骨過程中扮演重要角色[7]。因此通過研究新生小鼠皮膚成纖維細胞誘導向成骨細胞分化的可能性,模擬韌帶成纖維細胞骨化的過程。本研究結果也表明,在一定濃度的外源性BMP環境中,隨著時間遷移,新生小鼠皮膚成纖維細胞具有向成骨細胞分化的能力。茜素紅染色半定量分析結果顯示,含有BMP-2細胞培養液培養12 d后茜素紅染色面積與6 d、8 d、10 d的染色面積比較,差異有統計學意義。免疫熒光結果顯示,誘導12 d的成纖維細胞質內有明顯BMP-2表達,而正常成纖維細胞未發現有明顯BMP-2表達。研究結果表明,應用成骨誘導液培養12 d后成纖維細胞具有良好的成骨細胞能力。由此脊柱韌帶骨化的可能機制為:韌帶組織附著于骨質上,各種因素導致脊柱退行性變,出現骨質增生,局部環境的BMP含量增加。對于附著骨質的韌帶而言,即外源性BMP增加,而且韌帶受到局部機械刺激增加,可導致成纖維細胞逐漸向成骨細胞分化。已經骨化的成纖維細胞又可作為BMP的來源,引起周圍韌帶成纖維細胞向成骨細胞分化,慢慢演變為某一節段韌帶完全骨化,并引起相應癥狀。
骨折為骨科常見疾病,BMP-2在骨折愈合過程中對骨形成具有重要作用[8]。有研究表明,BMP-2作為骨折患者手術干預的補充可有效地促進骨折愈合、降低感染率[9,10]。創傷性骨折后,尤其局部軟組織損傷嚴重者,骨折斷端周圍組織血供受到破壞,骨折愈合過程中所需物質的供應減少,造成骨折延遲愈合或是不愈合,即形成骨不連甚至骨缺損,為骨折研究領域較難課題。骨組織工程學的出現,為治療骨不連或是骨缺損提供了良好的發展前景。研究表明,多種細胞均可作為骨組織工程的種子細胞,向成骨細胞誘導分化,并有效表達BMP-2。但有些細胞培養成本較高,取材較為困難。找到存在廣泛并具備向成骨細胞分化能力的細胞是本次研究的主要方向。成纖維細胞在體內廣泛存在,尤其皮膚含有大量成纖維細胞;而且該細胞易于培養,成本較低。有研究表明,韌帶成纖維細胞和牙齦成纖維細胞均具備向成骨細胞分化的能力[11,12]。牙齦成纖維細胞容易被采集,培養成活率較高,經過成骨誘導后能夠表達BMP-2,但是牙齦成纖維細胞向成骨細胞分化能力較弱,不能十分高效地表達BMP,對影響骨代謝的細胞因子反應性較差[13,14]。本研究從形態學觀察發現,培養液中加入成骨誘導液后,細胞具備成骨細胞形態。鈣結節茜素紅染色以及免疫熒光檢測結果表明,誘導后的細胞具備成骨細胞生物學特征,能夠有效表達BMP-2并分泌相關物質形成礦化結節。因此皮膚成纖維細胞也具備向成骨細胞分化的能力,由于存在廣泛易于培養,可考慮將皮膚成纖維細胞作為骨組織工程種子細胞之一研究骨不連或是骨缺損的治療。本次實驗僅研究在BMP外環境因素誘導下皮膚成纖維細胞成功向成骨細胞分化并檢測BMP-2定性表達,未研究細胞成骨分化后BMP-2的定量表達、BMP誘導成纖維細胞向成骨細胞分化的具體機制以及是否有其他重要細胞因子參與,這些問題尚待進一步研究。
綜上所述,本研究表明新生小鼠皮膚成纖維細胞具有向成骨細胞分化的能力,皮膚成纖維細胞有可能作為骨組織工程的種子細胞修復骨不連或骨缺損。

