線栓法制備SD大鼠局灶性腦缺血再灌注模型的實踐與評價*
甘 雨,馬 進,袁 媛,喬 敏,包玉龍,王 菲
遼寧省中醫(yī)藥研究院,遼寧 沈陽 110034
近年來,缺血性腦血管疾病發(fā)生率、致殘率和死亡率逐年攀升,探究其發(fā)病機制,尋找有效的治療藥物具有重要的現(xiàn)實意義,而制備理想、穩(wěn)定的動物模型是研究該類疾病的重要途徑。目前,制備局灶性腦缺血動物模型的方法有多種,包括開顱機械閉塞法、微栓子栓塞法、氣囊栓塞法、光化學誘導血栓形成法、線栓法等[1]。其中線栓法因具有不開顱、創(chuàng)傷小、梗塞部位明確、缺血及再灌注時間可控等優(yōu)點[2],而成為國內外學者廣泛應用的良好載體,現(xiàn)將線栓法模型效果及制作經驗報告如下:
1 材料與方法
1.1實驗動物SPF級SD大鼠,雄性,體質量260~280 g,由遼寧長生生物技術有限公司提供,許可證號:SCXK(遼)2015-0001。飼養(yǎng)于遼寧中醫(yī)藥大學附屬第二醫(yī)院實驗動物中心,實驗動物許可證號:SYXK(遼)2012-0003,溫度 20~23℃,相對濕度 50%~60%。
1.2主要試劑與儀器水合氯醛(國藥集團化學試劑有限公司,批號:20150508);2,3,5- 氯化三苯基四氮唑(TTC,國藥集團化學試劑有限公司,批號:20150310);4%多聚甲醛(北京索萊寶科技有限公司,批號:20151214);栓線(北京西濃科技有限公司,產品貨號:2838-4A);JKDP-2型電熱培養(yǎng)恒溫箱(廈門醫(yī)療電子儀器廠)。
1.3實驗方法
1.3.1 分組 將SD大鼠44只隨機分為假手術組18只和模型組26只。
1.3.2 模型制備 參照Longa等[3]及文獻[4]方法,采用線栓法制備大鼠局灶性腦缺血再灌注模型。3%水合氯醛[300 mg/kg(體質量)]腹腔注射麻醉大鼠,將大鼠仰臥位固定于操作臺上,頸前區(qū)消毒,采用頸部正中縱行切口,鈍性分離肌肉及筋膜,充分暴露右側頸總動脈(CCA),仔細分離迷走神經。再依次剝離頸外動脈(ECA)和頸內動脈(ICA)。結扎ECA,夾閉ICA,再結扎CCA,于CCA分叉部下方約10 mm處剪一小口,插入線栓,松開夾閉ICA的微動脈夾,將線栓緩慢送入ICA,直至遇有輕微阻力為止,此時線栓插入深度(18.0±0.5)mm。外留線栓涂黑(便于再灌注時拔線),縫合切口。2小時后行再灌注,即將線栓抽至CCA內,大腦中動脈恢復血供。假手術組不插入線栓,頸部手術及血管處理同模型組。
1.4評價指標
1.4.1 神經行為學評分 分別于術后2小時及3、7、14天觀察大鼠行為和神經功能狀況,并參照文獻[5]方法對大鼠神經功能障礙進行評分。0分:活動正常,無神經功能缺陷;1分:提尾懸空時,左側前肢內收,不能完全伸展;2分:爬行時身體向左側旋轉(追尾征);3分:爬行時身體向左側傾倒;4分:無法自發(fā)行走并伴有意識水平下降。模型組評分1~3分者納入研究,同時排除蛛網(wǎng)膜下腔出血和未到觀察時間點死亡大鼠。
1.4.2 腦梗死面積比測定 分別于術后3、7、14天2組各取3只大鼠,麻醉后斷頭取腦,腦組織置于-20℃冰箱中冷凍20分鐘,去除嗅球、小腦和低位腦干。自額極每間隔2 mm連續(xù)做5個腦組織冠狀切片,分別為 A、B、C、D、E 片,迅速置于2%TTC溶液中,37℃恒溫避光孵育30分鐘,期間每5分鐘翻動1次。染色后拍照,置4%多聚甲醛溶液中固定。以最大缺血斷面C片計算腦梗死面積百分比,用Image J 1.47圖像分析軟件計算C片梗死區(qū)面積和非梗死區(qū)面積,為避免右側大腦因缺血性水腫帶來的誤差,采用Swanson法計算梗死面積百分比。腦梗死面積百分比=(S1-Sr)/2S1×100%(S1:C片健側總面積;Sr:C片患側非梗死區(qū)面積)。
1.5統(tǒng)計學方法采用SPSS 17.0統(tǒng)計軟件分析數(shù)據(jù),計量資料以(±s)表示,采用t檢驗,計數(shù)資料采用χ2檢驗,P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1神經行為學評分與死亡率假手術組大鼠全部存活。模型組大鼠術中死亡3只,術后1~3天死亡3只,術后4~7天死亡2只,總死亡率為29.6%(8只死亡動物未列入神經行為學評分的統(tǒng)計分析)。假手術組大鼠死亡率低于模型組(χ2=4.86,P<0.05)。假手術組大鼠各時間點神經行為學評分均為0分。模型組大鼠不同時間點神經行為學評分均高于假手術組,差異有統(tǒng)計學意義(P<0.01),見表1。
表1 2組大鼠術后不同時間點神經行為學評分比較(±s) 分

表1 2組大鼠術后不同時間點神經行為學評分比較(±s) 分
組別 只數(shù) 術后2小時 術后3天 術后7天 術后14天假手術組 18 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00模型組 18 1.94±0.80 1.61±0.78 1.50±0.67 1.33±0.52 t 10.29 8.76 7.76 6.27 P<0.01 <0.01 <0.01 <0.01
2.2 TTC染色觀察與腦梗死面積比測定經TTC染色后,假手術組大鼠腦組織左右半球均紅染,未見明顯梗死灶(圖1-A);模型組大鼠右側大腦半球有局限的缺血梗死灶(蒼白區(qū)域),主要分布在額葉、頂葉、部分顳葉皮層。模型組大鼠術后不同時間點腦梗死面積百分比與假手術組同期比較差異均有統(tǒng)計學意義(P<0.01),見表2、圖1。
表2 2組大鼠術后不同時間點腦梗死面積百分比(±s) %
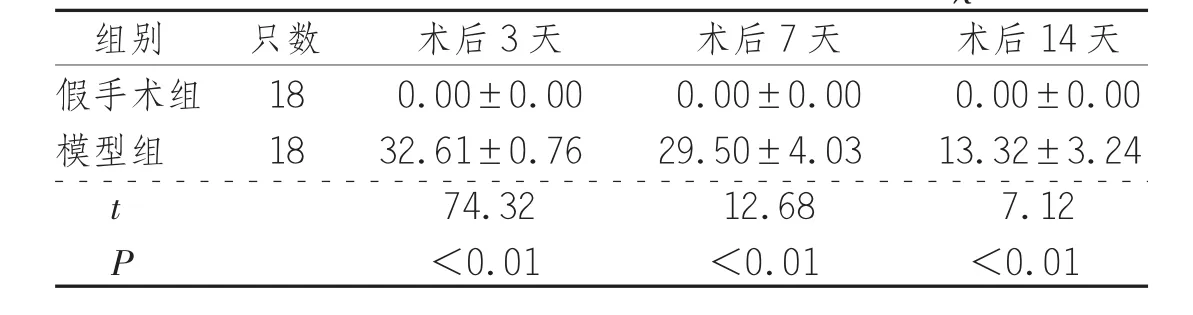
表2 2組大鼠術后不同時間點腦梗死面積百分比(±s) %
組別 只數(shù) 術后3天 術后7天 術后14天假手術組 18 0.00±0.00 0.00±0.00 0.00±0.00模型組 18 32.61±0.76 29.50±4.03 13.32±3.24 t 74.32 12.68 7.12 P<0.01 <0.01 <0.01
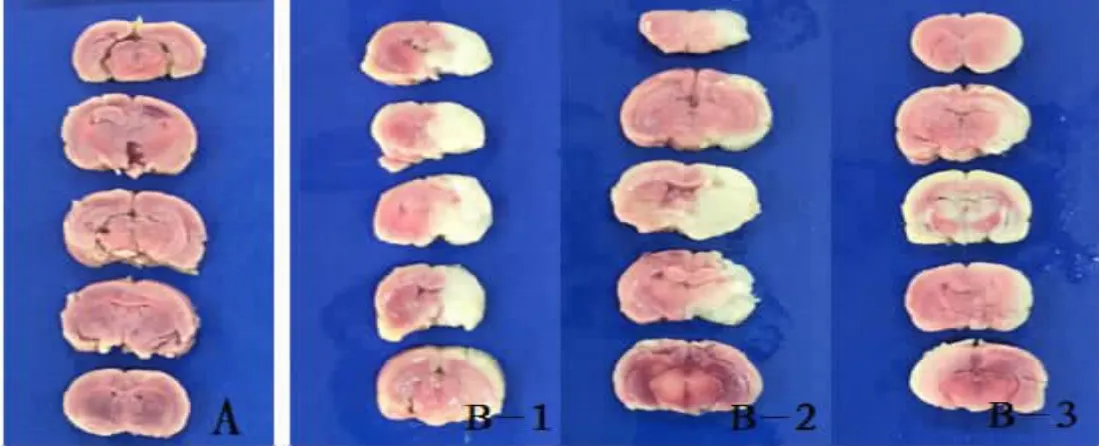
圖1 2組大鼠術后不同時間點腦梗死面積(TTC染色)
3 討論
自上世紀八十年代,Koizumi J等[6]首創(chuàng)不開顱經CCA插入線栓制備大腦中動脈閉塞缺血模型以來,經30余載不斷改進,目前已成為實驗性腦缺血研究最常用的造模方法。但該法仍不盡完善,如:制備過程復雜,手術難度大;動物品系及體質量要求嚴格;穩(wěn)定性欠佳,易受栓線種類、規(guī)格、頭端處理等諸多因素影響,想制備穩(wěn)定性好、可靠性高的模型尚存在一定困難[7]。本研究選用SD大鼠,采用經頸總動脈遠端插線的方法制備大鼠腦缺血再灌注模型。結果顯示用此法制備腦缺血再灌注模型具有缺血部位恒定、可靠性高等特點。
3.1 線栓的選擇線栓是決定模型制備成功與否的關鍵,線栓的直徑、硬度、弧度及頭端處理是重要影響因素[8]。本研究選用北京西濃科技有限公司生產的2838-4A型線栓,該線栓為單絲尼龍線,頭端燒熔為半球形,前端包被多聚賴氨酸,直徑(0.38±0.02)mm,由于其直徑均一,弧度及硬度適中,大大提高了模型制備的成功率和腦缺血范圍的穩(wěn)定性,同時也節(jié)約了線栓制作及精選的時間,為快速、優(yōu)質完成研究提供了保障。
3.2 大鼠的選擇大鼠的品系和體質量是影響模型成功與否的重要指標[9]。SD大鼠腦血管解剖特點與人類相似,生理機能變異較小,梗死灶恒定,重復性好。大鼠體質量偏小(250 g以下),頸動脈較細,插線困難,且易損傷血管;體質量偏大(300 g以上),顱內動脈較粗,不能完全阻塞大腦中動脈[10]。因此,體質量260~280 g的SD大鼠血管變異小,生命耐受力強,實驗易于控制。
3.3插線的技巧ECA和ICA要充分暴露,結扎ECA盡量靠近分叉處,而夾閉ICA盡量靠近遠端,當打開微血管夾時,在ICA的栓線足夠長可避免血流將栓線從血管內沖出。插線時鼠頭部歪向左側,使栓線的弧面朝向內上方,大概與水平面呈45°,有利于進線。
3.4插線的深度在術前準備時用細標記筆在18 mm處作標記,進線時遇到阻力,倘若已達到18 mm,立即停止進線,以免造成蛛網(wǎng)膜下腔出血;倘若不足18 mm,應緩慢退出2~3 mm,調整栓線的角度再進線。
3.5線栓外留殘端處置殘端最好涂上黑色,拔線時更容易分辨,殘端要盡量保留長一些,因為大鼠清醒便開始活動,易使殘端縮進肌肉內。另外拔出線栓動作要輕柔,防止拉斷血管而無法再灌注或全部拔出造成大出血。
總之,要建立理想、穩(wěn)定和可靠的標準化腦缺血再灌注模型,必須注重細節(jié),不斷總結經驗。本研究對Longa法制作的大鼠局灶性腦缺血模型作了一些改進,并通過神經行為學、TTC染色觀察進行驗證,獲得了滿意的效果,可為研究缺血性腦血管疾病的發(fā)病過程及治療藥物評價提供保障。

