膀胱尿路上皮癌組織中樁蛋白的表達變化及意義
姚佳沛,劉煒,徐建春,李顥
(昆明醫科大學第一附屬醫院,昆明 650031)
全球范圍內膀胱癌的發病率位居惡性腫瘤的第9位,膀胱尿路上皮癌(BUC)是最常見的類型[1]。BUC依照是否發生肌層浸潤可分為浸潤性尿路上皮細胞癌與非浸潤性尿路上皮細胞癌。BUC組織學形態多樣,臨床上已見多種變異型,形態學上可近似良性病變,為病理醫生的鑒別診斷增加了難度;同時有些變異型BUC侵襲性較普通型更高,更需要加強監測謹慎制定治療方案[2]。近年來,盡管以外科手術為代表的腫瘤治療手段飛速發展,但BUC患者
的預后并沒有得到顯著的改善,患者術后5年生存率在50%~60%[3]。新的診療手段,例如BUC特異性腫瘤標記物,可能是未來發展的方向。樁蛋白作為一種分布廣泛的信號蛋白,是近年學者們研究的熱點之一。樁蛋白家族包括樁蛋白、過氧化氫誘導的克隆5與Leupaxin[4]。樁蛋白在體內的作用范圍最為廣泛,其能夠激活局部黏著斑激酶(FAK)信號通路,從而調節細胞的黏附和轉移[5],因此推測樁蛋白可能與腫瘤的形成與發展有關。近年來的研究[6~8]表明,樁蛋白與多種腫瘤密切相關,但樁蛋白在BUC的起病與發展過程中的作用目前尚不明確。本研究觀察了BUC組織中樁蛋白的表達變化,并探討其臨床意義。
1 資料與方法
1.1 臨床資料 選取2012年9月~2015年12月昆明醫科大學第一附屬醫院收治的BUC患者93例,男71例,女22例;年齡51~73(59±8.17)歲,其中≤60歲34例、>60歲59例;腫瘤直徑(3.41±2.17)cm,其中≤3 cm 27例,>3 cm 66例;組織低分化42例,高分化51例;臨床分期T1~T2期44例,T3~T4期49例;有淋巴結轉移25例,未發生淋巴結轉移68例。納入標準:①臨床病歷資料完整,所有患者均知情同意;②術后經病理科確診為BUC;③為原發性BUC,且未合并其他惡性腫瘤;④術前未經放、化療及其他輔助抗腫瘤手段治療;⑤未合并其他嚴重代謝性疾病;⑥完成隨訪調查。手術留取BUC組織93例份(觀察組),另取37例份正常膀胱組織作為對照(對照組)。
1.2 樁蛋白檢測方法 采用免疫組化法。將保存的石蠟包埋標本以間距4 μm連續切片,烤箱中65 ℃烤片過夜,常規脫蠟水化,枸櫞酸緩沖液中煮沸(95 ℃)修復,自然冷卻后以TBS洗滌2次,以正常山羊血清封閉,孵育30 min,加入一抗樁蛋白單克隆抗體(CST,購于上海北諾生物科技有限公司),陰性對照采用PBS代替,于4 ℃孵育過夜。TBS洗滌3次,加入二抗EnVisionTM+/HRP(DAKO,購于上海北諾生物科技有限公司)37 ℃孵育30 min;DAB顯色,蘇木素復染。常規制片。結果判定:300倍光學高倍鏡下取4個不同視野,每個視野至少含有100個細胞,4視野的計分結果取算術平均數。將染色結果計分分為染色程度計分與染色數目計分,染色程度計分:無染色計0分,淺黃至黃色計1分,黃棕色計2分,褐色計3分;染色數目計分:<5%計0分,5~25%計1分,25%~75%計2分,>75%計3分;程度計分×數目計分得到染色結果總分,其中0~3分視為陰性表達,>3分視為陽性表達。
1.3 隨訪方法 以患者術后出院為觀察起點,利用電話、電子通訊等手段并結合患者復診記錄進行隨訪調查,隨訪9~62(39.14±8.62)個月。失訪病例已剔除。
1.4 統計學方法 采用SPSS22.0統計軟件。計數資料比較采用χ2檢驗,利用Kaplan-Meier生存曲線分析患者生存率與生存時間。P<0.05為差異有統計學意義。
2 結果
2.1 兩組樁蛋白表達比較 觀察組及對照組樁蛋白陽性率分別為50.54%(47/93)、0,兩組比較,P<0.05。
2.2 樁蛋白表達與BUC臨床病理參數的關系 結果見表1。由表1可知,樁蛋白表達與BUC組織分化程度、臨床分期、是否發生淋巴結轉移有相關性(P均<0.05),而與患者年齡、性別、腫瘤直徑無相關性(P均>0.05)。
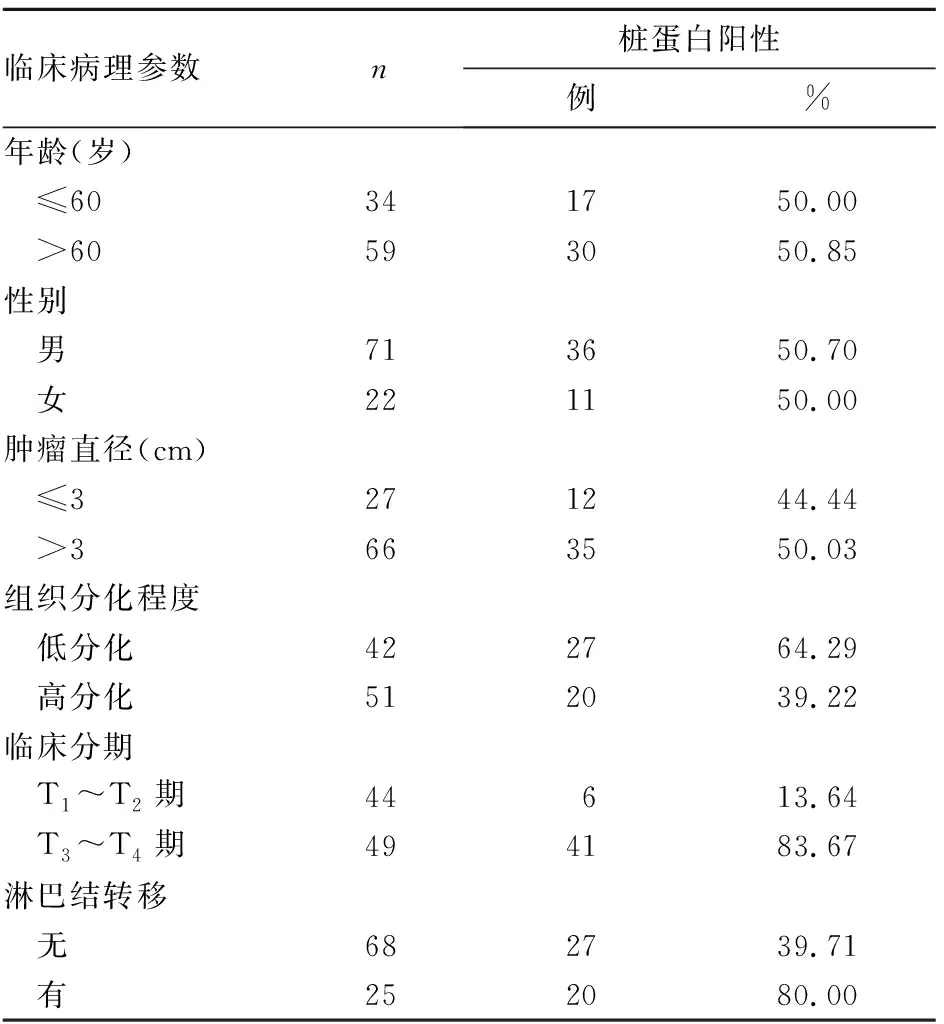
表1 樁蛋白表達與BUC臨床病理參數的關系
2.3 樁蛋白表達與BUC患者預后的關系 觀察組患者按照樁蛋白表達結果分為樁蛋白陽性表達者(47例)與樁蛋白陰性表達者(46例),隨訪調查結果制成Kaplan-Meier生存曲線(圖1)。樁蛋白陽性表達者生存率為59.57%(28/47)、生存時間(43.99±2.57)個月,樁蛋白陰性表達者生存率為84.78%(39/46)、生存時間(54.41±2.24)個月,兩組比較,P均<0.05。
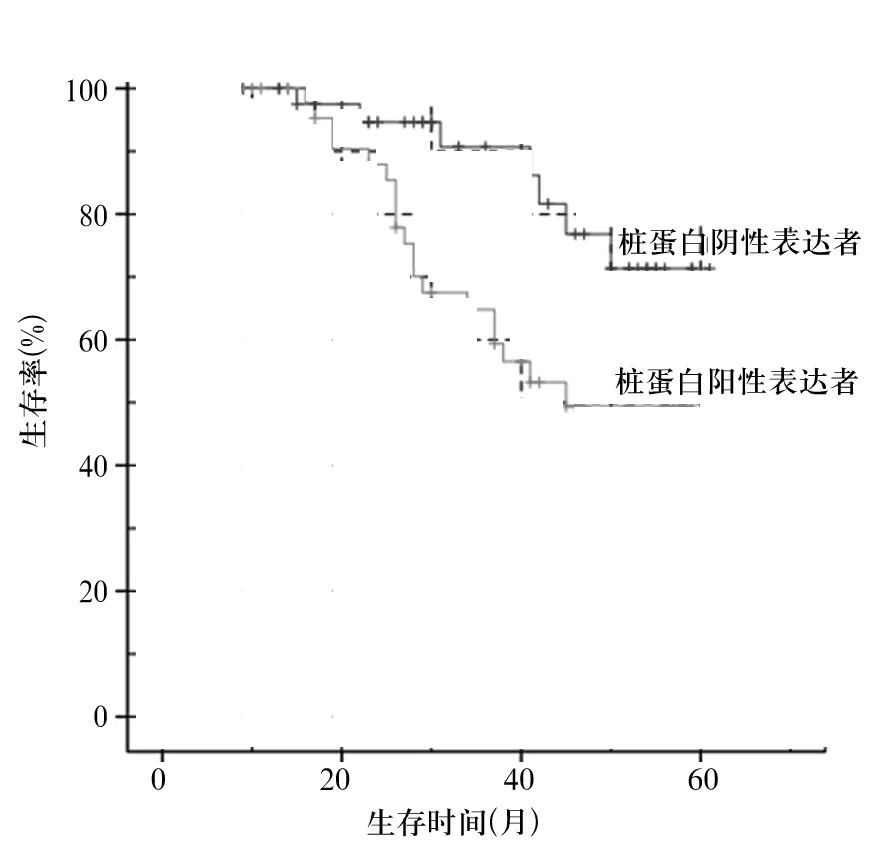
圖1 樁蛋白陽性、陰性表達者Kaplan-Meier生存曲線
3 討論
BUC多起源于上皮細胞,發病初期癥狀不明顯,多為血尿,但可自行減輕或停止,較為隱匿,但惡性程高。在我國,BUC的發病率位居泌尿系統惡性腫瘤之首,也是引發癌癥相關死亡的主要病因之一[9]。BUC存在多種生物學行為,臨床上公認的治療難點在于復發容易,預后診斷難[10]。依據BUC的不同細胞生物學行為,一般將其分為兩種,非肌層浸潤性BUC即表淺性、高分化腫瘤,約占BUC的80%左右,治療相對容易,但也易復發;肌層浸潤性BUC即浸潤性、低分化腫瘤,惡性程度較高,一般需要聯合治療。傳統BUC的治療方案以外科手術切除和放化療為主,但即使聯合應用藥物膀胱內灌注治療、光動力治療等輔助抗腫瘤手段,仍無法明顯降低BUC復發率與病死率,同時聯合方案的不良反應也較大,給患者帶來生理、經濟上的多重壓力[11,12]。近年來,隨著臨床技術的發展,非肌層浸潤性BUC患者能夠選擇膀胱內卡介苗作為主要的免疫治療手段[13];而根治性膀胱切除術為代表的外科手術仍然是治療肌層浸潤性膀胱癌的標準方案,同時該手術對非肌層浸潤性BUC也有一定的療效[14]。合理選擇治療方案一直是影響患者預后與生活質量的關鍵因素。臨床上一般依據臨床分期、淋巴結轉移等傳統腫瘤相關病理參數估計[15]。然而,許多臨床病理參數相似的患者術后生存時間差異巨大[16],說明目前的臨床病理參數并不能準確反映患者的情況。盡管近年來BUC的診斷方面有許多進展,例如以熒光原位雜交探針為代表的免疫組化相關病理診斷手段,臨床上已較多地應用于尿液細胞樣本篩查和復發監測[17],但BUC患者的預后卻并沒有得到明顯的改善。因此,深入研究BUC的發生與惡性進展機制,從而指定針對性的診療方案成為改善臨床診療方案的當務之急。
樁蛋白是一種多功能的多結構域蛋白,分子量約68 kD,于SRC基因轉染的細胞中最先被發現,是一種能與癌基因結合的細胞連接相關蛋白[18]。樁蛋白主要表達于細胞黏著斑,在平滑肌組織中表達最高,能夠通過與結構分子、信號分子的連接參與調控細胞黏著斑的結構,從而影響細胞的黏附與遷移[19]。正常表達的樁蛋白是機體內細胞黏附、分化、繁殖等生理活動的必須,但樁蛋白的異常表達會引起細胞形態的改變,引發細胞黏附能力異常,從而引發多種疾病[20]。腫瘤的原位侵襲、遠端浸潤與腫瘤細胞的遷移能力密切相關,而細胞的遷移能力是一個由前黏著斑消失伴隨新黏著斑形成的動態過程,與細胞的黏附力直接相關[21],因此可以推測黏著斑相關的樁蛋白表達必然影響腫瘤細胞的侵襲力。近期研究[22]顯示,由樁蛋白、肉瘤基因(Src)、FAK參與調控的絡氨酸磷酸化作用是細胞非依賴性信號轉導、增殖、轉移的關鍵步驟。而許多細胞因子正是通過Tyr31/118磷酸化樁蛋白,從而促進或調控腫瘤細胞的黏附、遷移[23~25]。因此,樁蛋白具有成為抗腫瘤治療新靶點的可能。Zheng等[26]認為,樁蛋白在前列腺癌組織中較正常組織高表達,其表達與前列腺癌病理分級、淋巴結轉移密切相關,同時樁蛋白表達較高的患者預后較差。另文獻[27~29]報道,樁蛋白在胰腺癌、結直腸癌、乳腺癌等惡性腫瘤中的表達也呈現出類似的作用。因此,初步推測樁蛋白在腫瘤組織中的異常表達與腫瘤的發生、惡性進展密切相關。
本研究顯示,樁蛋白在正常膀胱組織中未見陽性表達,而在BUC組織中陽性率為50.54%,提示樁蛋白在BUC組織中的表達異常上調,與前述其他類型腫瘤組織中同樣顯著升高的效果相似,因此樁蛋白的異常可能與BUC的形成相關。本研究還顯示,樁蛋白表達與BUC臨床分期、組織分化程度、淋巴結轉移密切相關。因此可以推測,樁蛋白在BUC腫瘤細胞中,應當呈現出與其他類型腫瘤細胞中類似的作用,即促進腫瘤細胞上皮-間質轉化,增強腫瘤細胞的侵襲力,樁蛋白可能有潛力成為臨床上反應BUC患者腫瘤惡性程度的生物標記物之一。本研究還發現,樁蛋白陽性表達者的預后顯著差于樁蛋白陰性表達者,提示樁蛋白可以作為BUC患者不良預后的生物標記物。因此,針對樁蛋白表達陽性患者,應加強監護,重視復診,重點防范BUC的術后復發,以盡可能改善患者預后。
總之,BUC組織中樁蛋白表達升高,其可能參與BUC的發生發展。

