動態(tài)對比增強磁共振在腦膠質瘤病理級別中的診斷價值
李運奇 尹先哲 湯 韜 趙智偉
1)南陽市第二人民醫(yī)院醫(yī)學影像科,河南 南陽 473012 2)南陽市第二人民醫(yī)院神經外科,河南 南陽 473012 3)河南科技大學第一附屬醫(yī)院康復科,河南 洛陽 471000
微血管增生是腦膠質瘤一個重要的組織學特征[1-2]。神經膠質瘤微血管通透性在預測病理分級、預后有重要意義[3]。病理分級不同的神經膠質瘤微血管增生的程度不同[4-5]。然而,采用免疫組織化學技術檢測CD105-MVD需要手術或活檢標本,這可能會導致腦組織損傷和抽樣誤差。動態(tài)對比增強磁共振成像(DCEMRI)可以通過分析對比劑分子通過的程度無創(chuàng)評估神經膠質瘤不成熟的微血管的通透性。本文研究DCE-MRI與CD105-MVD水平的關系,探討論在神經膠質瘤中是否可以以非侵入性的方式(如DCE-MRI)評估MVD的程度。
1 資料與方法
1.1一般資料選取回顧分析南陽市第二人民醫(yī)院2014-11—2016-09經臨床或者病理證實為腦膠質瘤患者39例,診斷根據2016年世界衛(wèi)生組織(WHO)分類進行[6]。男25例,女14例,年齡14~70(46±12)歲。病理分級Ⅱ級19例,Ⅲ級11例,Ⅳ級 9例。在接受DCE-MRI檢查之前,所有患者均未接受任何顱內手術、化療或者放療等治療。
1.2方法選擇西門子3.0T超導MR儀,頭部正交線圈,對全部患者實施MRI平掃橫斷和冠狀、矢狀掃描。掃描參數,DCE-MRI使用以下執(zhí)行序列:強化前數據集的獲得采用T1WI作為基線(TR/TE,5.1/1.8 ms;視場角(FOV)240 mm×240 mm;矩陣138×192;掃描厚度、3.6mm),翻轉角度2°和15°。DCE信號收集(TR/TE,4.9/1.9 ms;FOV,240 mm×240 mm;矩陣,138×192;掃描厚度3.6 mm),翻轉角度12°,測量時間間隔為4.29 s。第五個基線數據獲得后,通過肘前靜脈注射釓雙胺注射液(Gd-DTPA-BMA;歐乃影,通用電氣醫(yī)療集團,挪威),注射劑量為0.1 mmol/kg,速度4 mL/s。
1.3數據分析所有數據傳入Siemens工作站,采用血流動力學模型獲得腦組織的時間—信號強度曲線。采用Tofts和Kermode藥代動力學模型計算Ktrans和Ve。通過頸內動脈段信號強度的變化得到動脈輸入函數。通過同步觀測在軸向對比度T1WI成像和相應的Ktrans和Ve參數圖確定Ktrans和Ve值。 ROIs區(qū)域被自動轉移到軸向對比度T1WI成像和Ktrans和Ve參數圖中。每個腫瘤的ROI大小保持不變(半徑4~6 mm)。每個病人測量3次ROIs,選擇三次中Ktrans和Ve最大值。 ROI由神經系統(tǒng)放射人員手工繪制。避開ROIs區(qū)域中的囊性壞死,出血區(qū)域和正常的微血管區(qū)域。
1.4免疫組化染色和診斷39例膠質瘤組織樣本全部經10%甲醛溶液固定,石蠟包埋,切成4 μm厚的組織切片。CD105兔多克隆抗體(Abcam,美國)作為一抗對MVD進行檢測評估,采用鏈霉菌抗生物素過氧化酶(SP)免疫組化法對切片進行染色。顯微鏡下觀察組織切片染色情況,并應用顯微攝像系統(tǒng)進行圖像采集。病理診斷根據2016年WHO分類標準進行。以陽性對照片和PBS代替一抗的陰性對照片進行對照。陽性切片的判斷:微血管出現棕黃色顆粒為染色陽性。用光密度值(OD)表示陽性細胞表達情況。OD值=整合的光密度/構成對象的像素數。
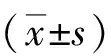
2 結果
2.1 Ktrans、 Ve和CD105-MVD與膠質瘤病理分級的關系低級別膠質瘤(LGG)和高級別膠質瘤(HGG)的平均Ktrans、Ve、CD105-MVD值如表1所示。LGG的Ktrans和Ve明顯低于HGG (P=0.001,P<0.001)。LGG的CD105-MVD明顯低于HGG(P<0.001)。Ⅲ級與Ⅳ級Ktrans、Ve和CD105-MVD無明顯差異。

表1 Ktrans、 Ve和 CD105-MVD與膠質瘤病理分級的關系Table 1 Relationship between Ktrans,Ve and cd105-mvd and the pathological grade of glioma
2.2神經膠質瘤中Ktrans、Ve和CD105-MVD之間的相關分析在高病理級別的膠質瘤(HGG)中Ktrans和Ve都與CD105-MVD呈正相關(r=0.698,P<0.001;r=0.682,P<0.001)。而低病理級別的膠質瘤(LGG)中Ktrans和Ve與CD105-MVD無明顯相關性(圖1)。
3 討論
腫瘤血管生成是神經膠質瘤發(fā)生和發(fā)展中一個關鍵的過程,該過程為腫瘤入侵健康組織提供了充足的氧和營養(yǎng)物質[7-9]。目前,越來越多的研究發(fā)現,基于MVD的組織學方法評價腫瘤血管生成是一個神經膠質瘤患者的獨立預后指[10-14]。目前的一些標記物不能區(qū)分生理狀態(tài)下和病理狀態(tài)下的微血管增殖,如CD31[15-17]、CD34[18-20]、CD3[21-24]、CD20[25-26]和凝血因子Ⅷ[4]。因此,這些標記物的免疫染色得出的MVD不能對微血管生成的程度提供一個準確的估計。CD105是一個共受體,屬于TGF-beta家族,其表達與新生不成熟的微血管有關[12,27-28]。多項研究表明,CD105可能是一個特異的異常微血管生成標記[29-31]。 CD105陽性表示神經膠質瘤微血管程度高,腫瘤惡性程度高[32-34]。這些CD105陽性的微血管通透性大,這會增加血管內容物滲漏到血管外的組織間隙,為神經膠質瘤腫瘤細胞入侵正常組織提供了條件[35-37]。之前有研究已經確定,CD105在星形細胞瘤微血管內皮細胞中陽性表達,CD105-MVD的表達水平與神經膠質瘤病理的等級成正相關[10]。本研究顯示,LGG中CD105-MVD的表達水平明顯低于HGG,HGG中的與腫瘤惡性程度相關的不成熟微血管可能會比LGG更多。Ⅲ和Ⅳ級神經膠質瘤之間的CD105-MVD的表達水平沒有顯著差異。這可能是由于這兩個級別神經膠質瘤中的微血管增生程度類似。臨床上檢測并評估CD105-MVD的表達水平方法復雜且費用高。因此,無創(chuàng)性評CD105-MVD的表達情況從而間接得出不成熟微血管的增生和識別潛在的惡性神經膠質瘤意義非同一般。

圖1 低級別膠質瘤和高級別膠質瘤MRI影像圖比較。A組從左到右依次為:病理級別Ⅱ級的膠質瘤MRI (T1WI) 影像圖,Ktrans影像圖,Ve影像圖;B組從左到右依次為:病理級別Ⅳ級的膠質瘤MRI (T1WI) 影像圖、Ktrans影像圖、Ve影像圖Figure 1 Comparison of MRI images of low grade glioma and high grade glioma.A group from left to right in turn:on the left side of the level of pathological Ⅱ grade of glioma MRI images of (T1WI),images of Ktrans,Ve image;In group B,from left to right,the left pathological grade IV glioma MRI (T1WI) image,Ktranss image and Ve image were successively shown
這些初步結果可以作為進一步驗證的基礎。目前,該項研究還有諸多不足之處。在該項研究過程中,遇到了一些目前無法克服的問題,如DCE-MRI數據處理前需要提前得到動脈輸入函數(arterial input function,AIF),AIF選擇不同的動脈及其ROI選擇位置是否合理,都將顯著影響計算結果[38-39],從而無法準確評估組織微血管特性。最準確的AIF應該是目標區(qū)的直接供血動脈,但由于空間分辨率受限,常常無法觀察到,因此常用掃描范圍內的動脈代替[40]。另外AIF與被檢者自身BMI指數、每搏輸出量有關,因此個體化AIF是最佳選擇,但其對時間分辨率要求較高,提高可重復性是臨床應用的關鍵因素。時間分辨率、空間分辨率較低的情況下,考慮選擇Reference模型或者Population AIF[41]。運動位移在DCE-MRI數據中普遍存在,如:頭頸部,吞咽、舌頭及下顎的活動;肺部及乳腺,呼吸運動、心臟跳動;肝、腎,胃腸蠕動等。AIF曲線由于血管運動不能夠真正反映對比劑進人體內的全過程。病灶邊緣由于運動位移模糊不清,直接影響病灶感興趣區(qū)勾畫,進而對擬合病灶時間一信號強度曲線的真實度及準確度產生誤差[42-44]。因此,運動校準是很有必要的,校準每一個像素點的位置,以保證計算結果的可靠性。
由DCE-MRI 得到的Ktrans和Ve對評估神經膠質瘤微血管通透性來講是一個非侵入性的理想的檢測方式[45-48]。DCE-MRI已經證實HGG的微血管滲透率大于LGG[49]。本研究顯示,LGG的 Ktrans和Ve值明顯低于HGG。神經膠質瘤中不成熟的微血管通透性大,正常成熟的微血管內皮完整,血管內容無或分子的轉移受到有效的限制。
本文顯示,HGG中有更多的不成熟和高滲透性的微血管。但在異常的Ktrans或者Ve信號和病理標本中很難執(zhí)行voxel-by-voxe對比。 因此,不能排除抽樣誤差所造成研究結果偏差的可能性。針對這一點我們假設高的trans和Ve信號代表高度不成熟的MVD腦部區(qū)域,其他區(qū)域依據于此進行比較。
另外在圖像后期處理中,處理軟件所采用都是標準化的模型,該模型簡化了一些數據處理工作,不能很好的評估一些數據的有效性。 如在該項研究中,血管內的血清體積不能很好的被計算出來。采用合適的模型可能會更好地描述一些重要的生理參數和生物效應。但是不同腫瘤類型,腫瘤部位和治療方法最適合的數據處理模型也不一樣[50],因此我們只能采用目前被廣泛認可的標準化模型來進行后期圖像處理。該研究還必須要考慮到等離子體體積的影響,該種影響一般情況下可忽略不計。但是這種影響可能導致在0.05~0.10 mL/g血管等離子體體積的范圍內Ktrans會被略高估值。另一個可能導致數值估偏的原因是基線ROI模版。比如,明顯的腫瘤水腫或早期治療失敗,隨著腫瘤組織體積的增加,最終得到的DCE-MRI圖像可能無法真正的反映腫瘤增殖情況。本研究未觀察到這種情況,然而,非線性注冊方法,如彈性圖像算法可以用于獲取與串行成像研究相匹配的序列或。本研究的另一個局限是樣本量相對較小,需要大規(guī)模的病例研究更客觀地證實灌注量的估計和體內腫瘤狀態(tài)之間的關系。

