基于核酸適配體的鎘離子可視化檢測方法
趙 旭吳世嘉樂 琳王周平,3
(1. 江南大學食品國家重點實驗室,江蘇 無錫 214122;2. 江南大學食品學院,江蘇 無錫 214122;3. 江南大學國際食品安全聯合實驗室,江蘇 無錫 214122)
鎘(Cd)元素是一種生物蓄積性強、毒性持久、具有“三致”作用的劇毒元素,攝入過量的鎘對生物體的危害極其嚴重,會導致腎臟、肝臟、肺部、骨骼、生殖器官損傷,對免疫系統、心血管系統等具有毒性效應,進而引發多種疾病[1]。鎘移動性強,難以生物降解,極易通過食物鏈進入人體,引起人體機能衰退,長期接觸會引起癌癥。目前,中國鎘污染形勢嚴峻,鎘污染事件頻發,嚴重影響了居民的正常生活和身體健康[2-3]。做好食品中鎘的分析檢測工作,對保護人體健康具有重要意義。
目前,比較成熟的重金屬離子檢測方法主要有原子吸收法(AAS)[4]、雙硫腙分光光度法[5]、催化示波極譜法[6-7]、原子熒光法(AFS)、電感耦合等離子體原子發射法(ICP-AES)[8]、電感耦合等離子體質譜法(ICP-MS)[9]等。這些方法都能夠提供較高的檢測靈敏度、較好的選擇性以及準確的檢測結果,但是普遍缺點是儀器價格昂貴、體積大,檢測時間長,并且樣品預處理步驟復雜、時間長、易受污染。近年來,一些依賴于納米材料或核酸適配體的新型檢測技術也常被用于簡單、快速地定量檢測重金屬離子,主要包括電化學分析法[10-11]、熒光法[12-13]、化學發光法[14]、比色分析法[15-16]等。
核酸適配體是一段具有三維空間結構的單鏈DNA或RNA,它可以與靶標發生特異性結合。因此,在構建檢測方法時,適配體可以被用作一種優良的分子識別元件[17]。由于適配體是在體外設計和篩選的,原則上任何靶標都可以有它對應的適配體,而且適配體在信號傳導和化學修飾方面具有更加優良的特性[18-19],因此應用了適配體技術的檢測方法往往具有更高的靈敏度。
到目前為止相較于其他重金屬,有關重金屬鎘基于適配體識別的檢測方法的研究報道很少,僅有3篇[14,20-21],但這些檢查方法對現場快速檢測的實際應用價值不高。本研究擬利用適配體與目標物結合的高特異性,建立一種基于酶聯適配體的鎘離子可視化檢測方法,以實現對鎘離子的快速靈敏檢測,提高方法的實用性。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
氯化鈉、牛血清白蛋白(BSA)、磷酸氫二鈉、磷酸氫二鉀等:分析純,國藥集團化學試劑有限公司;
DNA:上海生工生物工程技術服務有限公司;
親和素:化學純,美國Sigma-Aldrich公司;
鏈霉親和素標記的辣根過氧化物酶(HRP-Streptavidin):250 U/mg,美國Sigma-Aldrich公司;
3,3',5,5'-四甲基聯苯胺溶液(TMB):上海生工生物工程有限公司;
0.2 mm注射器過濾器:天津東康科技有限公司;
鎘離子標準液:100 μg/mL,1% HNO3,上海阿拉丁生化科技股份有限公司;
透明96孔微孔板:每孔300 μL,美國Corning公司;
超純水:18.2 mΩ,由美國Millipore凈水系統制備。
1.1.2 主要儀器設備
紫外-可見光(UV-vis)分光光度計:Shimadzu UV-2300型,日本島津公司;
酶標儀:BioTek Synergyh1型,美國BioTek公司;
電熱鼓風干燥箱:DHG-9145A型,上海一恒科學儀器有限公司;
微量分析天平:AR224CN型,奧豪斯儀器中國有限公司;
實驗室pH計:Starter 3C型,奧豪斯儀器中國有限公司;
超純水儀:Direct-Q3型,密理博中國有限公司;
超聲波清洗儀:KQ-800DE型,無錫科潔儀器設備公司。
1.2 試驗方法
1.2.1 微孔板包被親和素 將親和素用碳酸鹽緩沖液(pH 9.0)稀釋,每孔包被200 μL,4 ℃反應12 h后,用pH 7.4 的洗滌緩沖液[1×磷酸鹽緩沖液(PBS)+0.05 mL/100 mL吐溫20]清洗3次,拍干。加入200 μL的2 g/100 g BSA溶液以封閉未完全被親和素包被的微孔板,37 ℃下放置30 min,拍干,用洗滌緩沖液洗滌3次,拍干。
1.2.2 HRP-互補鏈復合物的制備 將稀釋1 000倍的HRP-Streptavidin與20 nmol/L的生物素化互補鏈[5’-biotin-CGC AAC GCT CGC TCA TAC TGC ACA ACC AAA-3’(DNA2)]混合,37 ℃孵育30 min,然后置于-20 ℃冷凍保存,備用。
1.2.3 鎘離子標準樣品的定量檢測 在微孔板中加入10 μL 的生物素化適配體[20][5’-biotin-ACC GAC CGT GCT GGA CTC TGG ACT GTT GTG GTA TTA TTT TTG GTT GTG CAG TAT GAG CGA GCG TTG CG-3’(DNA1)],37 ℃ 孵育30 min后,用pH 7.4的洗滌緩沖液清洗3次,拍干。將100 μL鎘離子樣品加到微孔板中,37 ℃孵育30 min,用洗滌緩沖液清洗3次,拍干。然后將HRP-互補鏈復合物加到微孔板中,37 ℃孵育30 min,用洗滌緩沖液清洗3次,拍干。最后在每孔中加入100 μL TMB顯色試劑,室溫放置20 min,加入100 μL的2 mL/100 mL硫酸溶液,用酶標儀在450 nm波長處測定其吸光度值。
1.2.4 實際樣品的檢測 利用本方法對自來水中重金屬鎘離子含量進行檢測。用0.2 mm注射過濾器對實際樣品進行過濾,隨后在樣品中添加1,3 ng/mL濃度的鎘離子標品,用本試驗中設計的方法對其進行檢測,得到鎘離子的濃度值并計算回收率,與石墨爐原子吸收光譜法進行比較。
2 結果與分析
2.1 重金屬鎘離子可視化檢測設計原理
如圖1所示:生物素標記的鎘離子適配體能夠特異性地識別和結合鎘離子,從而實現對靶標的捕獲。檢測體系中的目標物鎘離子通過親和素與生物素的結合從而被固定到包被有親和素的微孔板的底部,然后再向孔內加入生物素標記的適配體互補鏈和鏈霉親和素-HRP的復合物。此時,由于適配體與目標物質鎘離子結合時構象會發生變化,導致適配體互補鏈不能與其雜交結合,HRP-互補鏈復合物只能通過結合未捕獲靶標的適配體固定到板底。隨后再加入TMB顯色劑,在HRP的作用下,TMB會被氧化,并且會產生藍色的產物;加入酸后,產物的顏色會變為黃色可被肉眼觀測,并且在450 nm處有最大吸收峰,從而實現鎘離子的可視化檢測。
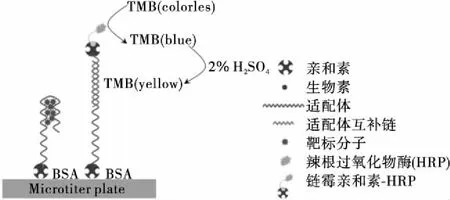
圖1 鎘離子可視化檢測原理圖
2.2 微孔板包被親和素濃度優化
適配體是通過生物素和親和素的連接作用固定于微孔板上的,微孔板上的親和素包被量會直接影響適配體在板底的結合量,因此合適的親和素包被濃度是試驗成功的基礎,于是對親和素的包被濃度進行了優化,結果見圖2。由圖2可知,當親和素濃度達到20~22 μg/mL時,A450差值基本達到飽和,此時檢測效果最佳,為了節省親和素用量,本試驗中親和素包被濃度采用20 μg/mL。
2.3 生物素化鎘離子適配體濃度優化
生物素標記的適配體濃度將直接影響板底連接的適配體量,為了探究適配體濃度對試驗結果產生的影響,對適配體濃度進行了優化,得到試驗結果見圖3。由圖3可知,隨著適配體濃度增大,固定到酶標板底部的互補鏈和引入檢測體系中的HRP量也會不斷增加,從而使A450值也不斷增加。但是當適配體濃度達到200 nmol/L時,A450值基本達到飽和,證明此時適配體的量已經達到飽和,因此試驗中選取200 nmol/L 為適配體加入濃度。
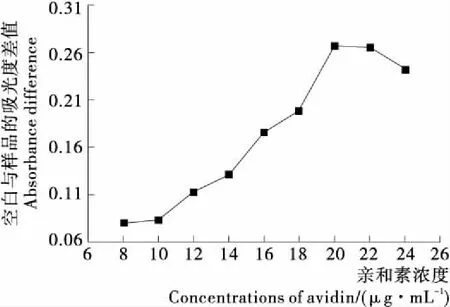
圖2 親和素濃度的優化
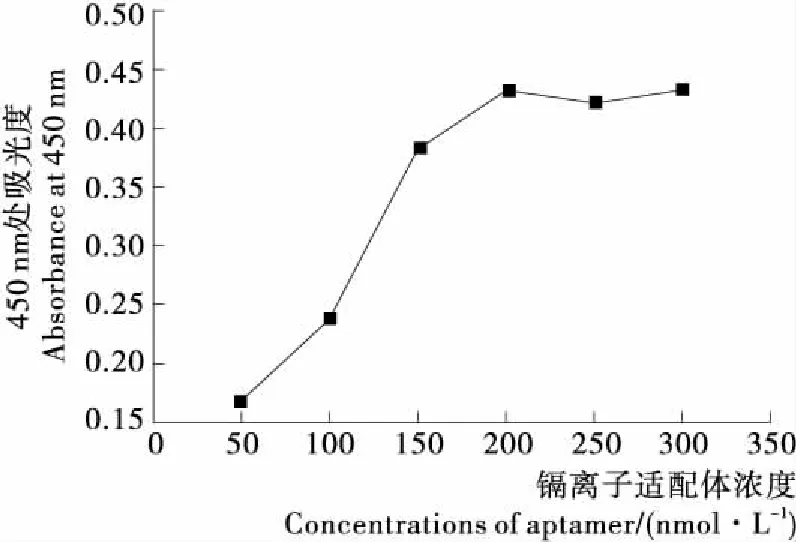
圖3 生物素標記的鎘離子適配體濃度優化
2.4 HRP修飾互補鏈序列濃度優化
互補鏈濃度會影響最終連接到板底的HRP酶的量,為了探究適配體互補鏈濃度對試驗結果產生的影響,對互補鏈濃度進行了優化,得到試驗結果見圖4。由圖4可知,隨著互補鏈濃度的增加,A450值也隨之逐漸增大,當互補鏈濃度達到20 nmol/L時,A450值基本達到飽和,證明此時互補鏈剛好飽和,因此選取互補鏈濃度為20 nmol/L。
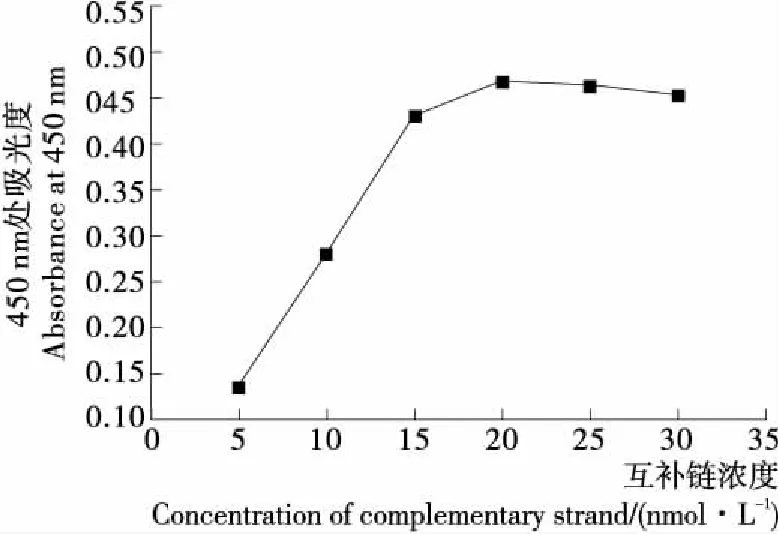
圖4 互補鏈濃度優化
2.5 線性范圍與檢測限
在最佳的試驗條件下,用本研究的檢測方法檢測不同濃度、同體積的鎘離子標準液,結果發現鎘離子濃度與A450在0.1~5.0 ng/mL時呈良好線性,校正曲線方程為y=-0.048 3x+0.439 6,檢出限為0.05 ng/mL(S/N=3)。對濃度為2.0 ng/mL的鎘離子樣品液平行測定3次,最后求得相對標準差為5.2%。
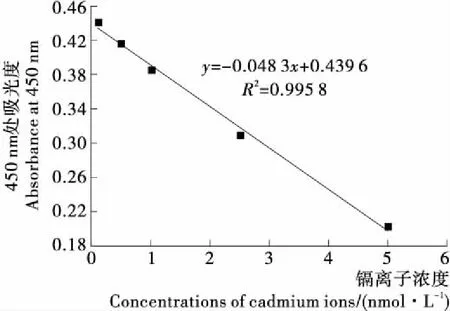
圖5 鎘離子濃度與A450的關系曲線
2.6 特異性
為了驗證此檢測方法的特異性,選擇了10種金屬離子(Hg2+,Pb2+,Fe3+,Mn2+,Mg2+,K+,Ag+,Cu2+,Al3+,Zn2+)與鎘離子在最優條件下進行試驗。鎘離子與其他對照組樣品濃度均為5 ng/mL。將空白孔與各個金屬離子檢測后所得到的A450差值進行比較,結果見圖6。由圖6可知,鎘離子與其他金屬離子的差值差距明顯,且試驗現象可用肉眼觀測到,表明本方法具有良好的特異性。
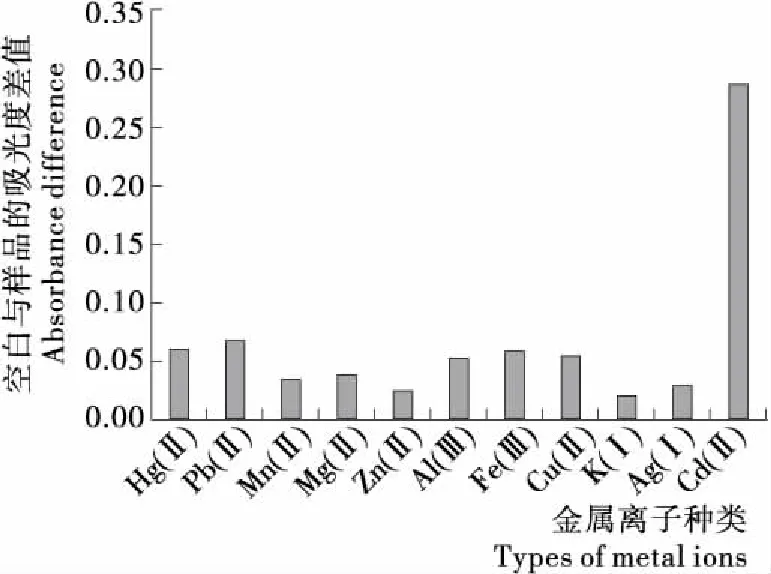
圖6 檢測方法特異性考察
2.7 實際樣品加標回收試驗
為了對試驗結果的準確性進行驗證,用試驗中構建的方法對自來水樣品進行加標回收試驗,并將試驗結果與國標方法——石墨爐原子吸收光譜法進行對比。測得未加標自來水樣品中含有鎘離子,本底值為1.316 ng/mL,將檢測結果扣除本底值后得到結果見表1。從表1可以看出,綜合本方法檢測實際樣品所得結果與原子吸收光譜法相比差異小,獲得了良好的回收率,表明本方法具有較好的準確性和穩定性,可用于鎘離子的實際樣品檢測。

表1 鎘離子加標回收率
3 結論
本研究成功建立了一種基于單鏈ssDNA適配體檢測重金屬鎘離子的可視化方法。方法的最低檢測限為0.05 ng/mL,且在自來水實際樣品的檢測中所得結果與傳統的原子吸收光譜法高度一致,表明本方法可以用于實際樣品檢測。本方法具有操作簡便、靈敏度高、特異性好的優點,可為重金屬分析檢測研究提供一種全新的可行途徑。

