MUC1 基因沉默對肝癌HepG2細胞增殖及侵襲能力的影響
王鳳麗,孫士明,李志
(1大連市中心醫院,遼寧大連116033;2齊齊哈爾醫學院附屬第三醫院)
肝細胞癌的發生是多種因素協同作用的結果,與基因的異常表達直接或間接相關。黏蛋白1(MUC1)又名PEM,是黏蛋白家族成員之一。越來越多的研究提示,MUC1作為癌基因與細胞惡性轉化、遷移及侵襲相關[1]。有研究報道,在肝癌細胞及肝癌組織中也發現MUC1異常表達,但MUC1與肝癌發生發展的關系尚不明確[2~4]。2015年12月~2017年12月,我們觀察了MUC1基因沉默對細胞增殖及侵襲能力的影響,現分析結果并探討其作用機制。
1 材料與方法
1.1 材料 肝癌HepG2細胞購于上海細胞庫;pGCsilencerTMU6.Neo.GFP.NC質粒購于上海吉凱基因化學技術有限公司;WST-1細胞增殖檢測試劑盒購于羅氏公司;細胞培養相關試劑購于Hyclone公司;TRIzol及細胞轉染試劑Lipofectamine2000購于Invitrogen公司;Transwell小室購于Corning 公司;小鼠抗人MUC1單克隆抗體購于Neomarker公司;兔抗人β-actin/cyclin D1/c-myc/MMP-9單克隆抗體購于Epitomics公司。
1.2 siRNA表達載體構建 根據GenBank登陸的MUC1(J05582)保守序列,依據siRNA設計原則選擇GACTGATGCCAGTAGCACT及GCAGCCTCTCGATATAACC兩個靶點,設計合成了兩對siRNA的模板DNA序列,并將其連接到pGC silencer U6/Neo/GFP載體上獲得pGC-MUC1-siRNA1、pGC-MUC1-siRNA2質粒。選取重組質粒pGCsilencerTMU6.Neo.GFP.NC(pGC-NC)作為無關序列對照質粒。
1.3 HepG2細胞MUC1基因沉默 采用含10%小牛血清的DMEM培養基培養細胞,待細胞融合>90%時隨機分為四組,NC組轉染pGC-NC質粒,HMR-1組、HMR-2組分別轉染pHMR-2pGC-MUC1-siRNA、pHMR-2pGC-MUC1-siRNA2質粒,空白對照組常規培養。轉染方法:采用陽離子脂質法,用含10%小牛血清的DMEM培養基培養細胞至對數生長期,經胰酶消化后接種于24孔板,置于37 ℃ 5% CO2孵箱中培養,次日待細胞融合>90%,吸棄上清,用無血清培養基洗細胞兩次;將pGC-NC和pGC-MUC1-siRNA1、pGC-MUC1-siRNA2質粒與Lipofectamine2000按1∶3的比例混合,轉染HepG2細胞,具體操作方法按照說明書。轉染細胞于37 ℃ 5% CO2孵箱中孵育48 h。分別采用RT-PCR法、Western blotting法檢測各組MUC1 mRNA和蛋白的相對表達量。結果顯示,HMR-1組及HMR-2組細胞MUC1 mRNA和蛋白相對表達量均低于NC組及空白對照組(P均<0.05),提示轉染質粒沉默MUC1成功。見表1。
1.4 相關指標觀察
1.4.1 細胞增殖活性 將HepG2細胞培養至對數生長期,0.25%胰酶消化,臺盼藍計數,接種至96孔板,每孔接種5×103個細胞。次日,待細胞匯合大于70%時隨機分為四組,分組及處理同1.3。采用WST-1試劑盒分別于轉染后24、48 h檢測各組細胞450 nm波長處吸光度(A)值。

表1 四組細胞MUC1 mRNA和MUC1蛋白相對表達量比較
注:與NC組比較,*P<0.05;與空白對照組比較,△P<0.05。
1.4.2 細胞侵襲情況 采用Transwell侵襲實驗。用無血清培養液將Matrige膠進行1∶10稀釋,取100 μL加入到Transwell小室包被小室底部上室面,置于37 ℃、5% CO2孵箱中濕化3 h,取轉染48 h的四組細胞(細胞分組及處理同1.3),用含1%血清的IMDM調整細胞密度為5×105個/mL。Transwell小室上室加入200 μL單細胞懸液,下室加入600 μL含10% NCS的IMDM培養液,每組3個復孔,將培養板置于37 ℃、5% CO2孵箱中培養48 h,用棉簽輕輕擦掉上室中膜上的細胞。于倒置顯微鏡下隨機選取5個不同視野計數穿膜細胞數,并計算各組細胞相對侵襲率(與NC組比較),每組重復3次取平均值。
1.4.3 細胞cyclinD1、c-myc、MMP-9 mRNA表達 采用RT-PCR法檢測。收集轉染48 h的四組細胞(細胞分組及處理同1.3)。采用TRIzol試劑裂解細胞,提取細胞總RNA;采用半定量RT-PCR法檢測各組細胞cyclinD1、c-myc、MMP-9 mRNA表達,以β-actin為內參照。引物由上海生物工程科技有限公司合成,引物信息及反應條件見表2。PCR產物采用1.5%瓊脂糖凝膠電泳分離,于凝膠成像儀中采集圖像,并通過ImageJ軟件分析電泳條帶灰度值。
1.4.4 細胞cyclinD1、c-myc、MMP-9蛋白表達 采用Western blotting法。收集轉染48 h的四組細胞(細胞分組及處理同1.3),采用RIPA蛋白裂解液(1%Triton X-100、1% deoxycholate、0.1% SDS)裂解細胞,收集細胞裂解上清,采用BCA試劑盒檢測細胞裂解液蛋白濃度,取等量的蛋白于100 ℃沸水中變性5 min,在10% SDS-PAGE中電泳分離,并轉移到PVDF膜上,5%脫脂牛奶室溫封閉1 h,加入一抗(兔抗人β-actin、cyclin D1、c-myc、MMP-9單克隆抗體)雜交4 ℃孵育過夜;次日HRP標記的二抗(山羊抗小鼠/兔IgG)雜交,室溫孵育1 h;ECL化學發光試劑盒顯色,利用化學發光儀采集圖像,計算各組細胞中各蛋白的相對表達量。

表2 各基因的引物序列及反應條件
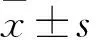
2 結果
2.1 各組細胞增殖能力比較 見表3。

表3 四組細胞增殖能力比較
注:與NC組比較,*P<0.05;與空白對照組比較,△P<0.05。
2.2 各組細胞侵襲能力比較 空白對照組、NC組、HMR-1組、HMR-2組細胞相對侵襲率分別為1.09±0.13、1.00±0.15、0.26±0.07、0.36±0.09,HMR-1組、HMR-2組均低于NC組、空白對照組(P均<0.05)。
2.3 各組細胞cyclinD1、c-myc、MMP-9 mRNA及蛋白表達比較 見表4。

表4 四組細胞cyclinD1、c-myc、MMP-9 mRNA及蛋白相對表達量比較
注:與NC組比較,*P<0.05;與空白對照組比較,△P<0.05。
3 討論
MUC1蛋白是一個高分子量的跨膜糖蛋白,由胞外區域(MUC1-N)、跨膜區域(MUC1-TM)及胞漿尾段(MUC1-CT)三部分組成,最先由Shimizu等[5]于1982年從人的乳汁中分離得到,編碼基因位于lq21。MUC1蛋白正常表達于腺上皮細胞近管腔面,呈極性分布。在部分腫瘤細胞及腫瘤組織中MUC1高表達,異常糖基化,失去極性,分布于整個細胞表面。MUC1蛋白胞外段可作為受體與其配體結合,或作為配體與其受體結合發揮生物學作用,其胞內段與細胞內多條信號傳導通路相關聯,在細胞惡性轉化、遷移及侵襲中起重要作用。Tsutsumida等[6]將攜帶人全長MUC1基因的重組載體轉染人胰腺癌S2-013細胞,使之過表達MUC1蛋白,該細胞增殖能力明顯增強。反之,利用RNAi技術沉默S2-013 細胞株MUC1 mRNA 及蛋白表達,則可抑制胰腺癌細胞體外增殖及體內成瘤能力。Xu等[7]采用MUC1 siRNA 轉染人非小細胞肺癌細胞株NCI-H1650 下調MUC1基因表達,也得到了類似的結果。本研究采用RNAi技術,通過干擾沉默MUC1基因表達,結果顯示,HMR-1、HMR-2組較NC組、空白對照組細胞增殖活性明顯減低,證實MUC1可抑制肝癌細胞的增殖。
有研究報道,MUC1-CT與細胞內多條信號轉導通路相關,在腫瘤的發生發展中發揮重要作用[8~10]。作為Wnt/β-catenin信號通路的靶基因,細胞周期蛋白cyclinD1及癌基因c-myc上調能夠促進細胞增殖及惡性轉化。Li等[10]研究發現,MUC1過表達參與Wnt/β-catenin信號通路的活化,MUC1-CT通過與β-catenin相互作用形成復合物,調節β-catenin的定位,活化轉錄因子LEF/TCF,上調cyclinD1及c-myc基因表達,促進乳腺腫瘤的發生與進展。本研究結果顯示,HMR-1組及HMR-2組細胞cyclinD1和c-myc表達水平顯著降低,可能為MUC1基因沉默抑制肝癌細胞增殖的可能機制。
研究證實,MUC1與腫瘤的侵襲轉移有關,在乳腺癌患者的轉移灶及循環系統腫瘤細胞中均發現MUC1蛋白高表達[11]。Horm等[11]發現,小鼠乳腺腫瘤DA3細胞過表達MUC1后,細胞通過基質膠的能力明顯增強。本研究結果顯示,HMR-1組、HMR-2組細胞侵襲能力顯著減低,表明MUC1在調節肝癌細胞侵襲轉移中發揮重要作用。MMPs是一組含鋅離子的肽鏈內切酶家族,在腫瘤的侵襲和轉移中扮演重要角色[12]。研究發現,活化JNK/Smad2L/Smad2L/C信號通路能夠上調MMP-1、MMP-2 及 MMP-9表達,從而促進肝癌細胞的侵襲及轉移能力[13,14]。Nart等[15]報道,MMP-9表達上調與肝癌進展及侵襲轉移相關。本研究HMR-1組及HMR-2組細胞MMP-9表達顯著下調,提示MUC1能夠調節MMP表達,在肝癌的侵襲及轉移中發揮重要作用。
綜上所述,沉默HepG2細胞MUC1基因表達能夠抑制肝癌HepG2細胞增殖及侵襲,其機制可能與下調cyclinD1、c-myc及MMP-9表達有關。

