全模型迭代重建算法評價125I粒子植入術后CT圖像
韓佳悅,孫連鑫,沙 琳*,張曉虹,賴聲遠(.大連醫科大學附屬第二醫院放射科,遼寧 大連 607;.中國人民解放軍30部隊衛生連放射科,遼寧 大連 6500)
125I放射性粒子植入術具有靶點準、局部控制力強、對周圍組織損傷小等優點,逐漸應用于腫瘤個體化治療中。CT是術后隨訪及評估療效的有效手段,可顯示放射性粒子在瘤體內外的分布及瘤體和瘤周組織的情況。然而125I放射粒子是一種鈦合金封裝體,會在CT掃描中產生金屬偽影,影響精確計數粒子數目和本身及周圍細微結構的顯示。選擇適當的圖像重建算法對減少金屬偽影非常關鍵。全模型迭代重建(model-based knowledge-based iterative reconstruction, IMR)技術是最新的非線性IMR技術,相比傳統的非迭代重建算法,如濾波反投影(filtered back projection, FBP)算法和現有的混合迭代重建(hybrid interative reconstruction, HIR)技術,IMR可大幅減少FBP算法中因空間分辨力不足而導致的噪聲,顯著提升圖像質量,降低噪聲,且能一定程度上抑制偽影產生,提高空間分辨力。本文旨在探討IMR技術在提高圖像質量及減少放射粒子偽影中的應用價值。
1 資料與方法
1.1 一般資料 收集2015年12月—2017年6月于我院接受125I粒子植入術及術后CT隨訪的16例腹部腫瘤患者,其中男6例,女10例,年齡46~72歲,平均(55.3±8.6)歲;肝臟轉移瘤5例,腹腔淋巴瘤3例,腹膜后平滑肌肉瘤2例,卵巢癌腹腔轉移4例,宮頸癌腹腔轉移2例;植入粒子數20~75粒。所有患者于125I粒子植入1周后接受CT檢查。
1.2 儀器與方法 采用Philips Brilliance iCT掃描儀。掃描范圍包括所有放射粒子植入的區域,管電壓100 kV,管電流250 mAs,準直器寬度128×0.625 mm,轉速0.75 s/rot,掃描層厚0.9 mm,層間距0.45 mm。
1.3 圖像分析 采用Philips EBW 4.01工作站,對CT掃描原始數據分別進行IMR、HIR中的iDose4及FBP重建,重建層厚均為1 mm,層間距1 mm,獲得3組圖像。
1.3.1 客觀評價 選取粒子偽影最強的層面,于粒子偽影最強處、同層面豎脊肌較均勻處及同層面腹壁皮下脂肪較均勻處放置ROI。根據偽影不同,選取不同大小的ROI,使之盡量包括偽影最強處及周圍的條狀暗帶。使用工作站中的復制粘貼功能,保證3組圖像中ROI的層面、位置和面積一致,獲得各ROI的CT值及噪聲值(SD)。計算偽影指數(artifact index, AI),AI=(偽影SD2-皮下脂肪SD2)1/2;CNR,CNR=|偽影CT值-豎脊肌CT值|/(偽影SD2+豎脊肌SD2)1/2。
1.3.2 主觀評價 由2名高年資影像科醫師采用盲法對FBP、iDose和IMR 3組重建圖像的質量進行評分,意見分歧時經協商達成一致。評分內容包括粒子偽影、粒子清晰度及瘤體和周圍正常組織顯示情況。評分標準:1分,圖像質量差,偽影大,粒子、瘤體及正常組織顯示欠清,觀察欠佳;2分,圖像質量較差,偽影較大,粒子、瘤體及正常組織尚能顯示,尚能觀察;3分,圖像質量一般,偽影略大,粒子、瘤體及正常組織顯示尚可;4分,圖像質量一般,偽影稍小,粒子、瘤體及正常組織顯示略好;5分,圖像質量較好,偽影較小,粒子、瘤體及正常組織顯示較好。圖像質量≥3分為滿足臨床工作要求。
1.4 統計學分析 采用SPSS 24.0統計分析軟件。對連續變量資料進行正態性及方差齊性檢驗,正態分布的資料以±s表示,偏態資料以中位數(上,下四分位數)表示。IMR、iDose4、FBP算法3組圖像主觀評分比較采用Friedman檢驗,兩兩比較時以Bonferroni法調整P值。3組間的客觀評價指標比較采用單因素重復測量方差分析,不符合球形假設檢驗時通過Greenhouse&Geisser方法校正,兩兩比較采用Bonferroni檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 主觀評價指標 IMR圖像質量的主觀評分為4(4,4.75),iDose4圖像質量的主觀評分為3(3,4),FBP圖像質量的主觀評分為3(2.25,3),3種重建方法所得圖像質量主觀評分差異有統計學意義(χ2=25.245,P<0.001);兩兩比較,IMR與FBP圖像、IMR與iDose4圖像質量主觀評分差異有統計學意義(調整后P<0.001,P=0.011),FBP與iDose4圖像質量主觀評分差異無統計學意義(調整后P=0.335);見表1。IMR圖像的偽影較小,圖像質量及對粒子和周圍組織的顯示情況優于iDose4及FBP圖像(圖1)。
2.2 客觀評價指標 3種重建方法圖像的噪聲、AI及CNR總體差異均有統計學意義(P均<0.001,表2),兩兩比較組間差異均有統計學意義(P均<0.05)。IMR圖像的AI及噪聲最低,CNR最高,FBP圖像的AI及噪聲最高,CNR最低。
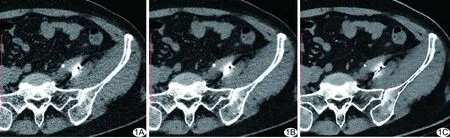
圖1 患者42歲,宮頸癌腹腔轉移瘤125I粒子植入術后3個月CT圖像 A.FBP重建圖像,粒子金屬偽影略大,粒子、瘤體及正常組織顯示尚可,評分為3分; B.iDose4重建圖像,粒子金屬偽影略大,粒子、瘤體及正常組織顯示尚可,評分為3分; C.IMR圖像,偽影稍小,粒子、瘤體及正常組織顯示略好,評分為4分
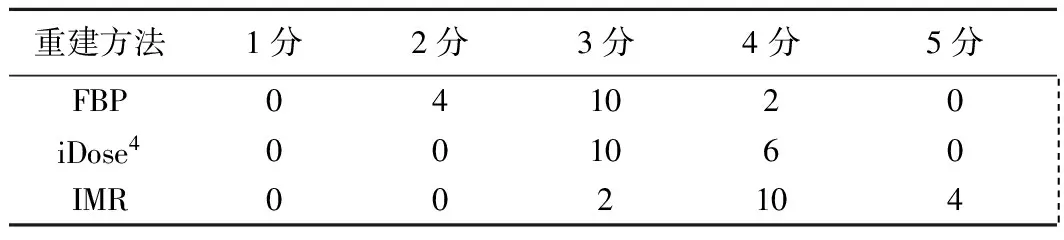
表1 FBP、iDose4、IMR重建圖像質量評分(例,n=16)
表2 FBP、iDose4、IMR重建圖像客觀評價指標比較(±s)
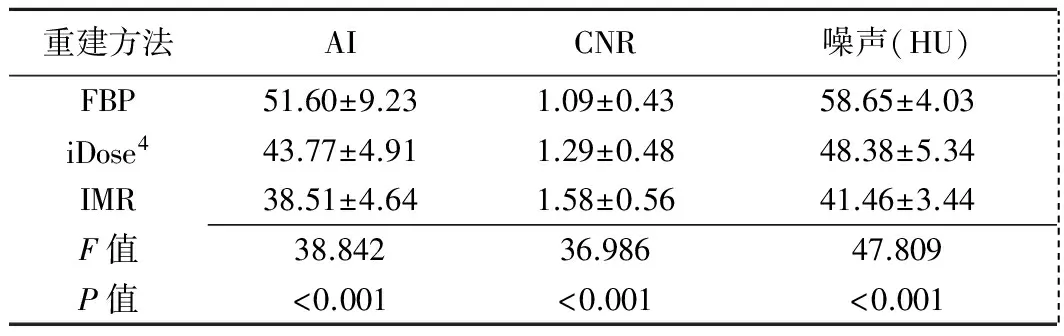
表2 FBP、iDose4、IMR重建圖像客觀評價指標比較(±s)
重建方法AICNR噪聲(HU) FBP51.60±9.231.09±0.4358.65±4.03 iDose443.77±4.911.29±0.4848.38±5.34 IMR38.51±4.641.58±0.5641.46±3.44 F值38.84236.98647.809 P值<0.001<0.001<0.001
3 討論
研究[1-3]表明,對于部分無法接受手術治療的惡性腫瘤患者,125I粒子組織間植入術可有效緩解疼痛和控制腫瘤局部復發,延長生存期,提高患者的生存質量。125I粒子植入后,需要采用CT根據WHO實體瘤評價標準(response evaluation criteria in solid tumor, RECIST)對腫瘤進行療效評估;如CT發現殘留或復發病灶,則需進一步采取干預措施。然而125I粒子具有鈦合金包殼,在常規CT上會產生明顯偽影,影響對粒子、腫瘤及周圍正常組織的觀察,甚至無法以RECIST標準來評估腫瘤的療效,是臨床隨訪及評估的難題之一[4-7]。因此,需要有效的方法來提高圖像質量,減少金屬偽影。
X線光子經過密度較高的物質時會發生能量衰減,低能光子較高能光子衰減和被吸收得更多,導致高密度物質周圍組織的X線衰減信息丟失。X線光子通過高密度物質后發生“硬化”,導致致密物質周圍產生暗影或條紋影[8]。CT圖像上的金屬偽影與金屬植入物的大小、成分、形狀、位置等因素密切相關,同時會受掃描參數、掃描方向和重建參數的影響[9-13]。
選擇合適的圖像重建算法對減少金屬偽影非常關鍵。解析算法和迭代算法是目前常用的2類CT圖像重建算法。FBP算法是解析算法的代表,被視為CT圖像重建算法的基礎,可快速獲得能真實反映解剖形態的圖像;但由于其在成像過程中進行了大量簡化模擬,故所得圖像常有較大的圖像噪聲或射束硬化偽影[14]。迭代算法可通過降低圖像噪聲,進而提高圖像質量。近年來,隨著計算機技術快速發展,迭代算法的重建速度不斷加快,成為新的研究熱點。目前大部分重建技術屬于迭代,如iDose4是基于投影數據空間和圖像空間的雙空間多模型迭代重建技術,混合了FBP及迭代重建,可有效提升圖像空間分辨力及密度分辨力[15]。IMR是最新推出的基于微平板探測器和硬件平臺的非線性全迭代重建技術,以結構化知識模型為基礎,可在重建過程中準確建立數據統計模型和圖像統計模型,并且通過反復減少掃描模型與采集數據之間的差異來逼近最真最優的圖像顯示。IMR結合了系統模型、幾何模型、解剖模型和噪聲模型的特點,可以進一步降低圖像噪聲提升空間分辨力[16]。研究[17]表明,對比FBP和現有的迭代重建技術,IMR在主觀與客觀上均可顯著提升圖像質量,降低噪聲,提高空間分辨力;IMR還可提升低劑量條件下低對比組織的檢出率,使更低劑量掃描成為現實。本研究結果顯示,IMR圖像的噪聲和AI低于、CNR高于FBP及iDose4重建圖像,提示在相同掃描條件和輻射劑量的前提下,IMR不僅可減小125I粒子的偽影、增加CNR、提高圖像的空間分辨力和密度分辨力,且顯示粒子更清晰,對周圍軟組織的觀察更準確,可獲得主客觀質量較好的、對125I及周圍組織顯示清晰的CT圖像。
本研究的局限性:首先,以偽影最大的層面作為ROI層面,存在主觀性;其次,未對IMR技術降低輻射劑量的作用進行研究。
綜上所述,與FBP和iDose4算法相比,IMR圖像具有更高的圖像質量和較低的圖像噪聲,顯示125I粒子及鄰近組織情況更優,可為125I粒子植入術后隨訪與療效評估提供可靠依據。

