抗纖益心方通過TGF-β/Smads信號通路改善糖尿病心肌病大鼠心肌纖維化和心功能的研究
張會超,聶恒,芮浩淼,曹程浩,楊鳳鳴
(河南省中醫院 心血管科,河南 鄭州 450002)
糖尿病是一組由多病因引起的以慢性高血糖為特征的終身性代謝性疾病,其長期血糖增高對患者的大血管、微血管、心、腦、腎等產生較大影響,具有高發病率、高致死率、高致殘率以及并發癥多的特點[1]。糖尿病性心肌病(diabetic cardiomyopathy,DC)是糖尿病患者常見的一種嚴重并發癥,可導致患者心力衰竭或猝死等,嚴重威脅患者生命安全[2]。研究表明,DC患者心肌纖維化是導致其心臟舒張與收縮功能不全,發生難治性心力衰竭的重要機制之一[3-4]。研究[5-6]表明,轉化生長因子-β1(transforming growth factor-β1,TGF-β1)通過激活其下游Smads蛋白,調控相關細胞外基質合成基因定位轉錄,參與多種組織或是器官纖維化的發生。抗纖益心方是目前臨床上心肌病治療較常用的藥方,具有抑制或減少心肌細胞凋亡的作用[7]。該方能改善患者心功能,但其機制尚不十分清除,為此本研究擬探討抗纖益心方改善DC患者心功能是否與改善心肌纖維化有關,并探討TGF-β/Smads信號通路是否參與其中。
1 材料與方法
1.1 動物分組與處理
選取40只大鼠,隨機分成對照組(control group,C組)、抗纖益心方組(anti fibrinolytic group,AF組)、DC組、DC+AF組4組,每組10只,大鼠平均體重為(109.65±21.30)g。采用鏈脲佐菌素(STZ)單次腹腔注射制作DC大鼠模型,當大鼠血糖濃度>16.7 mmol·L-1則認為造模成功。各組大鼠作如下處理:C組大鼠予單次腹腔注射生理鹽水;AF組大鼠先予單次腹腔注射生理鹽水,隨后用抗纖益心方溶液18.8 g·kg-1·d-1灌胃處理;DC組大鼠僅予單次腹腔注射STZ;DC+AF組大鼠先予單次腹腔注射STZ,隨后應用抗纖益心方溶液灌胃處理。各組大鼠連續用藥8周后處死。
1.2 指標檢測
1.2.1 血液動力學檢測 采用頸動脈心室內插管法評估大鼠的心臟血流動力學指標左室收縮壓(left ventricular systolic pressure,LVSP)和左室舒張末壓(left ventricular end diastolic pressure,LVEDP)。
1.2.2 心室肌組織Ⅰ型膠原蛋白(collagen Ⅰ,Col Ⅰ)表達檢測 大鼠處死后收集心室肌標本,采用OCT包埋劑處理后冷凍,并將其制成5 mm的切片,經固定、復溫、洗滌后封存。然后滴加Col Ⅰ 抗體在37 ℃下處理30 min,洗滌后滴加Alexa Fluor 488熒光標記二抗,甘油封片后采用免疫熒光染色在熒光顯微鏡下評價Col Ⅰ的表達情況。
1.2.3 TGF-β/Smads檢測方式 大鼠處死后收集心室肌標本,經RIPA裂解液勻漿、離心后獲得心室肌組織總蛋白。然后檢測蛋白濃度、分離,電轉印至PVDF膜上,封存后分別滴加TGF-β1、甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、Smad2、Smad3抗體,在4 ℃條件下孵育12 h,然后再次洗滌,室溫下孵育30 min后顯色法顯色,采用蛋白質印跡法檢測TGF-β1、Smad2、Smad3蛋白水平表達,蛋白的磷酸化水平采用蛋白質印跡法評價。
1.3 統計學處理
2 結 果
2.1 抗纖益心方對DC大鼠血糖以及心功能的影響
DC組、DC+AF組大鼠血糖濃度明顯高于C組(P<0.05);AF組大鼠血糖濃度及LVEDP、LVSP與C組比較差異無統計學意義(P>0.05);DC組LVEDP顯著上升(P<0.05),LVSP顯著下降(P<0.05),DC+AF組大鼠LVSP明顯高于DC組(P<0.05),LVEDP低于DC組(P<0.05)。見表1。
表1各組大鼠血糖及心功能指標檢測結果比較
Tab1EffectofKangxianYixinrecipeonbloodglucoseandcardiacfunctionindiabeticcardiomyopathyrats
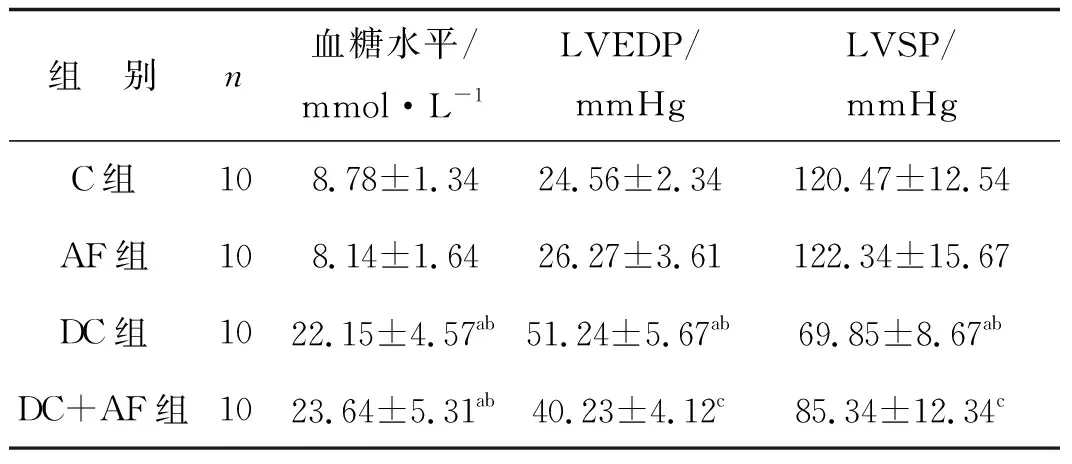
組 別n血糖水平/mmol·L-1LVEDP/mmHgLVSP/mmHgC組108.78±1.3424.56±2.34120.47±12.54AF組108.14±1.6426.27±3.61122.34±15.67DC組1022.15±4.57ab51.24±5.67ab69.85±8.67abDC+AF組1023.64±5.31ab40.23±4.12c85.34±12.34c
a 與C組比較,P<0.05;b 與AF組比較,P<0.05;c 與DC組比較,P<0.05
2.2 抗纖益心方處理對DC大鼠心肌纖維的影響
C組、AF組、DC組、DC+AF組大鼠Col Ⅰ表達水平依次為(1.63±0.67)、(1.72±0.71)、(3.14±1.52)、(2.12±1.26)ng·ml-1,DC組及DC+AF組顯著高于C組(P<0.05),DC+AF組顯著低于DC組(P<0.05),見圖1。
2.3 抗纖益心方處理對DC大鼠心肌細胞TGF-β/Smads信號通路的影響
DC組大鼠TGF-β1、Smad2及Smad3的磷酸化水平顯著高于C組(P<0.05),而DC+AF組大鼠TGF-β1、Smad2及Smad3的磷酸化水平顯著低于DC組(P<0.05),C組與AF組大鼠TGF-β1、Smad2及Smad3比較差異無統計學意義(P>0.05),見表2、圖2(圖中p指磷酸化)。
3 討 論
DC是指發生在糖尿病患者身上,并且不能用高血壓性心臟病、冠心病等其他相關心臟病來解釋的一種特異性心肌病[8]。該病常見的臨床癥狀為心功能異常,患者主要表現為心臟重塑。心臟重塑包括心肌細胞與非心肌細胞重塑兩種[9]。非心肌細胞發生重塑主要是大鼠成纖維細胞的增殖,進一步轉化為肌成纖維細胞,而后者可分泌與合成細胞外基質(extracellular matrix,ECM),使患者心臟發生纖維化,進而出現心室重塑[10]。ECM在臨床上的分類較多,但以Col Ⅰ最為常見,并且占所有ECM成分的80%以上,而Col Ⅰ的高度表達可提高人體心肌僵硬度,長期如此可導致心室收縮以及舒張功能下降[11-12]。在本研究中,DC組大鼠LVEDP及LVSP發生明顯異常的同時伴有心肌細胞中明顯的Col Ⅰ沉積,證明DC組大鼠心臟存在心功能異常并且有可能是心臟纖維化所導致。

圖1各組大鼠心肌組織冰凍切片ColⅠ免疫熒光染色圖像
Fig1ImmunohistochemicalstainingoffrozensectionsofColⅠinmyocardiumofratsineachgroup
表2各組大鼠心肌細胞TGF-β/Smads信號通路激活情況
Tab2EffectsofKangxianYixinrecipeonTGF-β/Smadssignalingpathwayincardiomyocytesofdiabeticcardiomyopathyrats
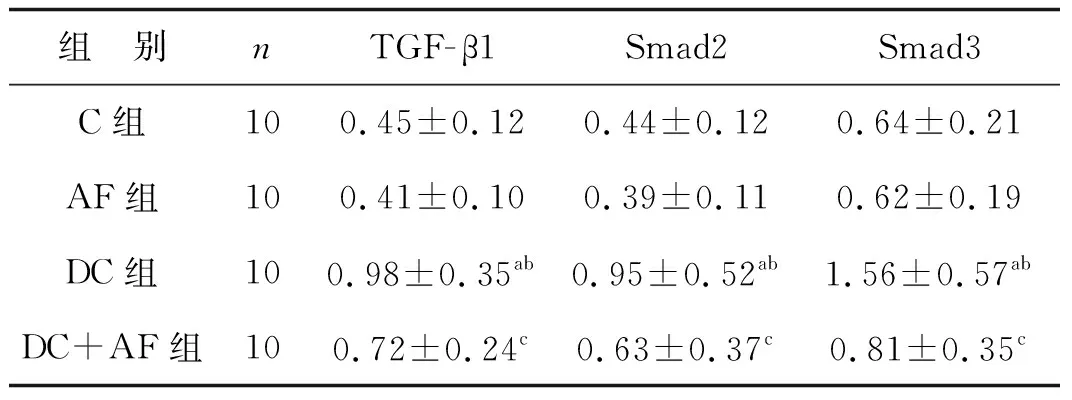
組 別nTGF-β1Smad2Smad3C組100.45±0.120.44±0.120.64±0.21AF組100.41±0.100.39±0.110.62±0.19DC組100.98±0.35ab0.95±0.52ab1.56±0.57abDC+AF組100.72±0.24c0.63±0.37c0.81±0.35c
a 與C組比較,P<0.05; b 與AF組比較,P<0.05; c 與DC組比較,P<0.05
DC對患者危害較大,嚴重者可導致患者猝死。因此在尋找合適治療方式的同時,尋找其發生機制才是研究重點[13]。目前認為DC導致患者發生成纖維化的機制與高血糖引起的氧化應激、腎素-血管緊張素-醛固酮系統、基質金屬蛋白酶、內皮素、TGF-β1等相關因子的表達水平增加有關[14-15]。Smads蛋白是TGF-β1下游的重要信號分子,Smad2及Smad3的磷酸化水平與下游膠原蛋白的表達密切相關[16]。有研究表明,TGF-β1能刺激Smad2、Smad3等蛋白的表達,同時抑制膠原酶原以及基質酶原等因子表達,促進心肌發生纖維化,從而加重患者的心功能異常[17]。在本研究中,DC組大鼠TGF-β1、Smad2及Smad3的磷酸化水平顯著高于其他幾組大鼠,提示TGF-β1信號通路參與DC組大鼠心臟纖維化過程,而且TGF-β1/Smads信號通路在DC組大鼠心肌細胞中呈高度活化狀態。
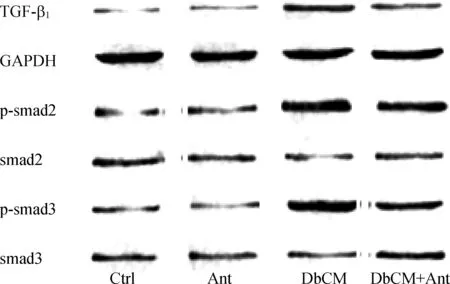
圖2各組大鼠心肌組織TGF-β1、GAPDH、p-Smad2、Smad2、p-Smad3、Smad3免疫印跡
Fig2TheexpressionofTGF-β1,GAPDH,p-Smad2,Smad2,p-Smad3andSmad3inthemyocardiumofratsineachgroup
臨床上根據DC發病機制研究出了各種控制DC進一步發展的藥物。孫佳歡等[18]學者研究中藥在心肌纖維化患者中的臨床作用,結果證明,中藥中不同活性成分對心肌纖維化起到一定的抑制效應,其療效明顯優于西藥治療。抗纖益心方主要由黨參、茯苓、黃芪、丹參、白術、川芎、赤芍、澤蘭、紅花、益母草組成,具有抗纖維化、抗炎等多種生物學活性[19]。相關研究表明,抗纖益心方能穩定擴張型心肌病大鼠的血壓,為β阻滯劑以及血管緊張素轉化酶抑制劑的應用提供依據[20]。本研究發現,抗纖益心方在DC+AF組大鼠模型中能發揮抗心臟纖維化、改善大鼠心功能的作用,同時DC+AF組大鼠Col Ⅰ、TGF-β1、Smad2及Smad3的磷酸化水平明顯低于DC組,進一步證明抗纖益心方通過抑制TGF-β1/Smads信號通路的表達,從而控制心肌纖維化進一步發展。
綜上所述,抗纖益心方對DC大鼠心肌纖維化具有一定的抑制作用,且能改善大鼠的心功能,其作用機制與TGF-β/Smads信號系統密切相關。
[參考文獻]
[1] 潘勁,胡如英,龔巍巍,等.浙江省2007至2012年糖尿病流行特征的描述性分析[J].中華內分泌代謝雜志,2015,31(10):846-850.
[2] 程天宇,鄢高亮,王棟,等.和肽素水平與糖尿病大鼠合并冠心病的相關性研究[J].東南大學學報:醫學版,2016,56(3):327-331.
[3] 李俊龍,曹新冉,王瑩,等.青蒿素對糖尿病心肌病大鼠心功能及纖維化的影響[J].上海中醫藥雜志,2016,63(3):70-73.
[4] 張花治,金智生,王東旭,等.紅芪多糖對db/db小鼠糖尿病心肌病心肌纖維化的改善作用[J].中國臨床藥理學雜志,2017,33(3):239-243.
[5] 趙婷,李丹,劉曉雯,等.SLC7A5對腫瘤細胞增殖的影響及其與轉化生長因子-β1信號調控的關系[J].中南大學學報:醫學版,2017,42(5):485-492.
[6] 崔佳瞿,吳小濤.轉化生長因子β超家族對椎間盤退變影響的研究進展[J].東南大學學報:醫學版,2015,56(3):439-443.
[7] 王振濤,常紅波,吳鴻,等.抗纖益心濃縮丸對擴張型心肌病大鼠心功能及心室重構的影響[J].中國中醫急癥,2017,26(3):394-396.
[8] 趙娜,潘碩,張勇,等.TGF-β/Smads信號通路參與苦參素抑制糖尿病心肌病大鼠心肌纖維化及改善心功能作用[J].山西醫科大學學報,2015,46(11):1056-1060.
[9] 武潔,楊曉君,王晶,等.TGF-β1/Smads信號通路對PM2.5致大鼠肺組織損傷的免疫調控作用[J].西北藥學雜志,2017,32(3):316-321.
[10]肖一佳,沈祥春,李杰平,等.心肌纖維化與TGF-β-Smad信號系統[J].中國新藥雜志,2016,25(2):182-186.
[11]金智生,王東旭,張花治,等.紅芪多糖對db/db小鼠糖尿病心肌病TGF-β1/Smads信號通路影響的實驗研究[J].北京中醫藥大學學報,2017,40(1):20-26.
[12]孫曉慧,牟艷玲.糖尿病心肌病相關信號通路的研究進展[J].生理科學進展,2015,46(6):419-423.
[13]高原,謝世陽,王幼平,等.加參方通過抑制TGF-β/Smads信號轉導通路改善大鼠心肌梗死后心室重構的機制[J].中華中醫藥雜志,2017,32(3):1328-1332.
[14]韓安邦,張健,路迎冬,等.芪藶強心膠囊對心肌梗死大鼠心肌纖維化及TGF-β1/Smad3信號通路的影響[J].北京中醫藥大學學報,2017,40(1):41-47.
[15]VIDYA K,RAMOJI K,LI H,et al.Forkhead box transcription factor 1:role in the pathogenesis of diabetic cardiomyopathy[J].Cardiovasc Diabetol,2016,15(1):44.
[16]孫桂芳,張曉芬,陳亞峰,等.轉化生長因子-β1/Smads 信號在增生性瘢痕形成中的作用研究進展[J].創傷外科雜志,2015,16(5):473-477.
[17]UMME S,XUE M,SAYED A S M,et al.Role of transforming growth factor-β1 and Smads signaling pathway in intrauterine adhesion[J].Mediators Inflamm,2016,35(6):415.
[18]孫佳歡,于琨,劉玉,等.中藥抗心肌纖維化的藥效物質基礎的研究進展[J].中醫藥導報,2016,23(15):86-90.
[19]JI Q,LIU X,HAN Z,et al.Resveratrol suppresses epithelial-to-mesenchymal transition in colorectal cancer through TGF-β1/Smads signaling pathway mediated Snail/E-cadherin expression[J].Bmc Cancer,2015,15(1):97.
[20]曾垂義,王振濤.抗纖益心方對擴張型心肌病大鼠血壓的影響[J].中醫學報,2016,31(8):1186-1188.

