聯(lián)合胃蛋白酶原、胃泌素、糞便Hp抗原檢測對萎縮性胃炎和胃癌的診斷價值
蔡惠美,林暉,歐希龍,黃玉鈿,方躍華,孫娟,曹文瑜,傅建英
(1. 福建醫(yī)科大學附屬福州市第一醫(yī)院 消化內(nèi)科,福建 福州 350000; 2. 東南大學附屬中大醫(yī)院 消化科,江蘇 南京 210000; 3. 福建醫(yī)科大學附屬福州市第一醫(yī)院 病理科,福建 福州 350000;4. 福建醫(yī)科大學附屬福州市第一醫(yī)院 檢驗科,福建 福州 350000)
胃癌是一種惡性上皮腫瘤,具有較高的全球發(fā)病率和死亡率[1-3]。我國是胃癌高發(fā)國家,其發(fā)病率呈現(xiàn)逐年遞增的趨勢[4]。研究指出,胃癌由一系列的癌前疾病發(fā)展而來,其中萎縮性胃炎是一種較為嚴重的癌前病變,該疾病通過多方面的發(fā)展最終進化為胃癌[5]。目前對胃癌和萎縮性胃炎的診斷主要依賴于內(nèi)窺鏡檢查和活組織檢測,但近年來的研究表明,血清中胃蛋白酶原(pepsinogen, PG)、胃泌素以及幽門螺桿菌(Helicobacterpylori,Hp)感染的檢測,在胃癌和萎縮性胃炎的篩選中發(fā)揮了重要的作用[6]。本研究檢測了萎縮性胃炎和胃癌患者血清PG、胃泌素及糞便Hp抗原(HpSA)水平,進一步闡明聯(lián)合檢測各指標在胃癌和萎縮性胃炎診斷中的價值。
1 對象與方法
1.1 研究對象
收集福建醫(yī)科大學附屬福州市第一醫(yī)院消化科2016年3月至2017年3月間門診或住院患者150例,經(jīng)胃鏡及組織病理檢查,確診正常及慢性淺表性胃炎50例(對照組)、萎縮性胃炎50例(萎縮性胃炎組),胃癌50例(胃癌組)。排除標準為:(1)年齡≤18歲;(2)有嚴重心腦血管疾病等胃鏡檢查禁忌證;(3)近1個月內(nèi)使用過抗生素、抑酸劑、非甾體抗炎藥及胃黏膜保護劑;(4)合并全身其他系統(tǒng)及器官惡性腫瘤;(5)有嚴重肝腎功能不全。3組研究對象在性別和年齡方面差異無統(tǒng)計學意義。
1.2 研究方法
1.2.1 標本采集 抽取參試者空腹血5 ml,離心收集血清樣本保存于-20 ℃冰箱備用;使用潔凈干燥的專用容器收集參試者糞便2~3 g,置于-20 ℃冰箱備用。
1.2.2 血清PG及胃泌素的檢測 使用酶聯(lián)免疫吸附法(ELISA)檢測患者血清中胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ)和胃泌素-17(G-17)的含量,檢測使用購自芬蘭百得公司的ELISA試劑盒進行,通過personal LAB全自動酶標儀讀取檢測結果。
1.2.3 糞便HpSA的檢測 制備患者糞便稀釋樣品(1∶4),采用免疫膠體金法檢測HpSA,檢測試劑購自上海凱創(chuàng)生物科技有限公司。
1.3 統(tǒng)計學處理

2 結 果
2.1 3組血清PGⅠ、PGⅡ及G-17檢測結果
ELISA檢測結果表明,萎縮性胃炎組和胃癌組PGⅠ水平及PGR值較對照組顯著降低,且胃癌組降低更明顯,差異均具有統(tǒng)計學意義(P<0.001);PGⅡ水平在萎縮性胃炎組和胃癌組有一定程度的減低,但較對照組差異無統(tǒng)計學意義(P>0.05);萎縮性胃炎組和胃癌組G-17水平較對照組增高,且胃癌組增高更為顯著,差異均具有統(tǒng)計學意義(P<0.001),見表1。
2.2 3組糞便樣品中HpSA檢測陽性水平
免疫膠體金法檢測結果表明,HpSA陽性率萎縮性胃炎組為84%,胃癌組為88%,均顯著高于對照組的60%(P<0.05)。
2.3 萎縮性胃炎及胃癌組HpSA陰性和陽性患者各檢測指標的差異
萎縮性胃炎組HpSA陽性患者中,PGⅠ、G-17水平及PGR值顯著低于HpSA陰性患者(P<0.05),但PGⅡ水平的差異無統(tǒng)計學意義(P>0.05);胃癌組HpSA陽性患者中,PGⅠ水平及PGR值較HpSA陰性患者減低(P<0.05),而PGⅡ及G-17水平在陰性和陽性患者中差異無統(tǒng)計學意義(P>0.05),見表2。
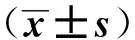

組 別PGⅠ水平/ng·ml-1PGⅡ水平/ng·ml-1PGR值G-17水平/pmol·L-1對照組135.9±38.115.2±3.589.6±4.49.3±3.2萎縮性胃炎組100.7±24.8a14.4±3.37.4±2.8a12.1±3.1a胃癌組51.5±28.4ab14.0±4.03.7±2.0ab18.4±5.9ab
a 與對照組比較,P<0.001; b 與萎縮性胃炎組比較,P>0.001
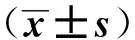

組 別 PGⅠ水平/ng·ml-1PGⅡ水平/ng·ml-1PGR值G-17水平/pmol·L-1萎縮性胃炎組HpSA陰性124.6±18.812.9±3.610.3±3.015.2±3.1HpSA陽性96.2±23.2a14.7±3.26.9±2.4a11.5±2.7a胃癌組HpSA陰性72.6±15.414.5±2.75.0±0.520.6±4.8HpSA陽性48.6±28.6b13.9±4.13.5±2.0b18.1±6.0
a 與萎縮性胃炎組HpSA陰性者比較,P<0.05; b 與胃癌組HpSA陰性者比較,P<0.05
2.4 PGⅠ、PGR、G-17及HpSA在萎縮性胃炎和胃癌診斷中的價值評估
根據(jù)各組PGⅠ、PGR、G-17的檢測結果繪制各指標的ROC曲線。在萎縮性胃炎組,PGⅠ的ROC曲線下面積(AUC)為0.776,最佳臨界值為PGⅠ<122.270 ng·ml-1,對應的靈敏度和特異度分別為68%和82%;PGR的AUC為0.655,最佳臨界值為PGR<9.005,靈敏度和特異度分別為56%和78%;G-17的AUC為0.726,最佳臨界值為G-17>11.505 pmol·L-1,靈敏度和特異度分別為66%和82%。ROC曲線見圖1。
在胃癌組,PGⅠ的AUC為0.957,最佳臨界值為PGⅠ<71.825 ng·ml-1,對應的靈敏度和特異度分別為94%和88%;PGR的AUC為0.924,最佳臨界值為PGR<5.140,靈敏度和特異度分別為90%和80%;G-17的AUC為0.906,最佳臨界值為G-17>12.855 pmol·L-1,靈敏度和特異度分別為84%和90%。ROC曲線見圖2。

圖1PGⅠ、PGR及G-17診斷萎縮性胃炎的ROC曲線
計算并比較各指標單獨檢測及聯(lián)合檢測時的診斷靈敏度和特異度發(fā)現(xiàn),聯(lián)合檢測PGⅠ、PGR、G-17及HpSA時,診斷萎縮性胃炎和胃癌的靈敏度和特異度均最佳,見表3。

圖2PGⅠ、PGR及G-17診斷胃癌的ROC曲線
3 討 論
胃癌作為一種惡性上皮腫瘤疾病,位居世界腫瘤死因第2位。雖然目前癌癥治療方法已經(jīng)有顯著突破,但胃癌的預后仍不理想,5年生存率僅為20%~30%[7]。胃癌具有多種癌前狀態(tài)如萎縮性胃炎、異型增生及腸上皮化生等[8]。這些癌前疾病在不良條件的促進下極易發(fā)展為胃癌,尤其是萎縮性胃炎,其發(fā)展為胃癌的可能性高達73%[9]。因此,監(jiān)測癌前疾病對胃癌的早期篩查具有重要意義。目前,血清學檢測已經(jīng)成為疾病診斷中不可或缺的一部分,其中血清胃蛋白酶和胃泌素在萎縮性胃炎和胃癌中的診斷價值備受關注,但是由于各種指標的靈敏度和特異度存在局限性,聯(lián)合使用多種檢測指標已經(jīng)成為當前相關領域研究的重要思路。
表3PGⅠ、PGR、G-17及HpSA單獨檢測與聯(lián)合檢測對萎縮性胃炎和胃癌診斷的評估

檢查指標萎縮性胃炎組胃癌組靈敏度/%特異度/%靈敏度/%特異度/%PGⅠ68829488PGR56789080G-1766828490HpSA84408840PGⅠ+PGR+G-1780829484PGⅠ+PGR+G-17+HpSA84909690
PG是胃蛋白酶的前體物質(zhì),根據(jù)免疫活性和生化特征的不同可分為PGⅠ和PGⅡ兩種,在胃黏膜發(fā)生急慢性炎癥時,血清PGⅠ和PGⅡ的水平升高,隨著炎癥促進萎縮進展,PGⅡ的水平顯著增加,而PGⅠ水平降低,致使PGR下降,因此檢測血清PG水平可以用來篩查進展期萎縮性胃炎。胃泌素能夠刺激胃酸的分泌,其中G-17含量最高,約占所有亞型的90%,在機體中發(fā)揮的作用最大[10]。研究表明,當胃竇發(fā)生萎縮時,G-17含量會發(fā)生變化,可以作為反映萎縮情況的重要指標。此外,G-17含量的增加與胃癌的發(fā)生密切相關,具有一定的診斷價值[11]。
本研究以萎縮性胃炎和胃癌患者作為研究對象,以正常及慢性淺表性胃炎者為對照組,分析表明,萎縮性胃炎組和胃癌組PGⅠ水平及PGR值有顯著下降趨勢,且胃癌組下降更明顯,G-17含量在兩組患者中均呈現(xiàn)增高趨勢,與對照組差異具有統(tǒng)計學意義,各指標的變化情況與已有研究結果[12]基本一致,證明了以上3種指標在萎縮性胃炎和胃癌發(fā)展中的潛在作用。ROC分析表明,PGⅠ、PGR及G-17在萎縮性胃炎和胃癌的診斷中具有較高應用價值。本研究中各檢測指標的應用臨界值與已有研究[13]存在差異,這可能與研究病例數(shù)、萎縮性胃炎的萎縮程度、胃癌種類、分級和分布的不同有關,同時也可能是不同地域人群的生活及飲食習慣的差異所導致。
Hp在胃癌患者中的陽性率極高,被列為人類胃癌的肯定致病原。目前對Hp感染的檢測,多采用組織學方法、13C-尿素呼氣試驗以及血清學試驗檢測Hp抗體[14],但以上方法存在費用高、操作繁瑣以及適用對象有限等局限性。近期研究中,HpSA檢測法備受關注,相比已有的幾種方法,HpSA法在敏感性、特異性以及準確性上與其他方法無顯著差異,但具有更加簡便、經(jīng)濟及快捷的特點,且不受疾病種類和年齡的影響[15]。因此,在對胃癌及其相關疾病的篩選過程中,我們認為HpSA檢測是一種較好的方法,值得推廣應用。
本研究通過免疫膠體金法檢測到萎縮性胃炎組和胃癌組患者HpSA的陽性率遠高于對照組。此外研究還發(fā)現(xiàn),萎縮性胃炎組和胃癌組的HpSA陽性患者中,PGⅠ水平和PGR值顯著低于HpSA陰性患者,這與Kikuchi等[16]的研究中Hp感染陽性患者PGI和PGR降低的數(shù)據(jù)一致。這一現(xiàn)象的產(chǎn)生,可能是由于Hp持續(xù)感染后引起癌前疾病及胃癌的發(fā)展過程中發(fā)生了PG基因的突變,使得PGⅠ的分泌能力喪失,導致PGⅠ水平降低,而由于PGⅡ水平變化不大,因此對應的PGR值顯著下降[17]。
目前,聯(lián)合血清PG、PGR及G-17檢測在胃癌及相關疾病的診斷中已經(jīng)得到證實[18]。在此基礎上,本研究通過綜合統(tǒng)計不同檢測指標在診斷中的靈敏度和特異度,進一步證明了聯(lián)合PGⅠ、PGR、G-17及HpSA的檢測,對萎縮性胃炎和胃癌的診斷評估效果最佳。總之,血清PG、G-17聯(lián)合HpSA的檢測對萎縮性胃炎和胃癌具有較高的診斷價值,其應用具有無創(chuàng)、便捷以及經(jīng)濟的特點,可作為一種篩選疾病的重要手段。關于本研究中各指標的臨界值,由于試驗對象的地域及樣本量較小的限制,試驗結果可能存在一定誤差,尚需更多研究進一步驗證。
[參考文獻]
[1] SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[2] 范立僑,譚明,李勇,等.胃癌組織中Vav1蛋白表達與胃癌臨床生物學行為及預后的關系[J].東南大學學報:醫(yī)學版,2017,36(1):4-8.
[3] 孫燕,姜藻.胃癌分子靶向治療的現(xiàn)狀及研究進展[J].東南大學學報:醫(yī)學版,2013,32(2):235-238.
[4] CHEN W,ZHENG R,ZENG H,et al.The updated incidences and mortalities of major cancers in China,2011[J].Chin J Cancer,2015,34(11):502-507.
[5] CHEN T,SUN L,HE C,et al.Serum OPN expression for identification of gastric cancer and atrophic gastritis and its influencing factors[J].PLoS One,2014,9(12):e114005.
[6] NEJADI-KELARIJANI F,ROSHANDEL G,SEMNANI S,et al.Diagnostic values of serum levels of pepsinogens and gastrin-17 for screening gastritis and gastric cancer in a high risk area in northern Iran[J].Asian Pac J Cancer Prev,2014,15(17):7433-7436.
[7] CHOI A H,KIM J,CHAO J.Perioperative chemotherapy for resectable gastric cancer:MAGIC and beyond[J].World J Gastroenterol,2015,21(24):7343-7348.
[8] LIN J T.Screening of gastric cancer:who,when,and how[J].Clin Gastroenterol Hepatol,2014,12(1):135-138.
[9] MUKOUBAYASHI C,YANAOKA K,OHATA H,et al.Serum pepsinogen and gastric cancer screening[J].Intern Med,2007,46(6):261-266.
[10]WANG X,LING L,LI S,et al.The diagnostic value of gastrin-17 detection in atrophic gastritis:a Meta-analysis[J].Medicine (Baltimore),2016,95(18):e3599.
[11]XIE X Q,ZHENG K C,WU B S,et al.Differences in the levels of gastric cancer risk factors between Nanjing and Minqing counties,China[J].J Prev Med Public Health,2014,47(5):281-287.
[12]王雪華,曹燕,張劍宏,等.血清胃蛋白酶原聯(lián)合胃泌素測定在胃癌及萎縮性胃炎中的診斷價值[J].中華臨床醫(yī)師雜志:電子版,2015,9(10):62-65.
[13]SUN L,TU H,LIU J,et al.A comprehensive evaluation of fasting serum gastrin-17 as a predictor of diseased stomach in Chinese population[J].Scand J Gastroenterol,2014,49(10):1164-1172.
[14]KOKKOLA A,RAUTELIN H,PUOLAKKAINEN P,et al.Diagnosis ofHelicobacterpyloriinfection in patients with atrophic gastritis:comparison of histology,13C-urea breath test,and serology[J].Scand J Gastroenterol,2000,35(2):138-141.
[15]吳力力,章國忠,潘建豹,等.糞便Hp抗原檢測對診斷兒童Hp感染的價值[J].臨床醫(yī)學,2006,26(6):86.
[16]KIKUCHI S,KUROSAWA M,SAKIYAMA T,et al.Long-term effect ofHelicobacterpyloriinfection on serum pepsinogens[J].Jpn J Cancer Res,2000,91(5):471-476.
[17]CAO Q,RAN Z H,XIAO S D.Screening of atrophic gastritis and gastric cancer by serum pepsinogen,gastrin-17 andHelicobacterpyloriimmunoglobulin G antibodies[J].J Dig Dis,2007,8(1):15-22.
[18]孫俊紅,趙彬.糞便 HPSA 檢測法篩查HP感染的臨床診斷價值[J].中國實用醫(yī)藥,2014(2):113-114.

