獨角金內酯調控水稻分蘗芽休眠的研究進展
李葉
(上海市金山區廊下鎮農業技術推廣服務站,上海201516)
0 引言
水稻分蘗分為有效分蘗和無效分蘗兩類,在高產群體中,無效分蘗的存在將影響有效分蘗正常發育和后期群體光合作用[1],抑制無效分蘗發生、提高群體的莖蘗成穗率是水稻形成合理群體進而取得高產的重要前提[2]。目前中國大面積生產上水稻莖蘗成穗率僅60%~70%,而超高產群體莖蘗成穗率必需達到80%以上,進一步抑制無效分蘗發生,提高莖蘗成穗率,使每個有效莖更充分地發育,穗型將增大,產量將有更大的突破[3]。因此,控制無效分蘗的發生已經成為中國稻作科學界高產栽培的研究熱點。
水稻分蘗的形成可分為分蘗芽的分化形成和分蘗芽的萌發生長兩個過程[4]。目前普遍認為,分蘗芽的分化形成主要受少數基因控制,而分蘗芽的萌發生長更多地受環境因素的影響。李學勇等[5]在粳稻品種‘H89025’中發現了由MOC1基因控制、分蘗能力完全喪失、只有一個主莖稈的天然突變體,其分蘗芽的分化形成受到抑制。分蘗是水稻的重要農藝性狀,現用品種都具有形成分蘗芽的特性,而分蘗芽的萌發生長則受水、肥等環境因素影響。當水培液氮濃度低于30 mg/L、土壤氮濃度降至30 mg/kg以下時,分蘗停止發生[6]。水稻分蘗芽三幼一基期當土壤水勢達-18 kPa并維持一個葉齡以上時,分蘗芽將轉入休眠狀態[7]。生產上利用分蘗芽萌發對氮素和水分反應敏感的原理,采用排水擱田和減少氮肥等措施控制無效分蘗的發生,但其效果受土壤、天氣和農田排灌條件影響。特別是中國南方稻區,水稻無效分蘗期往往遭遇連續陰雨,排水擱田措施常常無法實施到位,迫切需要研發對水稻分蘗具有“急剎車”調控效應的新技術。近年來,越來越多的學者意識到,化控技術作為傳統農業技術的發展與補充,在解決水稻無效分蘗控制中將發揮重要作用,并最終成為調控分蘗發生的最有效手段。
獨角金內酯是一種新發現的激素,并已被證明能夠抑制水稻分蘗的發生,目前的研究主要集中在獨角金內酯調控植物分枝發生的機理以及其合成和信號轉導途徑等,對其在水稻生產上的應用研究較少,本研究就獨角金內酯對水稻分蘗發生的作用及其機制,以及其應用前景等方面展開了綜述。
1 獨角金內酯對水稻分蘗的作用
水稻分蘗由葉腋內的腋芽活化生長形成,與植物分枝形成類似,受頂端生長優勢控制。頂端生長優勢又由一類具有抑制作用的生長素(auxin)調控,這類生長素在頂端產生(例如水稻的心葉),在莖中向基部運輸,影響腋芽生長。基于頂端生長優勢與腋芽生長的關系,近年來不少研究者在秧田期應用多效唑(PP333)和烯效唑(S-3307)減弱植物頂端生長優勢,促進側枝生長,培育水稻壯秧;于水稻有效分蘗終止期施用赤霉素(920)增強植物頂端生長優勢,抑制分蘗出生,減少無效分蘗,促進主莖和大分蘗生長與大穗[8-9]。然而,施加這類有促進頂端生長的激素,在促進或抑制水稻分蘗發生的同時,將產生很多副作用,如節間、葉片、葉鞘變長或變短、改變水稻生育進程等,這對水稻的安全生產有不利的影響。因此,在不影響水稻正常生長的前提下,如何安全有效地控制無效分蘗已成為水稻化控技術研究與應用的難點,迫切需要探索與頂端生長優勢無關調控水稻分蘗的新途徑。
獨角金內酯(strigolactones)是最近新發現的一種植物激素或其前體,它主要合成于根部,由類胡蘿卜素代謝產生,由形態學下端向形態學上端運輸,抑制芽的生長[10]。Umehara等[11]給水稻突變體d3、d10和d17施加獨角金內酯人工合成物GR24,發現d3突變體沒有恢復其野生表型、分蘗受到抑制,而d10和d17兩種突變體都恢復了野生表型,結果顯示獨角金內酯具有調控水稻分蘗的作用。Xu等[12]以常規水稻品種‘揚稻6號’和‘南粳44’為材料,在分蘗期進行了根部施加GR24試驗,結果顯示施加微量(2 μmol/L)的GR24就能對水稻分蘗產生很好的抑制效應,分蘗發生率較對照下降95個百分點以上,且未發現對水稻其他器官的生長產生影響。因此,獨角金內酯能較好地抑制水稻分蘗發生且副作用較小,這為水稻分蘗的化學調控開辟了新途徑。
2 水稻中獨角金內酯的合成及信號轉導
激素能夠調控植物枝條的形成,細胞分裂素和生長素在其中都發揮作用。但近年來對一系列多分枝突變體包括豌豆rms、擬南芥max、矮牽牛dad、水稻d和htd等突變體[13-20]的研究發現,還存在著第3種植物激素調控植物的分枝,并認為獨角金內酯就是MAX途徑產生的一種控制植物分枝的新激素[11,21],這與傳統的認為植物分枝由生長素和細胞分裂素這2種激素調控的理論有很大的不同,這一發現對于植物激素研究具有重要意義。
獨角金內酯最初從根寄生植物的根系分泌物中分離出來,被認為是種子萌發的刺激物。而到目前為止,獨角金內酯已經從許多種植物中分離得到,涉及獨角金內酯合成與信號的基因也陸續在高等植物如擬南芥、豌豆、矮牽牛等中發現。在水稻中,獨角金內酯合成和參與分蘗調控信號轉導途徑的研究也有報道,對其相關研究結果進行整理,獨角金內酯合成和信號轉導途徑大致可概括為圖1。其中,D17(編碼類胡蘿卜素裂解單加氧酶 CCD7)、D10(編碼 CCD8)和D27(編碼含鐵蛋白)3個基因已被證實直接參與了獨角金內酯的合成[20-28];在D17、D10和D27下游,細胞色素P450MAX1基因被認為是合成活性獨角金內酯所必須的[29-31],目前此基因只在擬南芥中被發現。D14位于獨角金內酯生物合成的下游,參與獨角金內酯的感應或生物合成途徑基因的反饋調節[32-34];D3參與了蛋白泛素化并介導蛋白質降解,是獨角金內酯信號轉導途徑的關鍵基因[22,25,35]。
水稻中D14和D3基因參與獨角金內酯的信號轉導過程,但其具體過程一直到2013年才被揭示,并得到了一個新的D53基因,在獨角金內酯存在的條件下,D53蛋白可與D14、D3蛋白互作,形成D53-D14-SCFD3蛋白復合體,D53蛋白進而被泛素化,從而特異地被蛋白酶體系統降解,誘導下游目標基因的表達以及獨角金內酯信號的響應[36-37]。
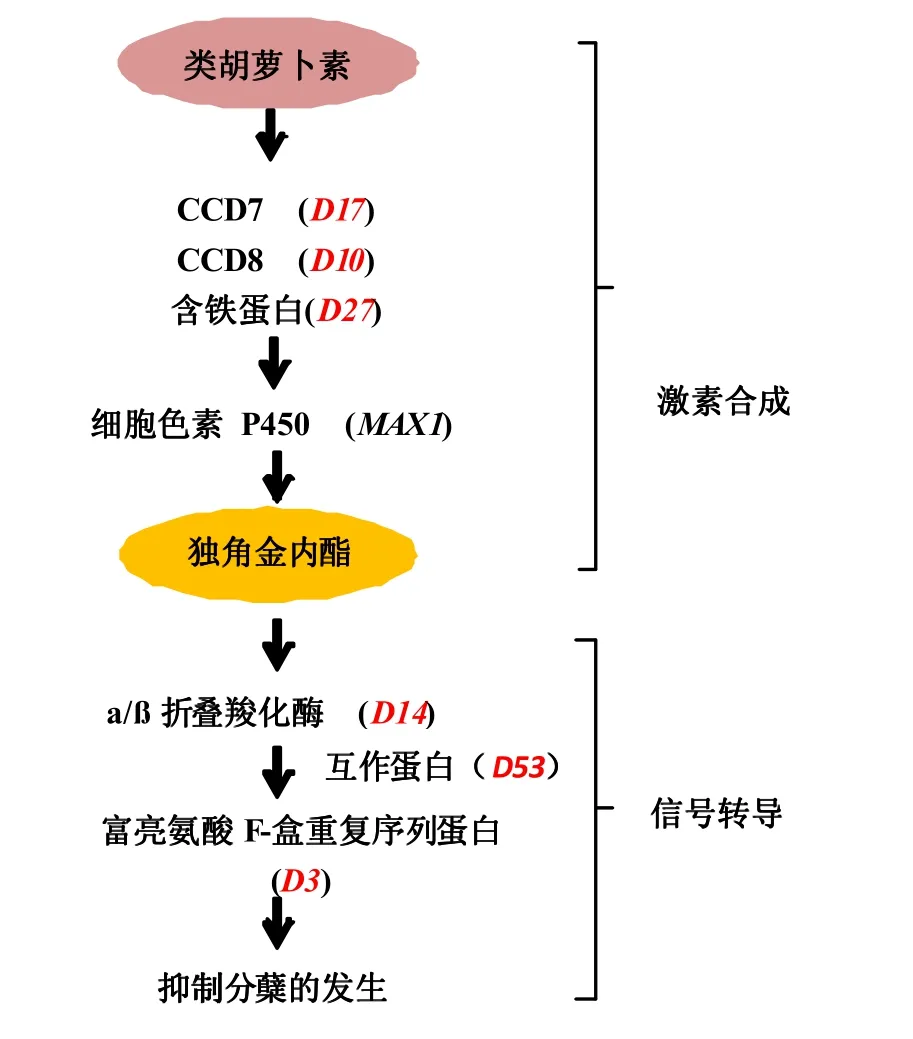
圖1 獨角金內酯合成及抑制分蘗的信號途徑
3 獨角金內酯抑制水稻分蘗發生的機制
獨角金內酯作為一種新的激素,通過復雜的網絡調控系統調控植物側枝發育,并與另外兩種重要激素細胞分裂素和生長素的相互作用有關。生長素于植物的頂端合成,通過極性向下運輸抑制側芽生長;獨角金內酯和細胞分裂素都于植物的根部合成,向上運輸至側芽中,但兩者的作用卻截然相反,前者抑制側芽生長,而后者可直接促進側芽的發生[38]。Liu等[39]的研究顯示,水稻去掉稻穗移除頂端生長素源之后,節部和腋芽中的細胞分裂素含量升高,節部新合成的細胞分裂素被運輸到腋芽,促進了已進入休眠狀態分蘗芽的萌發生長;對去穗移除頂端生長素源的水稻植株再進行葉面噴施生長素處理,植株已被激活進入萌發狀態的分蘗芽被恢復至休眠狀態,節部和腋芽中的細胞分裂素含量降低;結果認為細胞分裂素參與了生長素調控腋芽休眠與萌發生長的過程,而生長素調控水稻腋芽生長的作用可能是間接的,推測水稻腋芽生長可能不依賴生長素的長距離信號途徑。另有研究發現,生長素對植物側芽生長的抑制作用是通過促進獨角金內酯生物合成或抑制下部節間的細胞分裂素合成來完成[40-41],這對植物激素以及發育調控研究具有重要意義。
關于獨角金內酯調控植物分枝的機理,主要有生長素運輸管道形成假說和第二信使假說。生長素運輸管道形成假說認為,腋芽要被活化必須向外輸出自己合成的生長素,若生長素的外輸被阻止腋芽的活化則被抑制,獨角金內酯通過抑制腋芽生長素的外輸而阻止其活化[42],即:當獨角金內酯含量較低時,所有腋芽都能外輸生長素而被活化;當獨角金內酯含量升高時,腋芽因外輸生長素的過程被阻止而不能被活化。在第二信使假說中,獨角金內酯被認為是受生長素正向調控并向上運輸至腋芽中直接參與抑制腋芽生長[41]。然而,這2種假說都未被實驗所證實,并遭受到部分實驗結果的挑戰。Domagalska等[43]的研究發現,獨角金內酯能夠降低生長素輸出載體蛋白PIN在質膜的積累,暗示獨角金內酯并不是運輸到腋芽直接發揮作用。Liang等[44]的試驗顯示,在2個腋芽的系統中,基部施加獨角金內酯并沒有完全抑制兩個腋芽的生長,其中一個腋芽繼續生長,另一個腋芽轉入休眠狀態,這意味著獨角金內酯是通過增加了兩個腋芽之間的競爭而抑制另一個腋芽生長,并非通過阻止腋芽生長素的外輸抑制腋芽的活化。綜上所述,雖然獨角金內酯調控植物分枝已是不爭的事實,但其功能還沒有被完全揭示出來,要闡明其到底以何種方式來調控腋芽的生長,急需進一步鑒定其調控基因和信號轉導途徑。
水稻有很多獨角金內酯合成和信號傳導的突變體,被認為是研究獨角金內酯的理想材料[10]。水稻也是世界上最重要的糧食作物之一,并具有分蘗特性,深入研究獨角金內酯在調控水稻分蘗上的作用,闡明獨角金內酯調控水稻分蘗發生的分子機理和信號轉導途徑,為水稻分蘗發生的化學調控提供理論依據,以尋求水稻的增產的有效途徑。
4 展望
獨角金內酯自2008年被證實為繼生長素和細胞分裂素之后的第3大激素以來,學者們利用不同的模式植物,對其能夠抑制植物分枝發生的功能及作用機制進行了大量細致的研究,并提出了其與生長素和細胞分裂素的相互關系,但其中仍存在一些未知和爭議,未來的研究方向將側重于研究這三者之間的調控網絡,并對獨角金內酯的信號轉導途徑進行更為細致和深化的描繪。
獨角金內酯對水稻分蘗發生的抑制作用早已被多位學者證實,但目前為止,還未應用于水稻生產上,究其原因,可歸納為兩點:(1)獨角金內酯及其類似物(如常用的GR24)價格過于昂貴,盡管極微量的GR24就能抑制水稻分蘗的發生,但應用于稻田控蘗仍需要極大的成本,得不償失。(2)目前對于獨角金內酯抑制水稻分蘗發生的研究僅僅局限于盆栽或者培養基培養,施加的獨角金內酯都由根部吸收,向上運輸至分蘗芽中并抑制其萌發,這種施加方式在實際生產中操作難度大,遠沒有直接葉面噴施方便快捷,而葉面噴施獨角金內酯是否也能夠高效率地抑制水稻分蘗,都未見有相關研究。因此,未來的研究重點在于探索出能夠大批量生產有活性GR24的方法,以降低其生產成本,另外還需摸索出合適的葉面噴施方法,例如噴施的濃度和噴施時期等。如果能解決上述問題,那么獨角金內酯作為水稻生產過程中無副作用的控蘗劑,其應用前景是巨大的,這亟待農業科技工作者去探索,去解答。
[1] Dun E A,Ferguson B J,Beveridge C A.Apical dominance and shoot branching.Divergent opinions or divergent mechanisms[J].Plant Physiology,2006,142:812-819.
[2] 楊惠杰,李義珍,楊高群.超高產水稻的分蘗特性觀察[J].福建農業學報,2003,18(4):205-208.
[3] 凌啟鴻.水稻精確定量栽培理論與技術[M].北京:中國農業出版社,2006:49-51.
[4] Li X Y,Qian Q,Fu Z M,et al.Control of tillering in rice[J].Nature,2003,422:618-621.
[5] 李學勇,錢前,李家洋.水稻分蘗的分子機理研究[J].中國科學院院刊,2003(4):274-276.
[6] 丁艷鋒,黃丕生,凌啟鴻.水稻分蘗發生及與特定部位葉片葉鞘含氮率的關系[J].南京農業大學學報,1995,18(4):14-18.
[7] 蔣彭炎,馬躍芳,洪曉富,等.水稻分蘗芽的環境敏感期研究[J].作物學報,1994,20(3):290-296.
[8] 王熹.水稻分蘗的化學調節[J].中國稻米,1995(2):35-36.
[9] 張祖德.提高水稻成穗率的化學調控技術研究[J].福建稻麥科技,2006,24(2):10-13.
[10] 陳彩艷,鄒軍煌,張淑英.獨角金內酯能抑制植物的分枝并介導植物與樅枝真菌及寄生植物間的相互作用[J].生命科學,2009,39(6):525-533.
[11] Umehara M,Hanada A,Yoshida S,et al.Inhibition of shoot branching by new terpenoid plant hormones[J].Nature,2008,455(7210):195-200.
[12] Xu J,Ding C,Ding Y,et al.A Proteomic Approach to Analyze Differential Regulation of Proteins During Bud Outgrowth Under Apical Dominance Based on the Auxin Transport Canalization Model in Rice(Oryza sativaL.)[J].Journal of Plant Growth Regulation,2015,34(1):122-136.
[13] BeveridgeC,SymonsG,TurnbullC.Auxin inhibition of decapitation-induced branching is dependent on graft-transmissible signals regulated by genes Rms1 and Rms2[J].Plant Physiology,2000,123:689-698.
[14] Stirnberg P,van De Sande K,Leyser O.MAX1 and MAX2 control shoot lateral branching inArabidopsis[J].Development,2002,129:1131-1141.
[15] Turnbull C G,Booker J P,Leyser O.Micrografting techniques for testing long-distance signalling inArabidopsis[J].The Plant Journal,2002,32:255-262.
[16] Booker J,Auldridge M,Wills S,et al.MAX3/CCD7 is a carotenoid cleavage dioxygenase required for the synthesis of a novel plant signaling molecule[J].Current Biology,2004,14:1232-1238.
[17] Booker J,Sieberer T,Wright W,et al.MAX1 encodes a cytochrome P450 family member that acts downstream of MAX3/4 to produce a carotenoid-derived branch-inhibiting hormone[J].Developmental Cell,2005,8:443-449.
[18] Simons J L,Napoli C A,Janssen B J,et al.Analysis of the DECREASED APICAL DOMINANCE genes of petunia in the control of axillary branching[J].Plant Physiology,2007,143:697-706.
[19] Zou J H,Zhang S Y,Zhang W P,et al.The rice HIGH-TILLERING DWARF1 encoding an ortholog of Arabidopsis MAX3 is required for negative regulation of the outgrowth of axillary buds[J].The Plant Journal,2006,48:687-696.
[20] Arite T,Iwata H,Ohshima K,et al.DWARF10,an RMS1/MAX4/DAD1 ortholog,controls lateral bud outgrowth in rice[J].The Plant Journal,2007,51:1019-1029.
[21] Gomez-Roldan V,Fermas S,Brewer P B,et al.Strigolactone inhibition of shoot branching[J].Nature,2008,455:189-195.
[22] Ishikawa S,Masahiko M,Tomotsugu A,et al.Suppression of tiller bud activity in tillering dwarf mutant of rice[J].Plant Cell Physiol,2005,46(1):79-86.
[23] Sorefan K,Booker J,Haurogne K,et al.MAX4 and RMS1 are orthologous dioxygenase-like genes that regulate shoot branching inArabidopsis and pea[J].Gene Dev,2003,17:1469-1474.
[24] Booker J,Auldridge M,Wills S,et al.MAX3/CCD7 Is a Carotenoid Cleavage Dioxygenase Required for the Synthesis of a Novel Plant Signaling Molecule[J].Curr.Biol,2004,14:1232-1238.
[25] Johnson X,Brcich T,Dun E A,et al.Branching genes are conserved across species.Genes controlling a novel signal in pea are co-regulated by other long-distance signals[J].Plant Physiol,2006,142:1014-1026.
[26] Drummond R S,Martínez-Sánchez N M,Janssen B J,et al.Petunia hybridaCAROTENOID CLEAVAGE DIOXYGENASE7is involved in the production of negative and positive branching signals in petunia[J].Plant Physiol,2009,151:1867-1877.
[27]Snowden K C,Simkin A J,Janssen B J,et al.The decreased apical dominance1/Petunia hybrida CAROTENOID CLEAVAGE DIOXYGENASE8 gene affects branch production and plays a role in leaf senescence,root growth,and flower development[J].Plant Cell,2005,17:746-759.
[28] Lin H,Wang R,Qian Q,et al.DWARF27,an iron-containing protein required for the biosynthesis of strigolactones,regulates rice tiller bud outgrowth[J].Plant Cell,2009,21:1512-1525.
[29] Booker J,Sieberer T,Wright W,et al.MAX1 encodes a cytochrome P450 family member that acts downstream of MAX3/4 to produce a carotenoid-derived branch-inhibiting hormone[J].Dev.Cell,2005,8:443-449.
[30] Kohlen W,Charnikhova T,Liu Q,et al.Strigolactones are transported through the xylem and play a key role in shoot architectural response to phosphate deficiency in nonarbuscular mycorrhizal hostArabidopsis[J].Plant Physiol,2011,155:974-987.
[31] Scaffidi A,Waters M T,Ghisalberti E L,et al.and Smith SM.Carlactone-independent seedling morphogenesis inArabidopsis[J].Plant J,2013,76:1-9.
[32] Arite T,Umehara M;Ishikawa S,et al.d14,a strigolactoneinsensitive mutant of rice,shows an accelerated outgrowth of tillers[J].Plant Cell Physiol,2009,50:1416-1424.
[33] Liu W,Wu C,Fu Y P,et al.Identification and characterization of HTD2:a novel gene negatively regulating tiller bud outgrowth in rice[J].Planta,2009,230:649-658.
[34] Gao Z,Qian Q,Liu X,et al.Dwarf88,a novel putative esterase gene affecting architecture of rice plant[J].Plant Mol.Biol,2009,71:265-276.
[35] Stirnberg P,van De Sande K,Leyser O.MAX1 and MAX2 control shoot lateral branching inArabidopsis[J].Development,2002,129:1131-1141
[36] Jiang L,Liu X,Xiong G S,et al.DWARF 53 acts as a repressor of strigolactone signalling in rice[J].Nature,2013,504:401-405.
[37] Zhou F,Lin Q B,Zhu L H,et al.D14-SCFD3-dependent degradation of D53 regulates strigolactone signaling[J].Nature,2013,504:406-410.
[38] 馮丹,陳貴林.獨角金內酯調控側枝發育的研究進展[J].生態學雜志,2011,30(2):349-356.
[39] Liu Y,Xu J X,Ding Y F,et al.Auxin inhibits the outgrowth of tiller buds in rice by downregulating OsIPT expression and cytokinin biosynthesis in nodes[J].Australian Journal of Crop Science,2011,5(2):169-174.
[40] Johnson X,Brcich T,Dun E A,et al.Branching genes are conserved across species.Genes controlling a novel signal in pea are co-regulated by other long-distance signals[J].Plant Phy siology,2006,142:1014-1026.
[41] Brewer P B,Dun E A,Ferguson B J,et al.Strigolactone acts downstream of auxin to regulate bud outgrowth in pea andArabidopsis[J].Plant Physiology,2009,150:482-493.
[42] Prusinkiewicz P,Crawford S,Smith RS,et al.Control of bud activation by an auxin transport switch[J].PNAS,2009,106,17431-17436.
[43] Domagalska M A,Leyser O.Signal integration in the control of shoot branching[J].Nat Rev Mol Cell Biol,2011,12(4):211-221.
[44] Liang J,Zhao L,Challis R,et al.Strigolactone regulation of shoot branching in chrysanthemum(Dendranthema grandiflorum)[J].J Exp Bot,2010,61(11):3069-3078.

