子宮內(nèi)膜樣腺癌術(shù)后再發(fā)陰道未分化多形性肉瘤1例及文獻(xiàn)分析
韓肖彤 劉 晨 李銳銳 王永軍
(北京大學(xué)國際醫(yī)院婦產(chǎn)科,北京 102206)
子宮內(nèi)膜癌術(shù)后復(fù)發(fā)主要與局部治療不徹底或首次治療時已發(fā)生治療范圍外的亞臨床轉(zhuǎn)移癌,具有腫瘤復(fù)發(fā)的高危因素如病理分級高、肌層浸潤深度深、盆腔及腹主動脈旁淋巴結(jié)轉(zhuǎn)移和腹腔沖洗液中有癌細(xì)胞等有關(guān)[1]。復(fù)發(fā)部位以局部復(fù)發(fā)最為常見,其中62%~73%局限在陰道[2]。陰道頂端復(fù)發(fā)與宮頸受累關(guān)系較為密切。陰道或殘端復(fù)發(fā)可有陰道細(xì)胞學(xué)異常、不規(guī)則陰道出血、尿頻、排尿排便困難甚至血尿、血便、直腸梗阻等[2]。復(fù)發(fā)并不一定存在典型的臨床癥狀,術(shù)后再出現(xiàn)病灶也不一定是腫瘤復(fù)發(fā)。判斷術(shù)后再發(fā)病灶究竟是腫瘤復(fù)發(fā)還是多發(fā)腫瘤,需結(jié)合病史特點(diǎn)、病理結(jié)果等進(jìn)行綜合分析。本文報道1例子宮內(nèi)膜樣腺癌術(shù)后再發(fā)未分化多形性肉瘤,再次行手術(shù)加術(shù)后化療,根據(jù)臨床病例資料及免疫組化特點(diǎn),并結(jié)合文獻(xiàn)對其臨床特點(diǎn)、診斷要點(diǎn)及其預(yù)后予以探討。
1 臨床資料
患者47歲,主因“子宮內(nèi)膜癌術(shù)后4個月,陰道出血1個月”門診以“高分化子宮內(nèi)膜樣腺癌ⅠA期術(shù)后;陰道殘端未分化多形性肉瘤”于2017年10月19日收住院。2017年3月開始陰道淋漓出血,6月13日行B超示宮腔內(nèi)不均質(zhì)高回聲,內(nèi)可見較豐富血流信號,當(dāng)?shù)蒯t(yī)院行診斷性刮宮,術(shù)后病理子宮內(nèi)膜復(fù)雜性增生伴非典型增生,不除外小區(qū)癌變。6月15日行盆腔增強(qiáng)MRI示子宮后壁肌瘤,子宮內(nèi)膜不厚。血CA125 39.27 IU/ml(正常值≤35 IU/ml)。于6月17日在當(dāng)?shù)蒯t(yī)院行腹腔鏡全子宮雙附件切除術(shù),術(shù)中剖視子宮見:宮腔后壁可見約3 cm×4 cm不規(guī)則贅生物,肌層可見侵犯,宮頸管內(nèi)未見異常。術(shù)后病理:高分化子宮內(nèi)膜樣腺癌,癌組織侵犯子宮肌層<1/2肌層。免疫組化:ER(10%+),PR(60%+),CK7(+),CEA(灶+),Vimentin(-),P16(+),P53野生型表達(dá),Ki-67(30%+)。術(shù)后1個月于當(dāng)?shù)厝揍t(yī)院復(fù)查,考慮未行淋巴結(jié)切除,7月13日行PET-CT提示陰道殘端放射性分布較濃聚,SUVmax約5.0,考慮術(shù)后改變(圖1)。于8月14日行子宮內(nèi)膜癌補(bǔ)充手術(shù)——腹腔鏡盆腹腔淋巴結(jié)切除術(shù),術(shù)后病理:送檢淋巴結(jié)未見癌轉(zhuǎn)移(左盆腔0/9,右盆腔0/8,腹主動脈旁0/5)。2017年9月開始陰道出血,略少于月經(jīng)量,查體見陰道殘端1 cm贅生物,活檢病理示未分化多形性肉瘤。此后陰道出血淋漓不凈,無腹脹、腹痛、惡心、嘔吐、尿頻、便秘、腹瀉等不適。否認(rèn)家族腫瘤病史。孕1產(chǎn)1。
入院查體婦科檢查:陰道殘端被一直徑9 cm×6 cm×5 cm的腫物占據(jù),表面可見暗紅色血跡,盆腔可觸及與陰道殘端相連的7 cm×6 cm×6 cm包塊,質(zhì)軟,活動度差,無壓痛。盆腔MRI(10月17日)(圖2):原子宮區(qū)可見混雜信號腫塊影,外周呈等T1稍長混雜T2信號,DWI呈高信號,增強(qiáng)掃描明顯異常強(qiáng)化,其內(nèi)可見片狀等T1短T2信號,DWI呈低信號,增強(qiáng)掃描未見強(qiáng)化,大小約6.3 cm×5.5 cm×12.2 cm,邊緣毛糙,與膀胱及盆壁之間脂肪間隙存在。陰道B超(10月19日):陰道斷端可見低回聲包塊8.8 cm×5.2 cm×4.7 cm,形態(tài)不規(guī)則,邊界尚清,回聲不均勻,可探及血流信號。腹盆部增強(qiáng)CT(10月24日)(圖3):陰道斷端可見不規(guī)則腫塊向腹盆腔內(nèi)生長,呈等低混雜密度,大小約5.7 cm×7.6 cm×7.4 cm,增強(qiáng)掃描腫塊周圍明顯強(qiáng)化,腫塊中心呈不規(guī)則無強(qiáng)化區(qū),腫塊前上部與乙狀結(jié)腸遠(yuǎn)端關(guān)系密切,前下端與膀胱壁關(guān)系密切,腹盆腔未見積液及腫大淋巴結(jié)。北京協(xié)和醫(yī)院及我院病理會診(10月24日):全子宮標(biāo)本(圖4):高分化子宮內(nèi)膜樣腺癌,侵犯淺肌層(<1/2子宮壁),未見脈管侵犯。陰道殘端贅生物標(biāo)本(圖5):結(jié)合免疫組化符合未分化多形性肉瘤。免疫組化結(jié)果:CK7(-),EMA(局灶+),S-100(-),WT1(局灶+),Vimentin(+),CD10(+),Desmin(-),SMA(+),Myogenin(+),H-caldesmon(+),Ki-67(50%+)。未行腸鏡檢查。
于10月31日在全麻下行開腹陰道殘端病灶整體切除+直腸、乙狀結(jié)腸部分切除吻合術(shù),術(shù)中見(圖6):陰道殘端病灶約8 cm,與膀胱、乙狀結(jié)腸粘連融合,界限不清,右側(cè)腹膜表面近膀胱處可見直徑1 cm的病灶累及,肝、膽、胰、脾、其余腸管、大網(wǎng)膜表面未見明顯病灶。腹膜后途徑分離陰道殘端病灶,見病灶累及部分乙狀結(jié)腸腸管及膀胱漿膜層。切除腹膜表面受累病灶,沿膀胱表面小心分離病灶,整塊切除陰道病灶及周圍2 cm的部分陰道。因病灶累及乙狀結(jié)腸腸管,行腸管部分切除吻合術(shù)。手術(shù)時間270 min,術(shù)中出血1200 ml,輸液4840 ml,其中壓積紅細(xì)胞4 U。
術(shù)后病理結(jié)果(圖7):(陰道殘端病灶)結(jié)合免疫組化,符合未分化多形性肉瘤,腫瘤組織侵出外膜層;可見脈管內(nèi)瘤栓及神經(jīng)侵犯;(乙狀結(jié)腸)腫瘤侵犯腸壁至黏膜下層;腸系膜淋巴結(jié)未見腫瘤轉(zhuǎn)移(0/7)。免疫組化染色結(jié)果:CK7(-),S-100(部分+),WT1(少量+),CD34(血管+),CD10(部分+),SMA(-),Myogenin(-),Ki-67(熱點(diǎn)區(qū)約30%+),Desmin(-),CD68(+),ER(-),PR(-),CD99(+)。
術(shù)后診斷:未分化多形性肉瘤Ⅲb期;高分化子宮內(nèi)膜樣腺癌ⅠA期。術(shù)后3周開始(2017年11月20日~2018年1月17日)行IEP(異環(huán)磷酰胺+表柔比星+順鉑)方案靜脈化療3個療程,具體方案:異環(huán)磷酰胺(2 g/d,d1~d3)+表柔比星(90 mg)+順鉑(100 mg)。腫瘤標(biāo)志物CA125、CA19-9、CEA、AFP、CA15-3術(shù)前、術(shù)后均正常,CA72-4術(shù)前正常,術(shù)后第1療程化療后升高至28.9 U/ml(正常值≤8.2 U/ml),第2療程后降至10.6 U/ml。現(xiàn)化療3個療程結(jié)束,未發(fā)現(xiàn)復(fù)發(fā)、轉(zhuǎn)移征象,擬繼續(xù)化療3個療程。
2 討論
2.1 子宮內(nèi)膜癌術(shù)后陰道殘端腫瘤診斷相關(guān)問題
子宮內(nèi)膜癌復(fù)發(fā)是指子宮內(nèi)膜癌經(jīng)系統(tǒng)的初始治療完全緩解一段時間后(采用放療者為3個月,未放療者為6個月以上),臨床又發(fā)現(xiàn)新的癌灶,且組織病理類型與原發(fā)灶完全一致[3]。未控是指未完成有效治療或首次治療后仍有殘余腫瘤,包括放療結(jié)束后3個月內(nèi)原發(fā)腫瘤持續(xù)存在,或盆腔內(nèi)出現(xiàn)新病灶;或手術(shù)中腫瘤未能切凈;或系統(tǒng)性化療結(jié)束后腫瘤病灶仍然存在等。規(guī)范性治療后總復(fù)發(fā)率為10%~20%,其中治療后1年內(nèi)復(fù)發(fā)者占50%,Ⅰ期復(fù)發(fā)率約15%[4]。復(fù)發(fā)的高危因素包括年齡、組織學(xué)分級、細(xì)胞類型、腫瘤分期、肌層浸潤深度、宮頸受累、宮腔受累范圍、淋巴血管間隙浸潤及腫瘤組織的一些生物學(xué)標(biāo)志(如腫瘤新生血管、激素受體、癌基因、抑癌基因、DNA倍體等)[3]。本例為中年女性,首次手術(shù)病理為高分化子宮內(nèi)膜樣腺癌ⅠA期,術(shù)中剖視子宮見:宮腔后壁可見約3 cm×4 cm不規(guī)則贅生物,肌層可見侵犯,宮頸管內(nèi)未見異常,陰道斷端光滑。病灶距離陰道斷端較遠(yuǎn),故陰道斷端腫瘤殘留可能性較小。本例子宮內(nèi)膜樣腺癌期別早,高分化,手術(shù)徹底,無淋巴結(jié)轉(zhuǎn)移及淋巴血管間隙受累,無附件及宮旁受累,故不存在腫瘤復(fù)發(fā)的高危因素。但術(shù)后3個月即出現(xiàn)陰道出血并發(fā)現(xiàn)陰道殘端病灶,因有子宮內(nèi)膜癌病史,首先應(yīng)考慮腫瘤復(fù)發(fā)問題。對于子宮內(nèi)膜癌術(shù)后陰道殘端復(fù)發(fā)患者,首選近距離或盆腔外照射放療,若盆腔瘤灶較大,單純放化療很難奏效時,積極徹底的減瘤或許為改善預(yù)后的有效手段。但復(fù)發(fā)病灶多為浸潤性生長,而根據(jù)影像學(xué)表現(xiàn),該病灶為膨脹性生長,且短時間內(nèi)迅速增大,提示惡性程度極高。陰道病灶活檢及手術(shù)切除組織學(xué)證實(shí)腫瘤為起源于間葉組織的軟組織肉瘤,與子宮內(nèi)膜癌病理不相符,且術(shù)中未發(fā)現(xiàn)原發(fā)腫瘤復(fù)發(fā)和轉(zhuǎn)移征象,故可以明確并非子宮內(nèi)膜癌復(fù)發(fā)或未控,而是與首次子宮內(nèi)膜樣腺癌無關(guān)的多發(fā)性原發(fā)性惡性腫瘤(multiple primary malignant neoplasm,MPMN)。
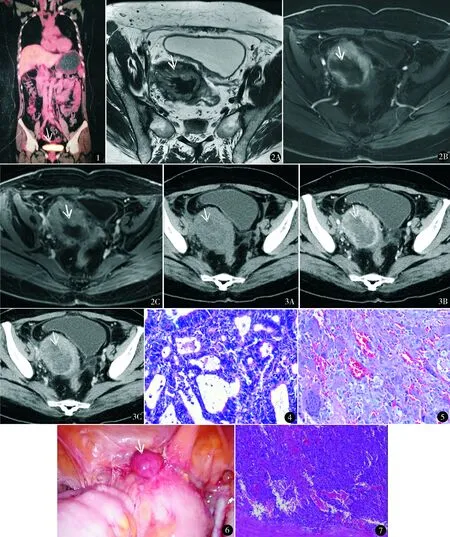
圖1 PET-CT提示陰道殘端高代謝 圖2 MRI軸位T2WI不抑脂序列(A)、增強(qiáng)掃描動脈早期(B)和靜脈期(C)示原子宮區(qū)混雜信號腫塊影 圖3 CT軸位平掃(A)、動脈期(B)和靜脈期(C)示陰道斷端不規(guī)則腫塊向腹盆腔內(nèi)生長,呈等低混雜密度 圖4 全子宮切除標(biāo)本病理(HE染色 ×400):高分化子宮內(nèi)膜樣腺癌,腺體不規(guī)則,有融合,呈篩狀 圖5 陰道殘端贅生物病理(HE染色 ×200):可見多核巨細(xì)胞、較多異型細(xì)胞。結(jié)合免疫組化符合未分化多形性肉瘤 圖6 術(shù)中所見(箭頭所指及其下方埋在組織中的均為病灶) 圖7 陰道殘端病灶術(shù)后病理(HE染色 ×100):低分化肉瘤,呈實(shí)性,細(xì)胞異型性大。結(jié)合免疫組化,符合未分化多形性肉瘤
MPMN指同一個體的單個或多個器官同時或先后發(fā)生2種或2種以上彼此無關(guān)的原發(fā)性惡性腫瘤,診斷沿用1932年Warren和Cates提出、1979年劉復(fù)生[5]補(bǔ)充的標(biāo)準(zhǔn):每一腫瘤必須是原發(fā)的惡性腫瘤并有其特殊的病理形態(tài),排除轉(zhuǎn)移癌,腫瘤發(fā)生在不同部位或器官(包括同一器官的不同位置)。Tichansky等[6]認(rèn)為,第二原發(fā)性惡性腫瘤在第一腫瘤治療后平均5~7年內(nèi)發(fā)生,且間隔時間越短,預(yù)后越差。惡性腫瘤治療后的5年內(nèi)是復(fù)發(fā)的高峰期,第二原發(fā)性惡性腫瘤發(fā)生時間與第一腫瘤復(fù)發(fā)的時間點(diǎn)基本重合,因此,惡性腫瘤治療后出現(xiàn)的新癌灶在考慮轉(zhuǎn)移或復(fù)發(fā)的同時,應(yīng)注意排除新發(fā)生的惡性腫瘤的可能。在臨床工作中,MPMN容易與單發(fā)原發(fā)性惡性腫瘤轉(zhuǎn)移和復(fù)發(fā)混淆,病理學(xué)診斷起著重要的、決定性的作用。根據(jù)組織病理類型的不同,診斷MPMN難度不大,但相同病理類型如何與復(fù)發(fā)、轉(zhuǎn)移相鑒別,需結(jié)合病理形態(tài)的獨(dú)特性、臨床表現(xiàn)、隨訪預(yù)后及有無癌前病變。
本例陰道殘端病灶術(shù)后病理結(jié)合免疫組化診斷未分化多形性肉瘤。未分化多形性肉瘤(undifferentiated pleomorphic sarcoma,UPS)以往稱為惡性纖維組織細(xì)胞瘤(malignant fibrous histiocytoma,MFH),起源于間葉組織,是成人較常見的軟組織肉瘤,占所有軟組織肉瘤的20%~30%[7]。因?yàn)槠浣M織學(xué)來源及分化方向仍不明確,2002年WHO重新評估和修訂了MFH的術(shù)語及分類方法[8],以UPS代替了MFH但這種分類方法仍存在爭議,根據(jù)2013年WHO的最新分類[9],UPS歸于未分化/不能分類的肉瘤(undifferentiated/unclassified sarcomas)。
UPS好發(fā)于中老年人,高發(fā)年齡為50~70歲,男性多于女性,多發(fā)生于四肢深部軟組織,特別是下肢,尤以大腿多見,其次是腹膜后、軀干等,亦可發(fā)生于骨骼、頭頸部、胰腺、肝、腎等其他部位。Nakayama等[10]報道,75%的病變位于四肢,90%的病變部位較深,常位于肌肉內(nèi)。該病臨床表現(xiàn)缺乏特異性,惡性度高,復(fù)發(fā)率高,預(yù)后差。
UPS缺乏特異性免疫組化標(biāo)記,病理主要為排除性診斷。大部分腫瘤對Vimentin、肌動蛋白(Actin)、CD68、α1抗胰蛋白酶(α1-AT)、α1抗胰糜蛋白酶(α1-ACT)呈陽性,少部分對Desmin、角蛋白(Keratin)、S-100、Ki-67、NF蛋白等呈灶性陽性[11],提示腫瘤可能是原始間葉細(xì)胞來源,部分具有纖維母細(xì)胞及肌纖維母細(xì)胞特征,并一定程度表達(dá)組織細(xì)胞標(biāo)記。本例陰道殘端贅生物表現(xiàn)為異型性顯著的高級別肉瘤樣結(jié)構(gòu),無腺體分化特征,且免疫組化不表達(dá)上皮標(biāo)記,ER、PR均為陰性,故考慮并非子宮內(nèi)膜癌復(fù)發(fā),而是新發(fā)的未分化多形性肉瘤。
盡管CT、MRI對其檢出率幾乎達(dá)到100%,但是由于影像表現(xiàn)多樣,術(shù)前常被誤診或不能確診。影像上呈邊界不清的類圓形或不規(guī)則團(tuán)塊狀影,無明顯包膜;腫瘤內(nèi)常伴滲出、壞死、囊變,病灶實(shí)性部分信號混雜,CT呈等低混雜密度;T1WI呈等低信號,T2WI上若瘤體以組織細(xì)胞為主,細(xì)胞含水量高,則呈高信號,以纖維成分為主則呈等信號;增強(qiáng)掃描腫瘤實(shí)性部分呈中度不均勻強(qiáng)化。本例腹盆部增強(qiáng)CT提示陰道斷端可見不規(guī)則腫塊向腹盆腔內(nèi)生長,呈等低混雜密度,增強(qiáng)掃描腫塊周圍明顯強(qiáng)化,平掃、動脈期及靜脈期CT值分別為37、83、75 HU,腫塊中心呈不規(guī)則無強(qiáng)化區(qū)。盆腔MRI提示原子宮區(qū)可見混雜信號腫塊影,外周呈等T1稍長混雜T2信號,DWI呈高信號,增強(qiáng)掃描明顯異常強(qiáng)化,其內(nèi)可見片狀等T1短T2信號,DWI呈低信號,增強(qiáng)掃描未見強(qiáng)化,邊緣毛糙。CT及MRI均對病灶有一個較清晰的影像提示,但明確診斷仍需要結(jié)合術(shù)中所見及術(shù)后病理。
2.2 陰道殘端肉瘤的治療
目前多數(shù)學(xué)者認(rèn)為[12],MPMN應(yīng)采取與單發(fā)性惡性腫瘤相同的治療原則,即根據(jù)腫瘤的分期、累及的器官及病理類型等,同時結(jié)合患者自身?xiàng)l件,盡量采取手術(shù)為主,放化療及生物治療為輔的綜合治療方案。確診或高度懷疑為子宮內(nèi)膜癌的患者首選手術(shù)治療,推薦標(biāo)準(zhǔn)的子宮內(nèi)膜癌分期手術(shù),即全子宮+雙附件+盆腔淋巴結(jié)+腹主動脈旁淋巴結(jié)切除術(shù)[13]。與開腹手術(shù)相比,在早期子宮內(nèi)膜癌的治療中,腹腔鏡手術(shù)是安全可行的[14]。目前UPS臨床治療方案很多,主要以手術(shù)切除為主,輔助放化療,但其術(shù)后腫瘤復(fù)發(fā)率及轉(zhuǎn)移率較高,預(yù)后較差,早期發(fā)現(xiàn)和完整切除腫瘤是必要的。本例先因子宮內(nèi)膜癌行腹腔鏡全子宮+雙附件+盆腔淋巴結(jié)切除術(shù),術(shù)后病理為高分化子宮內(nèi)膜樣腺癌ⅠA期,無需添加輔助治療;術(shù)后陰道殘端出現(xiàn)巨大病灶,活檢提示低分化肉瘤,存在單發(fā)、孤立的巨塊型病灶,應(yīng)先行徹底的減瘤術(shù),故行陰道殘端病灶切除+直腸、乙狀結(jié)腸部分切除吻合術(shù),術(shù)后病理提示未分化多形性肉瘤,惡性程度高,預(yù)后較差,需加用化療。子宮肉瘤的術(shù)后輔助治療以化療為主,選擇化療方案時,單藥和聯(lián)合化療方案可能均有效,但應(yīng)綜合評估,選擇最佳方案。常用的單藥化療藥物有多柔比星、表柔比星、順鉑、異環(huán)磷酰胺和達(dá)卡巴嗪[15]。聯(lián)合化療目前尚無理想、統(tǒng)一的方案,尤其對于各種不同組織學(xué)亞型,選擇何種化療藥物及化療藥物劑量仍有爭議。常用的聯(lián)合化療方案主要有異環(huán)磷酰胺+表柔比星+順鉑、吉西他濱+多西他賽、多柔比星+順鉑+氮烯咪胺、長春新堿+放線菌素D+環(huán)磷酰胺、羥基脲+達(dá)卡巴嗪+依托泊苷、環(huán)磷酰胺+長春新堿+多柔比星+達(dá)卡巴嗪等,對于未分化子宮內(nèi)膜肉瘤,通常認(rèn)為其對化療不敏感,輔助化療用于未分化子宮內(nèi)膜肉瘤治療的報道較少,多采用以鉑類為主的化療。Yamagami等[16]對11例接受異環(huán)磷酰胺+多柔比星+順鉑化療的復(fù)發(fā)性子宮肉瘤的研究顯示,反應(yīng)率為36.4%,疾病控制率為90.9%。本例術(shù)后采用異環(huán)磷酰胺+表柔比星+順鉑方案,目前仍在化療中,療效還有待進(jìn)一步觀察。
2.3 經(jīng)驗(yàn)教訓(xùn)
MPMN的預(yù)后難以統(tǒng)計(jì),受到多種因素的影響。總體來講,MPMN若能早期發(fā)現(xiàn)并進(jìn)行干預(yù),其預(yù)后不一定比單原發(fā)癌差[17],甚至明顯優(yōu)于單原發(fā)惡性腫瘤的復(fù)發(fā)或轉(zhuǎn)移。本例初次就診行子宮內(nèi)膜活檢發(fā)現(xiàn)子宮內(nèi)膜復(fù)雜性增生伴非典型增生,不除外小區(qū)癌變,行盆腔增強(qiáng)MRI示子宮內(nèi)膜不厚,但未行宮頸細(xì)胞學(xué)檢測。初次手術(shù)僅行全子宮雙附件切除,行PET-CT后加做盆腔淋巴結(jié)切除術(shù)。初次手術(shù)后3個月即發(fā)現(xiàn)陰道殘端病灶并再次手術(shù)。是否能早期發(fā)現(xiàn)病灶,避免第一次術(shù)后短期內(nèi)再次手術(shù)呢?我們可以在以下幾方面做出改進(jìn):初次就診最好行宮腔鏡檢查+子宮內(nèi)膜活檢,可以增加宮腔鏡下診斷,亦可以更好地選擇活檢取材部位,減少漏診;MRI應(yīng)提示子宮內(nèi)膜與肌層之間的子宮結(jié)合帶是否完整,手術(shù)醫(yī)生應(yīng)與影像科醫(yī)生共同閱片,以幫助評估子宮內(nèi)膜癌期別,從而指導(dǎo)手術(shù)方式;術(shù)前還應(yīng)行宮頸細(xì)胞學(xué)檢查。若術(shù)前做好更為充分的評估,初次手術(shù)即行全子宮雙附件+盆腔淋巴結(jié)切除術(shù),可以減少手術(shù)次數(shù);若先行宮頸細(xì)胞學(xué)檢查,或許有可能在初次手術(shù)前發(fā)現(xiàn)陰道病變,若行子宮切除時同時切除部分陰道,是否能避免陰道殘端病灶出現(xiàn),還有待進(jìn)一步研究。
1 王 芳.子宮內(nèi)膜癌復(fù)發(fā)的影響因素分析及相應(yīng)治療方案.實(shí)用癌癥雜志,2017,32(5):820-822.
2 Scholten AN,van Putten WL,Beerman H,et al.Postoperative radiotherapy for Stage 1 endometrial carcinoma:long-term outcome of the randomized PORTEC trial with central pathology review.Int J Radiat Oncol Biol Phys,2005,63(3):834-838.
3 熊光武.子宮內(nèi)膜癌的復(fù)發(fā)及轉(zhuǎn)移.見:王建六,主編.子宮內(nèi)膜癌.第2版.北京:北京大學(xué)醫(yī)學(xué)出版社,2017.366-403.
4 高 敏,蔣國慶,燕 鑫,等.子宮內(nèi)膜癌85例臨床分析.中國婦產(chǎn)科臨床雜志,2008,9(1):16-17.
5 劉復(fù)生.多原發(fā)癌瘤172例臨床病理分析.中華腫瘤雜志,1979,1(2):113-119.
6 Tichansky DS,Cagir B,Borrazzo E,et al.Risk of second cancers in patients with colorectal carcinoids.Dis Colon Rectum,2002,45(1):91-97.
7 汪穎姝,王立峰,劉翠翠,等.常規(guī)MRI聯(lián)合DWI在軟組織未分化多形性肉瘤診斷中的價值.河南醫(yī)學(xué)研究,2015,24(10):11-13.
8 Fletcher CD.The evolving classification of soft tissue tumours: an update based on the new WHO classification.Histopathology,2006,48(1):3-12.
9 貢其星,范欽和.WHO軟組織腫瘤分類第四版(2013年)的學(xué)習(xí)體會.臨床與實(shí)驗(yàn)病理學(xué)雜志,2013,29(6):587-590.
10 Nakayama Y,Minagawa N,Torigoe T,et al.Malignant fibrous histiocytoma originating from the mesorectum:a case report.World J Surg Oncol,2011,9(1):15.
11 Patel DP,Gandhi YS,Sommers KE,et al.Primary pulmonary malignant fibrous histiocytoma.Case Rep Pulmonol,2015,3(8):1-5.
12 石 莉,周樹林,姜 旖,等.婦科惡性腫瘤相關(guān)的多發(fā)性原發(fā)性惡性腫瘤30例臨床分析.中華婦產(chǎn)科雜志,2014,49(3):199-203.
13 張 坤,郭紅燕,韓勁松.22例子宮內(nèi)膜癌復(fù)發(fā)病例的臨床特點(diǎn)分析.中國微創(chuàng)外科雜志,2017,17(6):495-497.
14 王海波,高麗彩,李秀娟,等.腹腔鏡與開腹手術(shù)治療肥胖婦女早期子宮內(nèi)膜癌的對比研究.中國微創(chuàng)外科雜志,2015,15(6):515-517.
15 李鵬飛.60例子宮肉瘤化療體會.中國傷殘醫(yī)學(xué),2015,23(14):76-77.
16 Yamagami W,Susumu N,Ninomiya T,et al.A retrospective study on combination therapy with ifosfamide,adriamycin and cisplatin for progressive or recurrent uterine sarcoma.Mol Clin Oncol,2014,2(4):591-595.
17 楊建光,李曉霞,孔凡民.多原發(fā)癌臨床特征分析.現(xiàn)代腫瘤醫(yī)學(xué),2011,19(12):2551-2553.

