加速康復外科護理在腹腔鏡胃癌根治術中的應用效果
劉紅霞 程康文 王貴和
胃癌是我國常見的惡性腫瘤,主要以手術治療為主。越來越多的研究[1-2]表明,腹腔鏡胃癌根治手術,安全、可行,可減少術中出血量、減輕術后疼痛、降低術后并發癥、加速術后康復、縮短住院時間等。隨著醫療模式和理念的轉變,醫療護理的目的不僅是常規護理,還要予以相應手段促進患者康復。基于加速康復外科(enhanced recovery after surgery,ERAS)理念的護理是通過術前、術中及術后一系列合理護理措施來減輕機體的應激反應,以利于術后康復。目前ERAS護理已廣泛應用于腹部外科各個領域,但ERAS護理在腹腔鏡胃癌根治術中的優越性少有報道。為此,本研究通過比較ERAS護理與常規護理對腹腔鏡胃癌根治術術中、術后相關指標的影響,探討ERAS護理在腹腔鏡胃癌根治術中的應用效果,具體報道如下。
1 資料與方法
1.1 一般資料 選擇2016年11月至2017年12月銅陵市人民醫院胃腸外科收治的擬行腹腔鏡輔助胃癌根治術治療的胃癌(經胃鏡確診)患者40例為觀察組,圍術期組給予ERAS方案進行護理;同時,以2015年12月至2017年12月我科收治的40例腹腔鏡輔助胃癌根治術常規護理患者為對照組。兩組患者的年齡、性別、體質指數(body mass index, BMI)、手術方式、吻合方式及術后TNM分期等一般資料比較,差異無統計學意義(P>0.05),詳見表1。本研究通過我院倫理委員會批準。
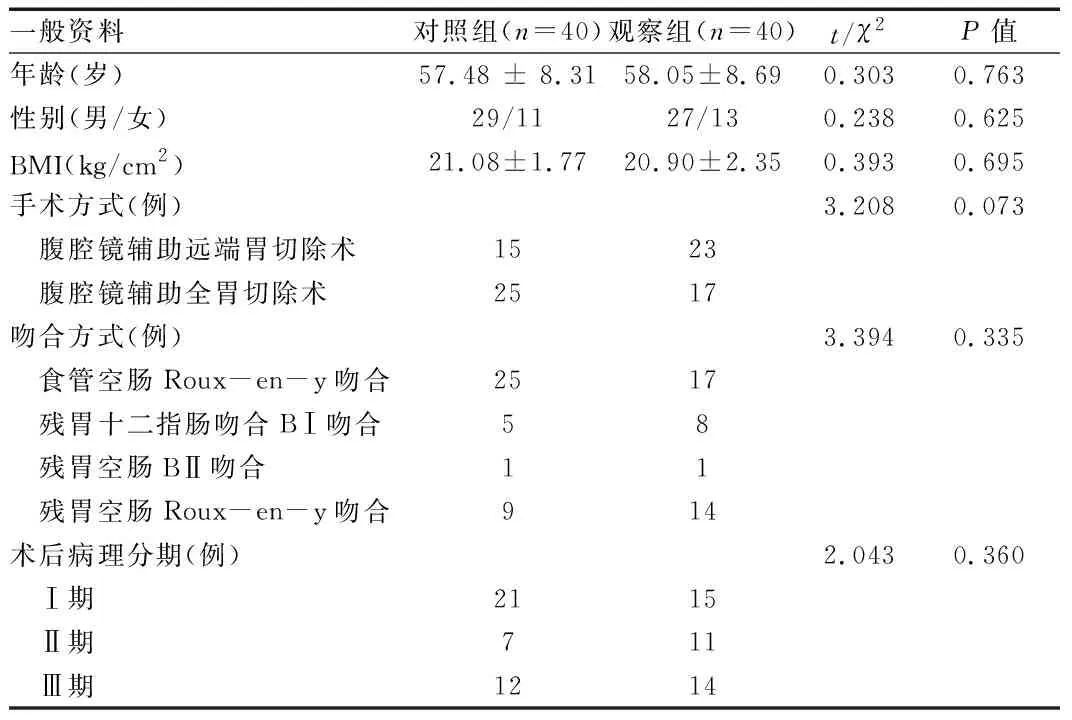
表1 兩組患者一般資料比較
1.2 納入與排除標準 納入標準:①患者知情同意;②年齡18~75歲;③美國麻醉醫師協會評分≤3分。排除標準:①全身狀況差,有腹腔鏡手術禁忌證;②術前行新輔助化療患者;③既往診斷胃癌的復發患者;④未行標準D2淋巴結清掃的患者;⑤腹腔鏡中轉開腹患者。
1.3 手術方式 參照日本第3版《胃癌處理規約》[3]及我國《腹腔鏡胃癌手術操作指南(2007版)》[4]行腹腔鏡輔助下D2根治術。病灶局限于胃竇行遠端胃切除,胃體或胃底可見病灶行全胃切除術。胃竇病灶切除后吻合方式首選Billroth I 式吻合,如果預計張力過大則行胃空Roux-en-Y式吻合;全胃切除后的吻合方式為胃空腸Roux-en-Y式吻合。
1.4 ERAS護理方案 ①術前高年資護士溝通交流,告知相關減少手術應激的措施;②入院后責任護士進行營養風險篩查量表2002進行評分,并常規給予口服腸內營養乳劑能全力(紐迪希亞,1 kcal /mL) 1 L/d,行飲食腸道控制及術前補充營養,對于存在營養風險且經口補充不能滿足機體60%熱卡需求,給予補充性腸外營養支持;③術前無需清潔灌腸及口服瀉藥,便秘患者予以口服乳果糖緩瀉劑,必要時加用復方聚乙二醇電解質散;④術前晚21:00口服術能(宜昌人福,57.66 kcal/100 mL,每瓶355 mL)2瓶,術前3小時口服術能1瓶;⑤術前不常規放置胃管,術中置入空腸營養管一根;⑥術中使用全身麻醉+胸段硬膜外麻醉(減少阿片類藥物的使用),縫皮前切口注射羅哌卡因浸潤(75 mg/20 mL),術后根據患者情況術后根據情況使用非甾體類抗炎藥氟比洛芬酯,并常規進行視覺模擬評分法(visual analogue scale, VAS)進行疼痛評分,>4分(Ⅱ級以上切口疼痛)追加阿片類止痛藥;⑦術中根據橈動脈監測的心臟每搏量實行目標導向液體治療,術后使用術中限制性補液;⑧術中給予患者保溫毯,控制輸液溫度、溫水腹腔沖洗;⑨術中常規放置肝下引流管1根,術后引流量<100 mL,復查CT明確腹腔內無異常及時拔除;⑩術后第1天早上拔除導尿管,如生命體征無異常,停止心電監護,由我科責任護士陪護患者下床活動,并記錄下床活動時間及距離;術后第1天開始啟動腸內營養百普力(紐迪希亞,0.75 kcal/mL) 20 mL/h小劑量泵控滴入,并給予飲水,之后逐漸增加腸內營養量,并更換為能全力鼻飼,期間同時啟動流質飲食,并逐漸減少靜脈補液量,直至停止靜脈補液。
1.5 常規護理方法 常規宣教,術前禁食12 h、禁飲6 h,并行機械灌腸或口服強效瀉藥,術后胃管留置4~5 d,術后下床活動采取自愿原則,術后肛門排氣、排便后開始逐漸試飲水、飲食。
1.6 觀察指標 記錄患者術中情況如:補液總量、手術時間、術中出血量;術后恢復情況如:術后通氣和排便時間、首次下床活動距手術結束時間、首次經口飲食時間、術后開始腸內營養時間、術后腸外營養使用時間、鼻腸管拔除時間、術后住院時間。出院后1周電話隨訪(隨訪間隔時間7天),并通過微信平臺延續隨訪至患者,及時發現術后30 d內相關并發癥,如Ⅱ級以上切口疼痛、咽喉疼痛、惡心、腹脹和或腹瀉、切口感染、肺部感染、吻合口瘺、腸梗阻發生例數。
2 結果
2.1 兩組患者術中及術后相關指標比較 與對照組相比,觀察組患者術中補液總量、術后通氣時間、術后排便時間、首次下床活動距手術結束時間、術后開始腸內時間、首次經口流質飲食時間、術后腸外營養使用時間、鼻腸管拔除時間、術后住院時間、住院總費用均短于對照組,差異有統計學意義(P<0. 05);觀察組術后Ⅱ級以上切口疼痛、咽喉疼痛發生率低于對照組,差異有統計學意義(P<0.05),詳見表2。
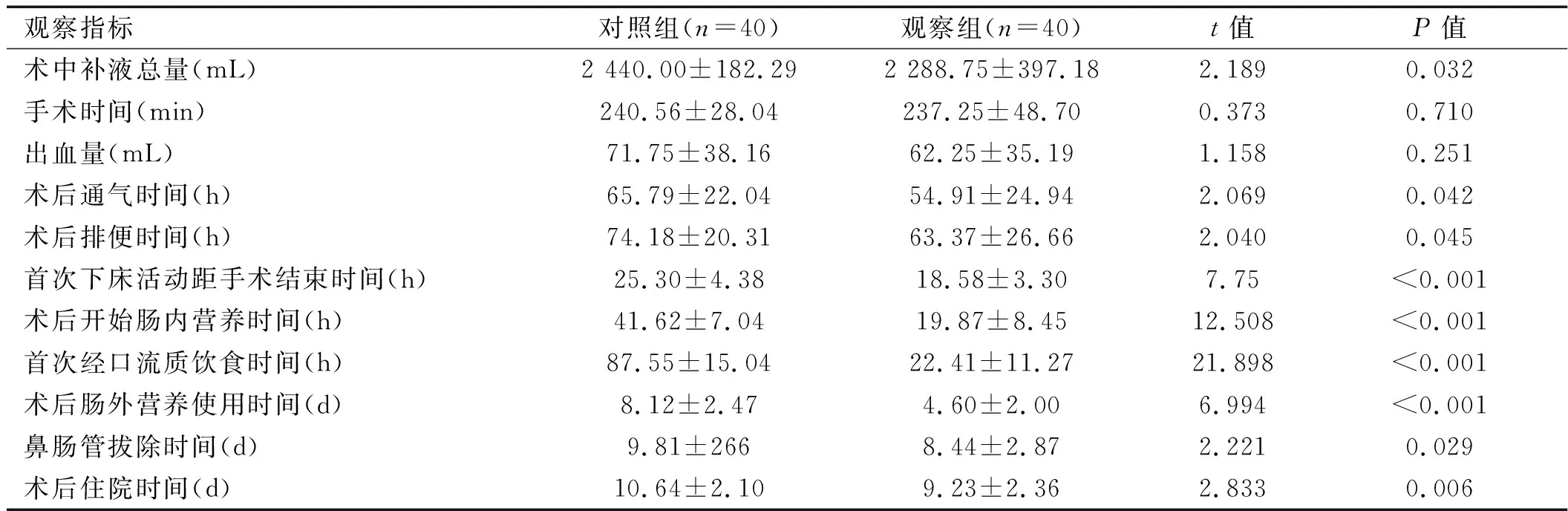
表2 兩組患者術中及術后相關指標比較
2.2 兩組患者并發癥比較 觀察組患者Ⅱ級以上切口疼痛及咽喉疼痛的發生率均少于對照組,差異有統計學意義(P<0.05);兩組患者發生嘔吐、腹脹和或腹瀉、切口感染、肺部感染、吻合口瘺、術后腸梗阻并發癥比較,差異無統計學意義(P>0. 05),詳見表3。出院后1周隨訪至術后30天,所有患者無需要干預處理的并發癥,術后30天無再入院患者。
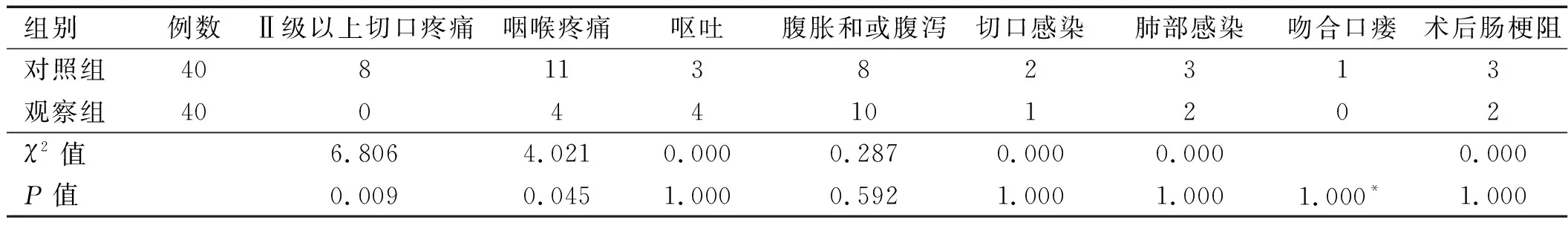
表3 兩組患者術后并發癥比較(例)
注:*表示Fisher確切概率法
3 討論
國內外多項研究已表明腹腔鏡手術在進展期胃癌中安全、有效[2,5-6],ERAS可減輕圍手術期應激反應,保護機體的免疫功能,減輕炎癥反應,維持機體內環境生理平衡機制,從而促進術后康復,減少術后并發癥[7]。但ERAS在腹腔鏡手術中的對比研究較少。因此,本文觀察ERAS聯合腹腔鏡胃癌根治術的治療效果為ERAS在腹腔鏡胃癌根治術應用的可行性及有效性提供依據。
ERAS的術前宣教可減輕患者術前焦慮,是ERAS順利開展的先決條件。多數ERAS指南不推薦機械性腸道準備,從而避免腸道水電解質的丟失及不適感[8],本組資料中部分患者因術前存在便秘,術前口服復方聚乙二醇電解質散,但是所有患者已摒棄經肛門灌腸及口服硫酸鎂或磷酸鈉鹽等瀉藥。相關研究[9]認為,術前口服碳水化合物,可減輕術后胰島素抵抗、避免術前長時間禁食導致口渴及饑餓,有利于術前機體肝臟內肝糖原合成,降低術前體內分解代謝狀況,本組所有患者術前均口服碳水化合物。同時采用術中保溫保護機體的凝血功能,以降低心血管并發癥及切口感染率[10]。術中限制性補液可以避免循環過負荷,過量補液導致術后胃腸道水腫,影響腸功能的恢復,本組資料中,觀察組術中平均補液量顯著少于對照組(P<0.05)。
鎮痛在ERAS中發揮重要作用,目前術后使用胸段硬膜外麻醉鎮痛,從而阻斷疼痛刺激引起交感神經興奮導致炎癥介質釋放增加[11],鎮痛中盡量減少阿片類藥物的使用,首選非甾體類抗炎藥,從而避免阿片類藥物對胃腸功能恢復的干擾,本組資料中觀察組所有患者術后VAS疼痛評分均<4分,未追加使用阿片類藥物,鎮痛控制良好,為術后早期下床活動奠定了基礎,同時也有利于術后早期腸功能的恢復。
本組患者術后第1天早上即拔除導尿管,以減少感染發生[12],避免導管限制術后早期活動。所有患者均未放置鼻胃管減壓,但術后所有患者常規放置較細的鼻腸管至上端空腸,便于術后早期管飼腸內營養,調節腸道微生態,營養腸粘膜細胞,避免術后腸源性感染的發生[13],從而可早期停止靜脈補液。觀察組患者逐漸恢復經口飲食后,盡早拔除鼻腸管,因長期放置鼻腸管會刺激咽喉部位導致疼痛,早期拔除可提高術后舒適度。本組資料中,觀察組啟動腸內營養時間早,經口流質飲食時間亦早于對照組,縮短腸外營養使用時間,從而可減少術后輸液導致活動不便、避免腸外營養相關并發癥,最終促進患者術后康復。
術后早期下床活動是ERAS中的關鍵因素[14],因早期活動可以促進胃腸功能的恢復、降低術后肺部并發癥、減輕胰島素抵抗、避免術后出現肌肉萎縮、有利于機體的血液循環而降低血栓的發生,此外,研究還表明術后早期活動可減輕術后精神錯亂和認知功能障礙[15]。相比對照組,觀察組患者術后首次下床活動時間距離手術結束時間較早(P<0.05),且無跌倒現象出現,表明術后早期下床活動安全、可行。
本組資料中,兩組患者術后嘔吐、腹脹和/或腹瀉、切口感染、肺部感染、吻合口瘺、術后腸梗阻的發生率差異無統計學意義,表明ERAS方案在本組資料中是安全有效的,至少不會增加術后并發癥發生率,我們前期的對照研究也證實ERAS可縮短住院時間,且不增加術后并發癥[16]。
總之,本研究表明ERAS在腹腔鏡胃癌根治術中,安全、有效,可促進術后康復。但因本次樣本量有限,本結果有待開展大樣本、多中心、前瞻性、隨機對照研究去證實。
[1] 程康文,王貴和,束寬山,等.腹腔鏡輔助與開腹胃癌根治術臨床效果及對腸道屏障功能影響的比較[J].中國普通外科雜志,2017,26(4):450-456.
[2] STRAATMAN J, VAN DER Wielen N, Cuesta MA et al: Minimally invasive versus open total gastrectomy for gastric cancer: a systematic review and meta-analysis of short-term outcomes and completeness of resection: surgical techniques in gastric cancer[J]. World J Surg, 2016,40(1): 148-157
[3] Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver. 3)[J]. Gastric Cancer. 2011,14:113-123.
[4] 中華醫學會外科學分會腹腔鏡與內鏡外科學組. 腹腔鏡胃癌手術操作指南(2007版)[J]. 中華消化外科雜志, 2007, 6(6):476-480.
[5] 仝德峰, 劉江文, 孫琳, 等. 進展期胃癌腹腔鏡輔助D2根治術的臨床療效分析[J]. 中國普通外科雜志, 2015, 24(8):1201-1204.
[6] KIM W, KIM HH, HAN SU et al: Decreased morbidity of laparoscopic distal gastrectomy compared with open distal gastrectomy for stage I gastric can-cer: Short-term outcomes from a multicenter randomized controlled trial (KLASS-01)[J]. Ann Surg, 2016,263(1): 28-35
[7] 程康文,王貴和.加速康復外科對腹腔鏡胃癌根治術患者炎癥因子與免疫功能的影響[J]. 腹腔鏡外科雜志,2017,22(1):30-35.
[8] MORTENSEN K, NILSSON M, SLIM K et al. Consensus guidelines for enhanced re-covery after gastrectomy: Enhanced Recovery After Surgery (ERAS?) Society recommendations[J]. Br J Surg, 2014, 101(10): 1209-29.
[9] SVANFELDT M,THORELLl A,HAUSEL J,et al.Randomized clinical trial of the effect of preoperative oral carbohydrate treatment on postoperative whole-body protein and glucose kinetics[J]. Br J Surg, 2007, 94(11) :1342-1350.
[10]SESSLER DI. Complications and treatment of mild hypothermia[J]. Anesthesiology, 2001, 95( 2) : 531-543.
[11]王貴和, 程康文. 加速康復外科對術后近期營養指標的影響[J]. 腹部外科雜志, 2017,22(4):30-35.
[12]楊萬玲,黃家麗.快速康復外科護理臨床應用現狀及啟示[J]. 安徽醫學雜志, 2013,34(10):1581-1583.
[13]黎介壽. 營養支持治療與加速康復外科[J]. 腸外與腸內養, 2015,2(2):65-67.
[14]SLIM K, JORIS J. The egg-and-chicken situation in postoperative enhanced recovery progra-mmes[J]. Br J Anaesth, 2017,118(1):5-6.
[15]KURBEGOVIC S, ANDERSEN J, KRENK L, et al. Delirium in fast-track colonic surgery[J]. Langenbecks Arch Surg, 2015,400:513-516.
[16]程康文, 王貴和, 束寬山, 等. 腹腔鏡胃癌根治術中應用快速康復外科理念的研究[J].腹腔鏡外科雜志, 2016,21(4) :292-296.

