補加可同化氮對冰酒發酵的影響
張雪,郭在力,俞志敏,張平,孫玉梅*
1(大連工業大學 生物工程學院,遼寧 大連,116034)2(遼寧太陽谷莊園葡萄酒業股份有限公司,遼寧 遼陽,111000)
葡萄中含有糖、有機酸、氨基酸、酚類、無機鹽和維生素等多種營養物質,在葡萄酒發酵過程中,酵母菌利用這些營養物質生長、繁殖并代謝,生成具有一定風味特性的葡萄酒[1]。葡萄眾多成分中,氮元素作用極其重要,直接影響酵母的細胞合成和多種物質代謝[2-3]。通常情況下,葡萄汁中的可同化氮含量在60~500 mg N/L之間,一般認為,完成正常酒精發酵的可同化氮含量不能低于140 mg N/L[4-5]。在葡萄酒發酵過程中,如果可同化氮質量濃度不足(小于140 mg N/L),會出現發酵停滯或終止,以及生成H2S等現象;如果可同化氮含量過高(大于450 mg N/L),則產生一些對葡萄酒風味不利的香氣[6]。當可同化氮含量低于140 mg N/L時需要適量補加可同化氮以保證酒精發酵的正常進行。
目前,關于補加氮對葡萄酒發酵影響的研究較多[7-8],但尚未見補加氮對冰酒發酵影響的研究報道。冰酒發酵的糖濃度較高,研究補加可同化氮對冰酒發酵的影響意義重大。本研究以威代爾葡萄汁為原料,通過補加氮源提高可同化氮含量,測定發酵過程中的理化指標,研究補加可同化氮對冰酒發酵的影響,從而為冰酒生產中補加可同化氮提供參考。
1 材料與方法
1.1 材料與試劑
冰葡萄汁:威代爾(Vidal)冰葡萄汁。釀酒酵母:釀酒酵母(活性干酵母)ST。添加劑:氮源(Thiazote?)、果膠酶、偏重亞硫酸鉀、山梨酸鉀,遼寧五女山米蘭酒業有限公司。
1.2 儀器與設備
1.3 活性干酵母梯度馴化
ST酵母經梯度馴化之后制成種子液,然后接種到冰葡萄汁中進行發酵。馴化方法如下:將1 g ST酵母溶于10 mL無菌水,38 ℃恒溫水浴培養15 min,每隔5 min輕微攪動1次,培養完成后得到一級活化液;取10 mL稀釋到20 °Brix左右的冰葡萄汁,加入到一級活化液中,25 ℃恒溫放置1 h,每隔30 min攪動1次,培養完成后得到二級活化液;取20 mL 40 °Brix左右的原始冰葡萄汁,加入到二級活化液中, 20 ℃恒溫水浴培養2 h,每30 min攪動1次。得到40 mL ST酵母種子液。
1.4 冰葡萄酒釀造工藝流程
在裝有750 mL冰葡萄汁的1 L葡萄酒瓶中,分別加入120 mg/L偏重亞硫酸鉀和30 mg/L果膠酶,均接種15 mL ST酵母種子液,每組2個平行。酒瓶用棉塞封口,于18~20 ℃發酵48 h后,用發酵栓取代棉塞。當還原糖含量基本保持不變時,加入320 mg/L偏重亞硫酸鉀和200 mg/L的山梨酸終止發酵。
1.5 測定方法
1.5.1 活酵母菌濃度測定
血球計數法[9]。
1.5.2 還原糖含量測定
DNS法[10]。
1.5.3 可同化氮含量測定
甲醛值法[10]。
教師在物理教學中要采取多樣化的教學方法培養學生的創造性思維,而牢固的基礎知識使學生進行創新的基礎,只有讓學生深刻的理解了物理基礎知識,掌握基礎技能,才能為學生思考問題、解決問題打下良好的基礎。其次,教師在物理教學過程中要積極培養學生的綜合能力,鼓勵學生從不同的角度思考問題,擺脫應試教育給學生帶來的束縛,通過對學生發散思維的培養,讓學生的創新能力得到提升。
1.5.4 甘油含量測定
高碘酸氧化滴定碘法[11]。
1.5.5 揮發性組分含量測定
采用外標法,測出待測組分標準品的峰面積,并與對應的濃度繪制標準曲線。樣品測定時,測出的各組分峰面積對應標準曲線,得到相應的樣品組分濃度。
樣品中的揮發性組分包括乙醇、乙酸、高級醇和酯類,采用頂空-氣相色譜法(HS-GC)進行測定[12]。
(1)處理條件:向15 mL樣品瓶中加入1.4 g NaCl、轉子和7 mL發酵液,用PTFE墊密封,并置于磁力攪拌器上,在350 r/min條件下攪拌10 min。
(2)色譜條件:頂空進樣條件:安捷倫7697A頂空進樣器;平衡溫度 90 ℃,定量環溫度 100 ℃,傳輸管路溫度110 ℃,平衡時間 30 min,采樣時間0.5 min。
氣相色譜條件:安捷倫 GC6850氣相色譜儀,安捷倫DB-FFAP毛細管色譜柱(30 m×0.25 mm×0.25 μm);汽化室溫度 250 ℃,FID 檢測器溫度250 ℃,進樣量2 μL。色譜柱初溫40 ℃,穩定10 min,以5 ℃/min升至180 ℃,穩定 1 min,以20 ℃/min升至230 ℃,穩定2 min;空氣流量300 mL/min,氫氣流量 30 mL/min,載氣(氮氣)流量10 mL/min,分流比10∶1。
2 結果
2.1 補加可同化氮對活酵母菌數量的影響
圖1顯示在發酵的前2天,補加和不補加氮源組的活酵母菌數量都逐漸減少。可能是因為冰葡萄汁中的糖含量較高,且冰酒發酵是在低溫下進行,酵母菌對于這樣的環境不能立即適應,需要短暫的適應階段,所以發酵的前兩天活酵母菌數量減少。之后酵母菌逐漸適應環境并迅速的生長繁殖,并在發酵第5天達到最大生長。發酵16 d后,與不補加氮源組相比,補加氮源組的酵母菌活細胞數量下降較快,可能是產生了較多有害代謝物所致,WANG等[13]也得到了相同的結論。
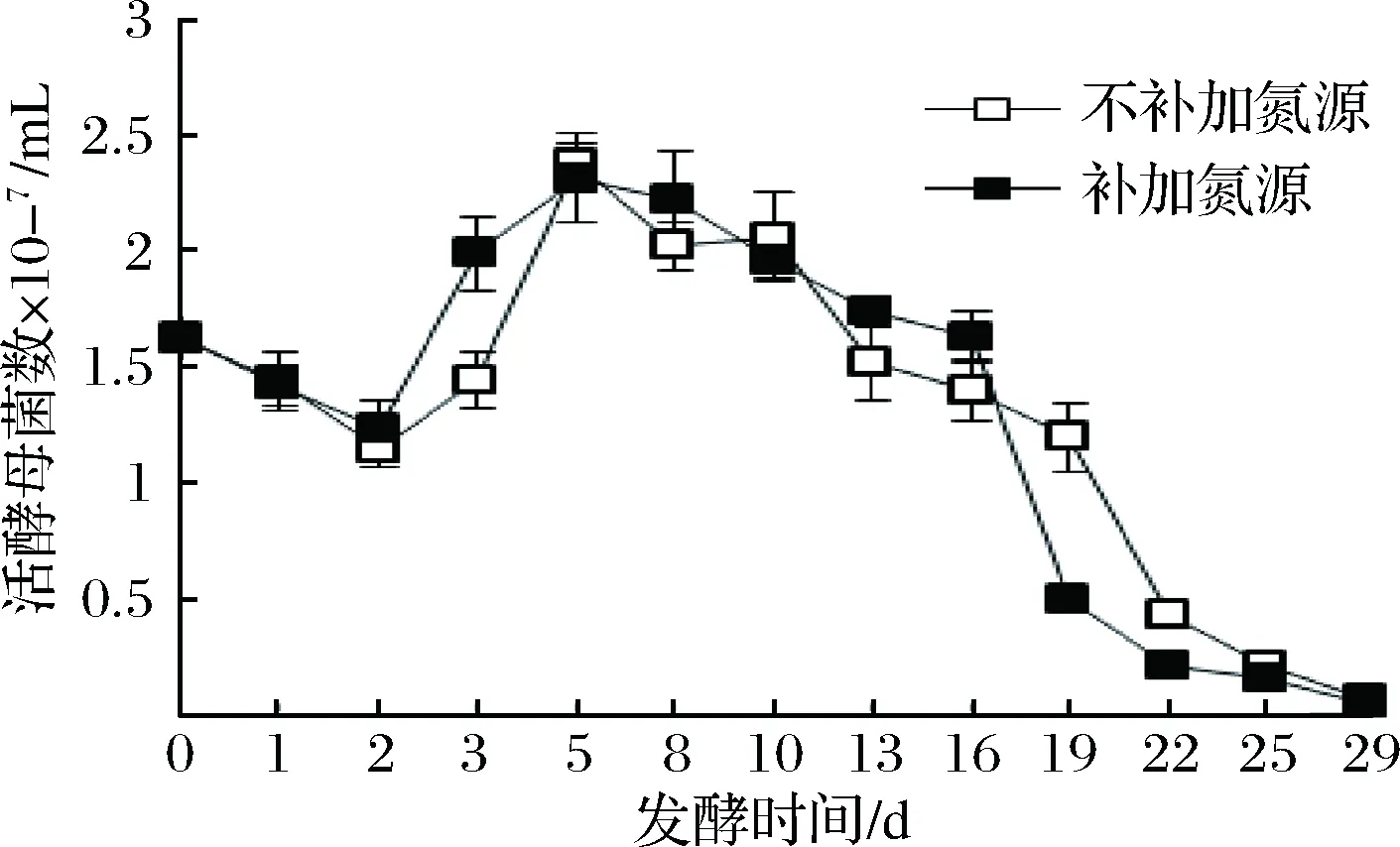
圖1 冰酒發酵過程中活酵母菌數變化Fig.1 The change of viable yeast cell concentrations during icewine fermentation
2.2 補加可同化氮對還原糖利用的影響
圖2顯示發酵的前2 d,補加和不補加氮源組的還原糖含量變化較小,可推測期間酵母菌都處于適應期。隨著酵母菌對環境的適應程度不斷提高,開始大量的生長繁殖,大量的還原糖被酵母菌利用,補加氮源組比不補加氮源組耗糖更快更多,前者在發酵17 d后還原糖含量基本不變,后者在發酵第19天之后基本不變。可見,補加氮源促進了發酵的進行,縮短了發酵時間。發酵結束時,2組殘糖含量均大于125 g/L,符合冰酒的標準。
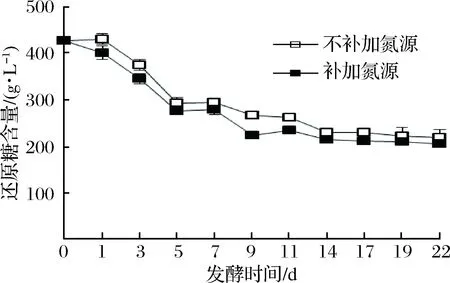
圖2 冰酒發酵過程中還原糖含量變化Fig.2 The change of reducing sugar contents during icewine fermentation
2.3 補加可同化氮對可同化氮利用的影響
圖3顯示補加和不補加氮源組的可同化氮利用趨勢大致相同。發酵前5 d,可同化氮含量大幅度下降至最低點;隨后可同化氮含量趨于穩定;發酵20 d后,可同化氮含量上升。這是由于前期酵母吸收大量含氮物質,同時伴隨著乙醇的生成,乙醇濃度較高時,會對細胞產生毒害作用,細胞通過關閉輸送氮源的通道來防止乙醇的毒害作用[14],因此,發酵中期可同化氮含量趨于穩定。發酵后期,一方面是因為酵母釋放了細胞內的部分氨基酸以維持胞內的氧化還原平衡;另一方面,由于酵母菌自溶,胞內的氨基酸被釋放出來,致使可同化氮含量上升,這與CHILDS等人[15]的研究結果一致。
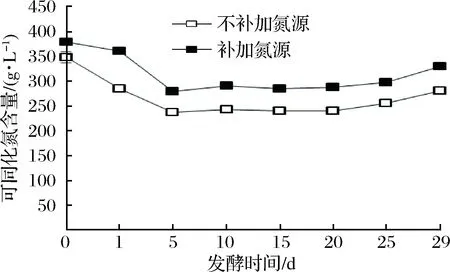
圖3 冰酒發酵過程中可同化氮含量變化Fig.3 Assimilable nitrogen contents during icewine fermentation
2.4 補加可同化氮對乙醇生成量的影響
圖4顯示,與不補加氮源組相比,補加氮源組生成乙醇更快。發酵20 d后,補加氮源組的乙醇含量基本保持不變,而不補加氮源組乙醇含量仍在增加,此時,補加氮源組乙醇含量為108.3 g/L,不補加氮源組乙醇含量為97.0 g/L。可見,氮源的補充促進了乙醇的生成,有利于縮短冰酒的發酵時間,更快達到要求的酒精度。
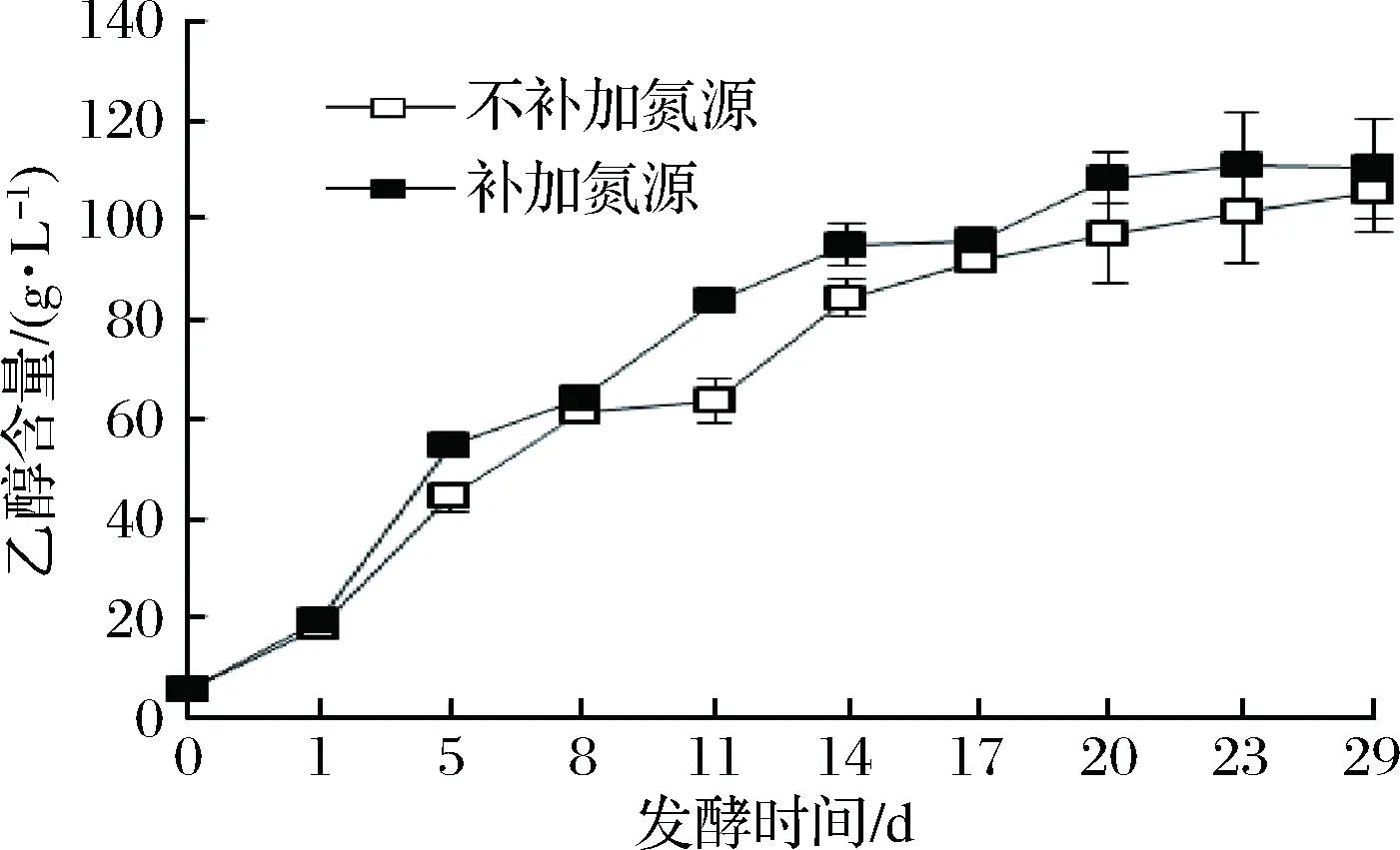
圖4 冰酒發酵過程中乙醇產量變化Fig.4 The change of ethyl alcohol contents during icewine fermentation
2.5 補加可同化氮對甘油產量的影響
酵母菌在高糖環境中,生成了過量的NADH,對于厭氧發酵,通過生成甘油平衡氧化還原電位[6]。圖5顯示甘油的生成集中在發酵的前期和中期,補加氮源組的甘油生成較快,發酵14 d后甘油含量基本不變,而不補加氮源組甘油含量在發酵17 d后基本不變。由圖5也可見,補充氮源不影響冰酒發酵的甘油最終產量,這與BELY等[16]得出的結論一致。

圖5 冰酒發酵過程中甘油產量變化Fig.5 The change of glycerol contents during icewine fermentation
2.6 補加可同化氮對乙酸產量的影響
圖6顯示從發酵開始到結束,補加氮源組始終比不補加氮源組的乙酸產量高。乙酸產量受糖消耗速率的影響,補加氮源加快了糖的消耗,從而加快了乙酸的生成。研究表明,當可同化氮濃度較低時,補加氮源可以減少乙酸產量;當可同化氮濃度較高時,補加氮源會增加乙酸產量[17-18]。由于本研究的不補加氮源組可同化氮基礎濃度較高,所以補加氮源會提高乙酸的產量。

圖6 冰酒發酵過程中乙酸產量變化Fig.6 The change of acetic acid contents during icewine fermentation
2.7 補加可同化氮對風味物質產量的影響
圖7顯示高級醇的生成主要集中在發酵的前期和中期,正丙醇、異戊醇和異丁醇含量在發酵14 d達到最大值后基本不變;但是,2-苯乙醇含量在發酵前5天逐漸增加至最高,之后開始下降,可能是由于2-苯乙醇是某些產物的合成的前體物質,但尚未見到相關報道。在本實驗中,補加氮源組的正丙醇、異丁醇和2-苯乙醇含量比不補加氮源組低,TORREA、VILANOVA等[19-20]也得出了相同的結論。異戊醇是由α-酮戊二酸合成的,補加氮源使糖的消耗量增加,α-酮戊二酸作為糖代謝的中間產物,其生成量會因糖代謝的加強而增加,最終導致異戊醇含量增加,這與秦偉帥等[21]的研究結果一致。不補加氮源組的最終高級醇總量,低于補加氮源組。研究表明,高級醇的總量小于等于300 mg/L時,高級醇的含量越高,葡萄酒的風味越復雜。2組高級醇總量均低于300 mg/L,因此補加可同化氮對葡萄酒的風味復雜性有益。

圖7 冰酒發酵過程中高級醇產量變化Fig.7 The change of higher alcohol contents during icewine fermentation
圖8顯示補加可同化氮提高了除琥珀酸二乙酯以外的其他酯類的產量,這可能與乙酸或乙醇的產量增加有關。補加可同化氮降低了琥珀酸二乙酯產量,可能是由于作為琥珀酸二乙酯前體物質的琥珀酸,其生成量會受到糖代謝和糖代謝途徑中琥珀酸之前的代謝產物消耗的影響,糖代謝途徑中琥珀酸之前的代謝產物消耗較大,琥珀酸生成量就會減少,琥珀酸二乙酯的生成量也就隨之降低[20]。補加氮源組的總酯含量比不補加氮源組高,葡萄酒的香氣更強。
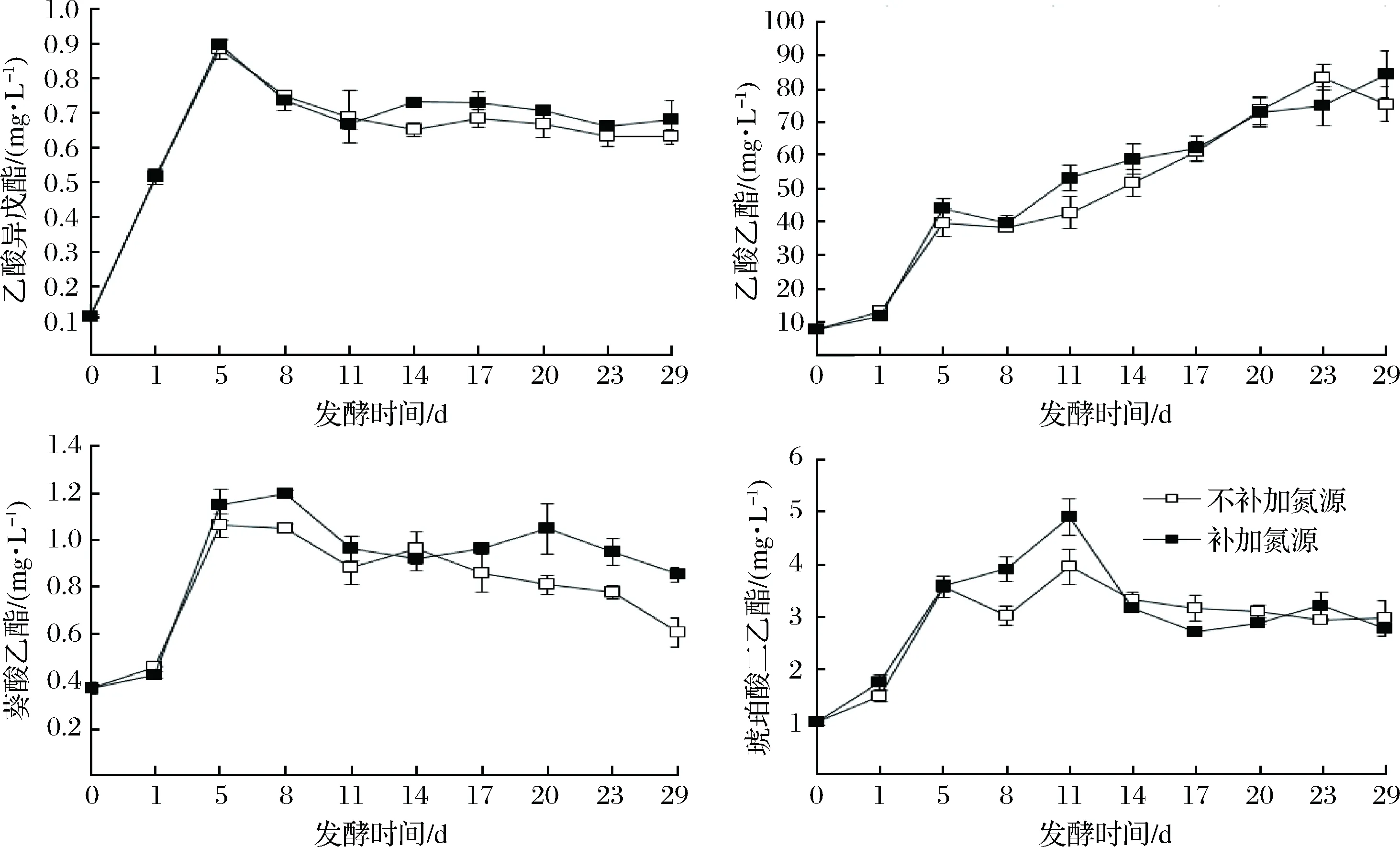
圖8 冰酒發酵過程中酯類產量變化Fig.8 The change of esters content during icewine fermentation
3 結論
初始糖質量濃度426.96 g/L、可同化氮質量濃度347.49 mg N/L的威代爾冰葡萄汁,補加0.25 g/L的可同化氮能加快糖消耗,且消耗量提高3.23%,可同化氮的消耗量降低10.03%,乙酸、乙醇、高級醇和酯類物質產量顯著提高,分別提高5.44%、4.65%、9.89%和11.38%,對甘油生成無影響。因此,適量補加可同化氮會影響發酵過程的參數變化,可以顯著提高冰酒品質。適宜的可同化氮含量本課題沒有研究,有待進一步實驗研究。
[1] ELENA J M,AGUSTIN A,ALEXANDRA M F, et al.The nature of the nitrogen source added to nitrogen depleted vinifications conducted by aSaccharomycescerevisiae strain in synthetic must affects gene expression and the levels of several volatile compounds[J].Antonie van Leeuwenhoek, 2007,92(1):61-75.
[2] 余昆,梁百吉,李勇,等.葡萄酒釀造過程中氮源的控制與管理[J].中外葡萄與葡萄酒,2013,18(1):48-52.
[3] 張方方,許引虎.葡萄酒發酵中酵母對營養需求的研究進展[J/OL].釀酒科技(2017-11-26).http://kns.cnki.Net/kcms/detail/ 52.1051.TS.20161221.1250.002.html.DOI.10.13746/j.njkj.2016364.
[4] STURGEONA J Q, BOHLSCHEIDB J C, EDWARDS C G.The effect of nitrogen source on yeast metabolism and H2S formation[J].Journal of Wine Research, 2013, 24(3): 182-194.
[5] 姜越,潘婷,惠竹梅.模擬汁中可同化氮和還原糖對酵母發酵特性的影響[J].食品科學,2018,39(2):131-137.
[6] 周光榮,楊雪峰,段雪榮,等.葡萄酒發酵過程中氮源的控制與管理[J].科技創新與應用,2014(24):287.
[7] 繆成鵬,張暉,楊曉雁,等.可同化氮含量對赤霞珠葡萄酒發酵和香氣成分的影響[J].中國釀造,2015,34(1):131-136.
[8] 張瑾,王國棟,惠竹梅,等.模擬葡萄汁中添加可同化氮對酵母酒精發酵的影響[J].西北農林科技大學學報(自然科學版),2010,38(3):160-166.
[9] 沈萍,陳向東.微生物學實驗[M].北京:高等教育出版社,2007:20-22.
[10] 中華人民共和國國家質量監督檢驗檢疫總局.飲料通用分析方法:GB/T 12143—2008[S].北京:中國標準出版社,2008.
[11] 彭晉平,楊繼紅,彭新立,等.高碘酸氧化滴定碘法測定甘油含量的研究[J].精細石油化工,2001(4):67-68.
[12] 雷安亮,鐘其頂,高紅波,等.靜態頂空氣相色譜法測定葡萄酒中主要香氣成分研究[J].中國釀造,2009,28(5):147-151.
[13] WANG X D, BOHLSCHEID J C, EDWARDS C G.Fermentative activity and production of volatile compounds by Saccharomyces grown in synthetic grape juice media deficient in assimilable nitrogen and/or pantothenic acid[J].Journal of Applied Microbiology, 2003, 94(3): 349-359.
[14] BOULTON R B, SINGLETON V L, BISSON L F,et al.葡萄酒釀造學——原理及應用[M].趙光鰲, 尹卓容, 張繼民,等, 譯.北京:中國輕工出版社, 2001.
[15] CHILDS B C, BOHLSCHEID J C, EDWARDS C G.Impact of available nitrogen and sugar concentration in musts on alcoholic fermentation and subsequent wine spoilage byBrettanomycesbruxellensis[J].Food Microbiology, 2015,46: 604-609.
[16] BELY M, RINALDI A, DUBOURDIEU D.Influence of assimilable nitrogen on volatile acidity production bySaccharomycescerevisiaeduring high sugar fermentation[J].Journal of Bioscience and Bioengineering, 2003, 96(6): 81-85.
[17] VILANOVA M, UGLIANO M, VARELA C, et al.Assimilable nitrogen utilisation and production of volatile and non-volatile compounds in chemically defined medium bySaccharomycescerevisiaewine yeasts[J].Applied Microbiology Biotechnology, 2007, 77(1): 145-157.
[18] BARBOSA C, VIRGILIO F, MENDES-FAIA A, et al.Nitrogen addition influences formation of aroma compounds, volatile acidity and ethanol in nitrogen deficient media fermented bySaccharomycescerevisiaewinestrains[J].Journal of Bioscience and Bioengineering, 2009, 108(2): 99-104.
[19] DIEGO T, VARELA C, UGLIANO M, et al.Comparison of inorganic and organic nitrogen supplementation of grape juice-effect on volatile composition and aroma profile of a Chardonnay wine fermented withSaccharomycescerevisiaeyeast[J].Food Chemistry, 2011, 127(3): 1 072-1 083.
[20] VILANOVA M, SIEBERT T E, VARELA C, et al.Effect of ammonium nitrogen supplementation of grape juice on wine volatiles and non-volatiles composition of the aromatic grape variety Albario[J].Food Chemistry, 2012, 133(1): 124-131.
[21] 秦偉帥,董書甲,姜凱凱,等.不同氮源濃度對酵母香氣物質合成的影響[J].食品與發酵工業,2017,43(3):61-65.

