二氫丹參酮Ⅰ聯合氨芐西林對生物膜陽性MRSE耐藥基因表達的影響
易玉玲,雍江堰,祖瑞鈴,李燕
臨床難治的耐甲氧西林表皮葡萄球菌(methicillin resistant S.epidermidis,MRSE)主要耐藥機制與mecA基因編碼產生的新青霉素結合蛋白2a(penicillin binding protein 2a,PBP2a)有關,且具有生物膜形成能力的MRSE可能會因為生物膜內營養供給、氧濃度、滲透壓等內環境的改變,導致其耐藥基因被激活或發生基因水平的轉移,造成耐藥增強而增加臨床治療難度[1~2]。因此,研究可以抑制生物膜陽性MRSE的藥物或方法十分必要。
已有研究表明中藥及其活性單體成分與抗生素聯用后對細菌生物膜的抑制作用增強,并且可能會逆轉MRS的耐藥性[3]。活血化瘀藥物丹參,其有效成分丹參酮類化合物具有抗菌、抗炎作用,但目前研究其抑制生物膜的臨床研究和應用較少。在本課題組前期實驗中,我們發現二氫丹參酮與氨芐西林聯用能協同抑制MRSE浮游菌與生物膜細菌,故本研究以MRSE耐藥基因為靶點,研究藥物對生物膜陽性的MRSE mecA、PBP2a表達的影響,初步探討丹參活性單體與抗生素聯用對MRSE耐藥逆轉的可能性,為防治生物膜陽性MRSE感染尋找新的思路。
1 材料與方法
1.1 材料
1.1.1 實驗菌株 SE生物膜陽性參考菌株SE1457(復旦大學瞿滌教授惠贈),生物膜陽性臨床菌株SE15569、SE21021、SE21306、SE26508和SE30291[4~5]:經鑒定均對苯唑西林耐藥,即苯唑西林對每株菌的 MIC≥ 4 μg·mL-1,判斷為MRSE。
1.1.2 主要試劑、藥物及儀器 二氫丹參酮Ⅰ對照品(成都普菲德生物技術有限公司);氨芐西林標準品(中國食品藥品檢定研究院)。MHB、TSB培養基(青島海博生物科技有限公司);細胞增殖及細胞毒性測試試劑盒XTT(南京凱基生物科技發展有限公司);Trizol Reagent(Invitrogen);M-MLV First Strand cDNA Synthesis Kit(Omega);TransStart Green qPCR SuperMIX(北京全式金公司)。PCR儀(BIO-RAD);酶標儀(上海科華實驗系統有限公司);微量核酸蛋白分析儀(THERMO);熒光定量PCR儀(德國耶拿公司)。
1.2 方法
1.2.1 MRSE臨床菌株中mecA陽性株的篩選
1.2.1.1 引物設計 NCBI查詢SE mecA基因的序列并設計引物,由上海生工合成,引物擴增序列和產物片段大小見表1。

表1 mecA基因特異性引物序列
1.2.1.2 MecA基因的擴增 將5株MRSE臨床菌株于血平板上復蘇,挑取SE菌落于LB培養基中,37℃振蕩培養過夜。吸取菌液于無菌EP管中,離心后棄上清,加入適量TE溶液,強烈振蕩洗滌菌體,離心后收集菌體。加入TE溶液懸浮菌體,加入溶菌酶至終濃度2 μg·mL-1,充分混勻,37℃孵育后,加入10%SDS溶液于37℃裂解,然后加入蛋白酶K于70℃消化,100℃煮沸后離心,收集上清液即為DNA模板。
PCR反應按照博邁德2×Taq PCR MasterMix說明書進行操作。 PCR反應條件設置:94℃預變性3 min,94℃變性30s,52℃退火30 min,72℃延伸30 s,共30個循環,72℃繼續反應5 min。PCR產物經2%瓊脂糖凝膠電泳鑒定。
1.2.2 qRT-PCR檢測藥物對生物膜陽性MRSE mecA基因表達的影響
1.2.2.1 生物膜的建立 先用TSB培養基復蘇-20℃保存的菌株搖床震蕩1h,血平板37℃、24h傳代2次后,再配制成濃度為1×106CFU·mL-1的菌懸液,在無菌6孔板內培養24 h SE生物膜。每孔加入3mL液處理,分為2 μg·mL-1二氫丹參酮Ⅰ+ 2 μg·mL-1氨芐西林聯用組、2 μg·mL-1氫丹參酮Ⅰ組、2 μg·mL-1氨芐西林組,另設置64 μg·mL-1萬古霉素作為陽性藥物干預組、不加藥的對照組,37℃培養24 h。
1.2.2.2 qRT-PCR檢測mecAmRNA 參照Trizol Reagent說明書采用Trizol法提取SE生物膜RNA,然后取RNA樣品液1μL,利用Thermo微量核酸蛋白分析儀測定其濃度。按照Omega的逆轉錄試劑盒將RNA逆轉錄為cDNA,-70℃保存。按照TransStart Green qPCR SuperMIX試劑盒檢測生物膜形成相關基因的表達,熒光定量PCR反應條件設置:第一步94℃預變性30s,第二步94℃變性5s,第三步52℃退火15s,第四步72℃延伸10s,40個循環,并于每個循環的延伸階段收集熒光信號;60-95℃做溶解曲線,以16SrRNA為內參基因,采用2-ΔΔct法計算各目的基因的相對定量。
1.2.3 ELISA檢測藥物對MRSE的PBP2a表達的影響 參照1.2.2.1方法,在6孔板中加入無菌玻片建立生物膜。培養結束后用液氮碾磨玻片并收集粉末,按照通用蛋白裂解液說明書進行蛋白質提取,取適量裂解液稀釋PSMF為1mM。加入EP管中、混勻,置于冰上裂解后,離心取上清液。按照BCA蛋白定量試劑盒說明書進行蛋白質濃度測定,配置BCA工作液,制作蛋白質標準曲線,將蛋白加入樣品孔中,每孔加入BCA工作液,37℃避光孵育,酶標儀測定A570,并根據標準品的吸光度和濃度繪制標準曲線。按照 ELISA試劑盒說明書檢測PBP2a蛋白的表達,根據蛋白質濃度結果將每組蛋白模板稀釋至相同濃度,設置標準品孔、樣本孔和空白孔。除空白孔外每孔加入HRP標記的檢測抗體,用封板膜封住反應孔,37℃孵育,洗滌5次,每孔加入底物A、B,37℃避光孵育后加反應終止液50μL,酶標儀檢測A450,并根據標準品的吸光度和濃度繪制標準曲線。
1.3 統計學分析
各實驗組之間的差異性比較,通過SPSS21.0統計學軟件進行單因素方差分析(o n e-w a y ANOVA),每個藥物組設置8個復孔,整個實驗重復3次,實驗結果以均數±標準差表示,以P<0.05為具有統計學差異。
2 結果
2.1 mecA基因陽性菌株的篩選結果
根據電泳結果,5株臨床MRSE中mecA基因陽性的菌株為SE21021、SE26508和SE30291,擴增mecA基因的電泳圖如圖1所示。
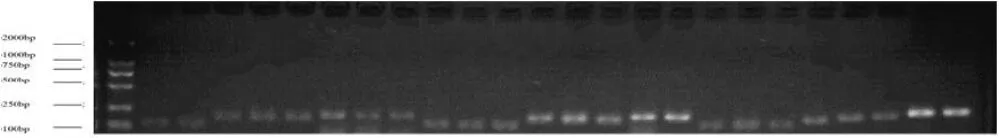
圖 1 SE26508、 SE21021 、SE30291 mecA基因擴增電泳圖
2.2 二氫丹參酮Ⅰ與氨芐西林聯用對生物膜陽性MRSE的mecA基因表達的影響
藥物干預MRSE中mecA基因的表達情況見圖2
對于SE21021,與二氫丹參酮Ⅰ單用和萬古霉素組相比,2 μg·mL-1二氫丹參酮Ⅰ與2 μg·mL-1氨芐西林聯用能明顯降低mecA的表達且有統計學意義(P<0.05);與氨芐西林單用組相比,聯用組也能降低mecA的表達,但無統計學意義(P>0.05)。對于SE26508,各組藥物均促進mecA基因的表達(P<0.05),但是聯用組mecA基因的表達低于氨芐西林單用組、二氫丹參酮Ⅰ單用組和萬古霉素組,其差異均有統計學意義(P<0.05)。對于SE30291,聯用組、氨芐西林單用組和二氫丹參酮Ⅰ單用組均降低了mecA表達,但差異無統計學意義(P>0.05),萬古霉素則促進了mecA基因的表達(P<0.05),因而聯用組比萬古霉素的抑制作用好且有統計學意義(P<0.05)。
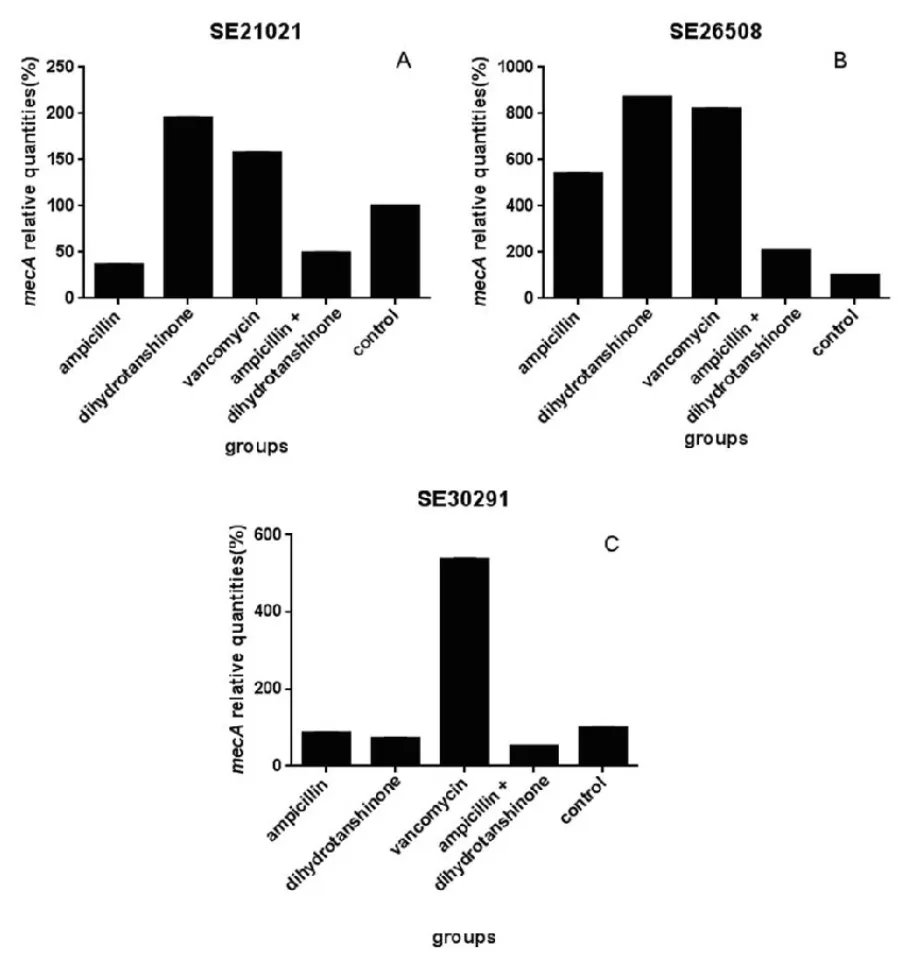
圖2 藥物干預后臨床菌株生物膜中mecA基因相對表達情況
2.3 二氫丹參酮Ⅰ與氨芐西林聯用對生物膜陽性MRSE的PBP2a蛋白表達的影響
ELISA測定PBP2a蛋白含量的標準曲線如圖3所示,x軸代表標準品濃度(ng·μL-1),y軸代表吸光度,得到濃度與吸光度之間的線性關系為y = 0.0012x+ 0.0321,R2 = 0.9979,根據標準曲線計算得到各組的PBP2a的表達量如圖4所示。
從圖4中可以看出,對于三株MRSE盡管已經使用了濃度已相對較高(64 μg·mL-1)的萬古霉素,但是萬古霉素對它們的抑制作用并不理想。對于SE21021,各組藥物均抑制了PBP2a的表達(P<0.05),且聯用組的PBP2a蛋白(301.50 ng·μL-1±13.26)比氨芐西林單用組(329.82 ng·μL-1±2.15)、萬古霉素組(360.26 ng·μL-1±9.26)都低(P<0.05),但比二氫丹參酮Ⅰ單用組(294.48 ng·μL-1±2.07)高(P>0.05)。對于SE26508,除萬古霉素組,其他各組藥物均抑制了PBP2a的表達,但只有氨芐西林單用組(187.47 ng·μL-1±3.74)具有統計學意義(P<0.05);聯用組PBP2a(224.27 ng·μL-1±10.53)的表達低于萬古霉素組(250.90 ng·μL-1±8.21)且具有統計學意義(P<0.05),高于氨芐西林單用組、二氫丹參酮Ⅰ單用組(218.27 ng·μL-1±8.89)但差異無統計學意義(P>0.05)。對于SE30291,各組藥物均抑制了PBP2a的表達,除了萬古霉素組,其余組均無統計學意義(P>0.05);聯用組的PBP2a蛋白(220.56 ng·μL-1±11.29)比氨芐西林單用組(329.82 ng·μL-1±2.15)、萬古霉素組(213.44 ng·μL-1±5.74)都高,差異無統計學意義(P>0.05),但是比二氫丹參酮Ⅰ單用組(232.35 ng·μL-1±7.00)低,差異無統計學意義(P>0.05)。
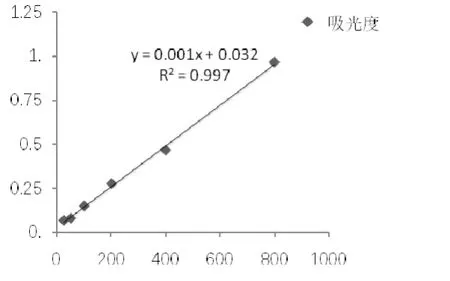
圖3 PBP2a定量標準曲線
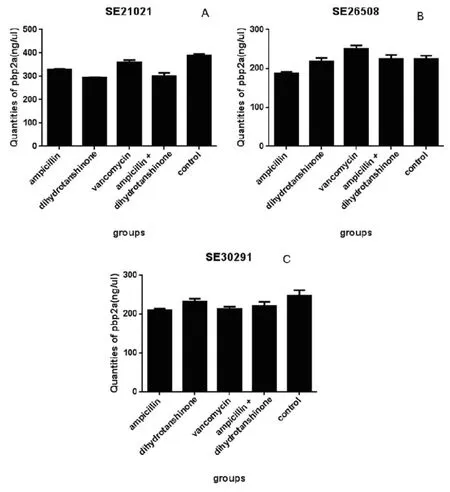
圖4 藥物干預后臨床菌株生物膜中PBP2a蛋白定量結果
3 討論
MRSE是臨床重要的多重耐藥菌之一,其耐藥機制主要與mecA基因編碼產生新的青霉素結合蛋白-PBP2a有關。轉肽酶PBP2a與β-內酰胺類抗生素的親和力極低,當正常的PBPs被β-內酰胺類藥物結合而失去活性時,PBP2a能代替其功能,促進肽聚糖合成,維持SE的生長,從而導致其對β-內酰胺類等多種臨床常用抗生素耐藥。而生物膜內環境的改變可激活耐藥基因的表達,甚至影響基因表達譜,發生基因水平轉移,其中少數細菌的耐藥性會傳遞給其他細菌[6],導致SE生物膜內mecA基因攜帶細菌越來越多,從而增加對β-內酰胺類抗生素的耐藥性。因此研究可以抑制生物膜陽性MRSE的藥物或方法可以有效控制臨床MRSE的傳播。
針對MRS的治療,一篇發表在Nature Chemical Biology上的文章指出哌拉西林、美羅培南、他唑巴坦組合使用可以協同抑制MRSA,并破壞細菌細胞壁。在小鼠感染模型中,三藥聯用方案與利奈唑胺同樣有效,因此可見β-內酰胺類抗生素與其他抗生素聯用是可以恢復對MRSA的抑制作用[7]。另外有些研究[8~9]還發現從天然藥物中提取的有效成分與β-內酰胺類抗生素聯用可以協同抑制MRS,如Carolina等[8]發現從八寶樹中提取的成分F-10可以協同β-內酰胺類抗生素通過降低PBP2a的表達來抑制MRSA,段德軍[9]等人發現丹參酮與氨芐西林、頭孢唑啉聯用可以增強對MRSA的抑制作用,同時還可以增強MRSA對萬古霉素的敏感性。
本課題組前期研究中,我們發現二氫丹參酮與氨芐西林聯用具有對MRSE浮游菌與生物膜細菌的協同抑菌作用,故本研究以MRSE耐藥基因為靶點,分析藥物對生物膜陽性的MRSE mecA、PBP2a表達的影響,初步探討丹參活性單體與抗生素聯用對MRSE耐藥逆轉的可能性。其結果顯示:對于SE21021,氨芐西林和二氫丹參酮Ⅰ聯用可以抑制mecA基因的表達,降低PBP2a蛋白的含量,并且與氨芐西林單用相比能降低PBP2a蛋白的表達,這說明聯用可能具有一定的逆轉作用。對于SE30291,藥物聯用后具有抑制mecA基因表達的作用,并且抑制幅度大于氨芐西林單用組,但PBP2a蛋白的表達卻比氨芐西林單用高。對于SE26508,聯用之后反而促進了mecA的表達。說明聯用后不能100%的抑制所有菌株mecA的表達。同時,我們發現藥物對mecA和PBP2a蛋白表達的抑制存在著不一致的現象:在SE26508,藥物聯用后促進了mecA的表達,但降低了PBP2a的表達,其可能的原因是:盡管mecA是PBP2a的編碼基因,但mecA的其他轉錄調控機制會影響PBP2a的合成。有研究證實[10]mecA轉錄形式包括組成型、誘導型與延遲誘導型。mecRI-mecI系統調控組成型轉錄方式,其調控mecA基因的表達水平與PBP2a蛋白表達成正相關。而blaRI-blaI系統控制誘導型與延遲誘導型轉錄方式,PBP2a的合成需要β-內酰胺類抗生素的誘導刺激下產生,因而mecA基因與PBP2a蛋白表達水平并非完全一致。
綜上,由于本次實驗選擇的菌株數較少,且使用同一濃度藥物作用的效果也不盡相同,因此尚不能得出二氫丹參酮Ⅰ和氨芐西林聯用對MRSE具有耐藥逆轉的作用,需加大菌株數量、增加生物膜形成前后耐藥基因表達水平和耐藥表型檢測以進一步探求和驗證。
[1]Heilmann C, Hussain M, Peters G,et al.Evidence for autolysinmediated primary attachment of Staphylococcus epidermidis to a polystyrene surface [J].Molecular Microbiology, 1997,24(5): 1013.
[2]Henning Büttner, Dietrich Mack, Holger Rohde.Structural basis of Staphylococcus epidermidis biofilm formation:mechanisms and molecular interactions [J].Frontiers in Cellular and Infection Microbiology, 2015,5:4.
[3]崔新潔,夏瑾,邵鐵娟等.中藥抗耐甲氧西林金黃色葡萄球菌生物膜研究進展 [J].中國中醫藥信息雜志.2017,24(2):132.
[4]李燕,李冬冬,宋瑱,等.4種方法檢測表皮葡萄球菌生物膜形成能力的應用價值探討[J].中國實驗診斷學.2011,15(3):424.
[5]李燕,李冬冬,陶傳敏,等.表皮葡萄球菌生物膜形成及相關基因的檢測及評價[J].中華醫院感染學雜志.2010,20(4):473.
[6]Lewis K.Riddle of biofilm resistance[J].Antimicrob Agents Chemother, 2001, 45(4): 999.
[7]Patrick RG, Mitchell WP, Renee B,et al.Synergistic,collaterally sensitive β-lactam combinations suppress resistance in MRSA[J].Nature Chemical Biology,2015,11:855.
[8]Carolina S, Ee Leen P, Kuan-Hon L,et al.Inhibition of penicillin-binding protein 2a(PBP2a) in methicillin resistant Staphylococcusaureus (MRSA) by combination of ampicillin and abioactive fraction from Duabanga grandiflora[J].BMC Complementary and Alternative Medicine ,2015,15:178.
[9]段德軍.丹參酮與萬古霉素聯合應用對MRSA的抑制作用[J].實用全科醫學,2008,6(4);363.
[10]陸克喬.滇重樓正丁醇提取物抗白念珠菌生物膜作用及機制研究[D].安徽:安徽中醫藥大學, 2016.

