番茄褪綠病毒實時熒光定量PCR檢測技術的建立
丁天波,劉曉蓓,李潔,魏可可,褚棟
?
番茄褪綠病毒實時熒光定量PCR檢測技術的建立
丁天波,劉曉蓓,李潔,魏可可,褚棟
(青島農業大學植物醫學學院山東省植物病蟲害綜合防控重點實驗室,山東青島 266109)
【目的】建立一種實時熒光定量PCR(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR)檢測番茄褪綠病毒(,ToCV)的方法,用于測定田間植株樣品及其傳毒媒介煙粉虱()中ToCV的含量。【方法】首先根據ToCV次要外殼蛋白(minor coat protein,CPm)基因的保守區域序列,運用Primer 3.0在線軟件設計ToCV特異性檢測引物ToCVqF和ToCVqR,并通過Primer-BLAST進行比對保證檢測引物的特異性;其次分別以感染ToCV、番茄黃化曲葉病毒(, TYLCV)、番茄斑萎病毒(, TSWV)的番茄樣品為模板,應用該對引物進行ToCV基因片段的克隆鑒定;將陽性克隆樣品放入含有氨芐青霉素的LB液體培養基中擴大培養,并提取質粒,獲得ToCV質粒標準品,將ToCV質粒標準品按10倍濃度梯度稀釋,建立標準曲線;同樣以按10倍濃度梯度稀釋的ToCV質粒標準品為模板,同時運用RT-qPCR和反轉錄PCR(reverse transcription-polymerase chain reaction,RT-PCR),比較這兩種方法檢測ToCV的靈敏度;最后應用該方法對田間采集的8份疑似ToCV感染的番茄樣品以及獲毒24 h后的單頭煙粉虱進行病毒檢測,結合擴增曲線、熔解曲線和Ct值對待測樣品中的帶毒情況和帶毒量進行測定。【結果】在感染ToCV的番茄樣品和陽性對照中,引物ToCVqF和ToCVqR均能夠特異擴增出ToCV CPm基因片段,目的片段大小為230 bp,而在感染TYLCV、TSWV的番茄樣品、健康番茄樣品和空白對照中,該對引物則無法擴增出特異性目的條帶,說明該對引物特異性較強;構建ToCV的RT-qPCR標準曲線結果表明,隨著ToCV質粒標準品模板濃度逐漸降低,Ct值出現遞增趨勢,并且在質粒標準品濃度2.7×103—2.7×109copies/μL范圍內,ToCV標準曲線Ct值同質粒標準品濃度之間呈現良好的線性關系,擴增效率為100%,決定系數R=0.9911,直線方程為= -3.32×lg+40.06(代表循環閾值即Ct值,代表質粒初始濃度),該曲線將用于ToCV含量的測定。RT-qPCR靈敏度檢測結果表明,該方法能夠檢測出的ToCV質粒標準品最低濃度為2.7×103copies/μL,而常規RT-PCR僅能夠檢測出2.7×105copies/μL的病毒樣品,通過RT-qPCR法檢測ToCV比常規RT-PCR法靈敏100倍。該方法能成功檢測出田間植物樣品攜帶ToCV情況,8份疑似ToCV感染的番茄樣品中有6份攜帶ToCV,同常規RT-PCR檢測結果一致,結合標準曲線計算出感染ToCV的番茄樣品帶毒量分別為2.48×105、2.21×105、7.97×104、3.74×107、3.37×107、2.78×106copies/μL;煙粉虱獲毒24 h后,攜毒率為100%,單頭煙粉虱最高帶毒量為2.55×104copies/μL,最低為6.46×102copies/μL。【結論】建立的RT-qPCR檢測ToCV的方法特異性強、靈敏度高,可以實現植物樣品和媒介昆蟲攜帶ToCV情況和病毒含量的檢測,可為ToCV的準確、有效監測和預警提供技術支持。
番茄褪綠病毒;實時熒光定量PCR;煙粉虱;檢測
0 引言
【研究意義】番茄褪綠病毒(,ToCV)是一種隸屬于長線形病毒科()毛形病毒屬()的RNA病毒,可侵染番茄、辣椒、煙草等多種作物[1]。ToCV是一種世界性病毒,1998年美國佛羅里達州對該病毒進行了首次報道[2],此后在南美洲、非洲、歐洲、亞洲相繼被發現[3-6];國內自2012年ToCV在北京地區辣椒上首次被發現后[7],相繼在山東、天津、河南、江蘇、內蒙古、廣東等多個地區發現其危害,給番茄等蔬菜生產造成了嚴重的損失[8-14]。作為一種僅能依靠蟲媒傳播的半持久性病毒,ToCV的迅速擴散離不開其傳播媒介——粉虱,而煙粉虱()作為中國番茄產區的主要粉虱種群,有調查研究發現ToCV的擴散同其具有較為密切的關系[8,15]。而目前針對植物病毒病,早期檢測、監測和預警是有效防止其蔓延的重要手段之一,因此建立一種可以準確、靈敏、快速檢測田間植株樣品和媒介昆蟲體內ToCV的檢測方法,對于該病毒的有效防控具有重要意義。【前人研究進展】目前,針對ToCV的檢測,早期有血清學檢測方法[16],但其檢測靈敏度有限,而分子生物學檢測技術能較好彌補這一缺陷。ToCV的分子生物學檢測技術比較常見的有反轉錄PCR(reverse transcription-polymerase chain reaction,RT-PCR)檢測法[6,17]和逆轉錄環介導等溫擴增(reverse transcription loop-mediated isothermal amplification,RT-LAMP)檢測法[18]等。上述兩種方法均能夠特異檢測出樣品中所包含的ToCV,靈敏度相對較高,但對于低豐度病毒樣品中ToCV的檢測仍然略顯不足,并且無法測定樣品中病毒含量。而實時熒光定量PCR技術(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR)因其自身高靈敏度、高特異性以及可定量等優點,成為許多現有植物病毒檢測的重要技術手段之一[19-20]。針對ToCV的實時熒光定量檢測,Orfanidou等[21]運用TaqMan探針法對番茄、龍葵、苦苣菜、反枝莧、藜等寄主植物感染ToCV情況及帶毒量進行檢測。【本研究切入點】目前有關ToCV的RT-qPCR檢測技術報道相對較少,雖然已有TaqMan探針檢測ToCV的方法,但其檢測成本較高,而基于SYBR Green I熒光染料的RT-qPCR成本較低,因此構建一種準確性好、靈敏度高、可定量并且成本低能夠滿足高通量應用的RT-qPCR檢測技術體系尤為必要。【擬解決的關鍵問題】選擇ToCV基因組特定區域設計特異性強的RT-qPCR檢測引物,制備ToCV質粒標準品,建立合格標準曲線,摸索成熟完整的RT-qPCR檢測技術體系,實現植物樣品中和傳毒媒介煙粉虱體內ToCV的準確、有效檢測,為ToCV的早期監測、預警提供技術支撐。
1 材料與方法
試驗于2015—2016年在青島農業大學山東省植物病蟲害綜合防控重點實驗室完成。
1.1 供試毒源和蟲源
原始感染ToCV番茄毒株系于2014年采自青島市上馬區,并通過實驗室內長期飼養的Q煙粉虱(即Q型煙粉虱)進行接種,接種成功后的番茄植株置于人工氣候室(溫度:(27±1)℃;相對濕度:(60±5)%;光周期:16L﹕8D)內培養,作為供試毒源。
試驗所用Q煙粉虱同樣長期飼養在人工氣候室中(條件同上)。
1.2 主要試劑
Trizol(Thermo Fisher Scientific公司)、反轉錄試劑盒PrimeScript RT reagent Kit(Perfect real-time)(TaKaRa公司)、rTaq酶(TaKaRa公司)、膠回收試劑盒(TaKaRa Mini BEST Agarose GEL DNA Extraction Kit,TaKaRa公司)、質粒提取試劑盒(TIANprep Mini Plasmid Kit,天根生化科技有限公司)、pMDTM18-T Vector(TaKaRa公司)、感受態細胞(Trans 5,北京全式金生物技術有限公司)。
1.3 引物設計
根據NCBI數據庫中ToCV次要外殼蛋白(minor coat protein,CPm)基因(GenBank登錄號:AGN91010.1)的保守序列,運用Primer 3.0在線軟件(http://bioinfo.ut.ee/primer3-0.4.0/)設計ToCV的實時熒光定量PCR檢測特異引物,并通過NCBI中的Primer-BLAST進行比對,保證所設計引物的特異性。上游引物ToCVqF:CTTTCTGGATGGTTTGCGGC;下游引物ToCVqR:TCCCCAACCAATGGTCGTTT。引物由英濰捷基(上海)貿易有限公司進行合成。
1.4 番茄和單頭煙粉虱總RNA的提取與RT-PCR
剪取0.05 g番茄葉片置于去除RNase的研缽中,加入液氮充分研磨后,采用Trizol試劑并按照說明書步驟完成番茄葉片總RNA的提取;將單頭煙粉虱置于RNase free的1.5 mL離心管中,液氮冷凍后充分研磨,加入200 μL Trizol試劑充分裂解,并按照說明書同比例減少后續所需試劑的用量,最終使用8 μL RNase free溶解單頭煙粉虱的總RNA。結合瓊脂糖凝膠電泳檢測提取RNA樣品的完整性,并運用核酸蛋白濃度測定儀檢測RNA樣品純度和濃度,選取優質合格的總RNA樣品(A260/A280在1.8—2.1)進行后續試驗。
取質量合格的總RNA樣品,按照反轉錄試劑盒說明書進行RT-PCR完成第一鏈cDNA的合成,并置于-20℃保存以備后續試驗使用。
1.5 ToCV基因片段克隆與鑒定
將上述RT-PCR獲得的cDNA作為模板,進行PCR擴增,總反應體系為25 μL:10×PCR Buffer(Mg2+plus) 2.5 μL、dNTP Mixture 2 μL、ToCVqF和ToCVqR各1 μL、cDNA模板1 μL、r Taq 0.25 μL、ddH2O 17.25 μL。PCR反應程序:94℃預變性3 min;94℃變性30 s,60℃退火30 s,72℃延伸30 s,35個循環;72℃后延伸10 min。
將上述PCR產物進行瓊脂糖凝膠電泳后,切下目的條帶,采用膠回收試劑盒進行純化回收,連接至pMDTM18-T Vector,并轉化進入感受態細胞Trans 5,37℃過夜培養后經藍白斑篩選,挑取白色單菌落置于含有氨芐青霉素的LB液體培養基中振蕩培養(37℃,220 r/min,6 h)。將菌液經特異引物ToCVqF和ToCVqR檢測后,將陽性克隆送至英濰捷基(上海)貿易有限公司進行測序。
1.6 ToCV質粒標準品的制備
選擇測序結果中序列完全正確的陽性克隆樣品,繼續放入含有氨芐青霉素的LB液體培養基中擴大培養(37℃,220 r/min,過夜)后,使用質粒提取試劑盒完成ToCV質粒的提取,使用核酸蛋白濃度測定儀測定質粒濃度后保存至-20℃。運用公式:C = A/B×6.02×1014(其中A代表質粒濃度ng·μL-1,B代表質粒DNA分子量,C代表copies/μL)計算出質粒濃度拷貝數,將其作為ToCV質粒標準品使用。
1.7 標準曲線的建立
將質粒標準品用DNase/RNase free water(購自天根生化科技有限公司)按照10倍梯度進行稀釋,獲得終濃度為2.7×103—2.7×109copies/μL的7個質粒樣品作為模板,在實時熒光定量PCR儀(qTower 2.2 real-time PCR Thermal Cycler,Analytikjena公司)上進行RT-qPCR,每個濃度進行兩次技術重復,儀器自動生成標準曲線。反應體系為20 μL:SYBR Premix Ex TaqTMII 10 μL、ToCVqF和ToCVqR各1 μL、模板1 μL、ddH2O 7 μL。
1.8 實時熒光定量PCR的靈敏度檢測
將質粒標準品按照10倍梯度稀釋成2.7×1010—2.7×103copies/μL的8個樣品,并以此作為模板分別進行RT-qPCR和常規RT-PCR,比較這兩種方法的檢測靈敏度。
1.9 田間番茄樣品的ToCV檢測
對田間采集的8份疑似ToCV感染的番茄樣品進行總RNA提取,通過RT-qPCR進行病毒檢測,根據擴增曲線、熔解曲線和Ct值確定其帶毒情況,并根據標準曲線計算出病毒感染樣品的攜毒量。
1.10 單頭煙粉虱體內的ToCV毒量測定
用吸蟲管吸取45頭煙粉虱成蟲,分成3組分別用微蟲籠夾在ToCV番茄毒株的葉片上,獲毒24 h后,從每個微蟲籠中隨機吸取8頭煙粉虱,共計24頭,單頭分裝于RNase free的1.5 mL離心管中,液氮冷凍后用于總RNA提取;同樣,將20頭煙粉虱置于健康番茄植株上取食24 h后,隨機取6頭進行總RNA提取,作為陰性對照。通過RT-qPCR方法檢測單頭煙粉虱體內攜帶ToCV的情況,并計算攜毒量。
2 結果
2.1 ToCV基因片段的克隆與鑒定
將感染ToCV番茄提取總RNA后經RT-PCR合成的第一鏈cDNA作為模板,運用ToCVqF和ToCVqR進行常規PCR擴增,其中實驗室保存ToCV樣品的cDNA作為陽性對照,番茄黃化曲葉病毒(,TYLCV)樣品的DNA、番茄斑萎病毒(,TSWV)樣品的cDNA及健康番茄的cDNA作為陰性對照,ddH2O作為空白對照。PCR擴增產物經1%的瓊脂糖凝膠電泳,結果表明(圖1),感染ToCV番茄樣品出現特異單一條帶,位置在230 bp,同陽性對照條帶大小一致,而陰性對照和空白對照則無特異條帶出現。將目的條帶切膠回收,經連接克隆送至英濰捷基(上海)貿易有限公司進行測序,將測序結果分析并在NCBI數據庫中進行BLASTn比對,結果證實經ToCVqF和ToCVqR擴增所獲序列為ToCV CPm基因片段。
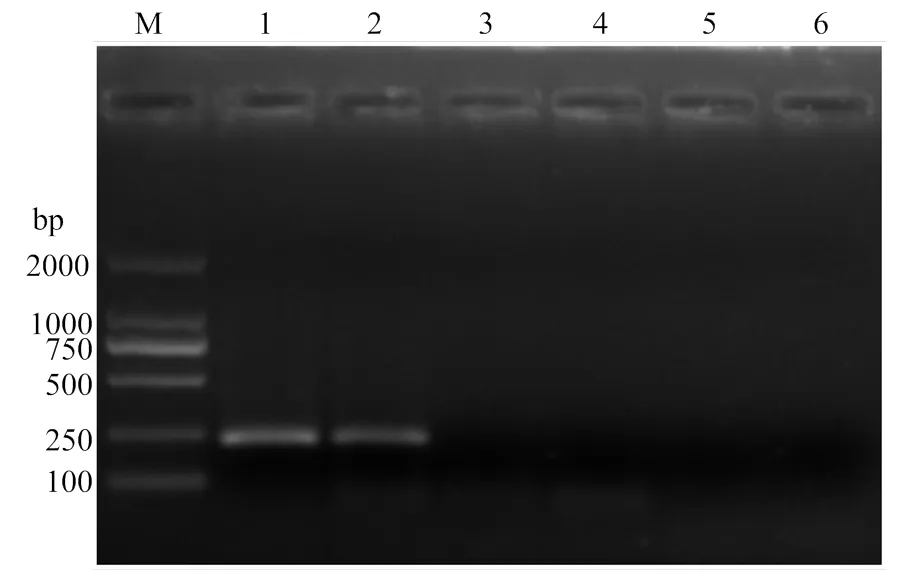
M:2000 bp分子量標準2000 bp DNA Marker;1:感染ToCV的番茄樣品ToCV-infected tomato sample;2:陽性對照Positive control;3:感染TYLCV的番茄樣品TYLCV-infected tomato sample;4:感染TSWV的番茄樣品TSWV-infected tomato sample;5:健康番茄樣品Healthy tomato sample;6:空白對照Blank control
圖1 常規RT-PCR擴增ToCV目的片段
Fig. 1 The amplification of ToCV fragment by RT-PCR
2.2 標準曲線的建立
以10倍梯度進行稀釋的7個質粒樣品作為模板,進行RT-qPCR,結果表明(圖2),隨著陽性質粒模板濃度逐漸降低,Ct值出現遞增趨勢,并且在質粒標準品濃度2.7×103—2.7×109copies/μL范圍內,Ct值同質粒標準品濃度之間線性關系良好,標準曲線斜率為-3.32,決定系數R=0.9911,擴增效率為100%,直線方程為=-3.32×lg+40.06(代表循環閾值即Ct值,代表質粒初始濃度)。該標準曲線將用于ToCV含量的測定。
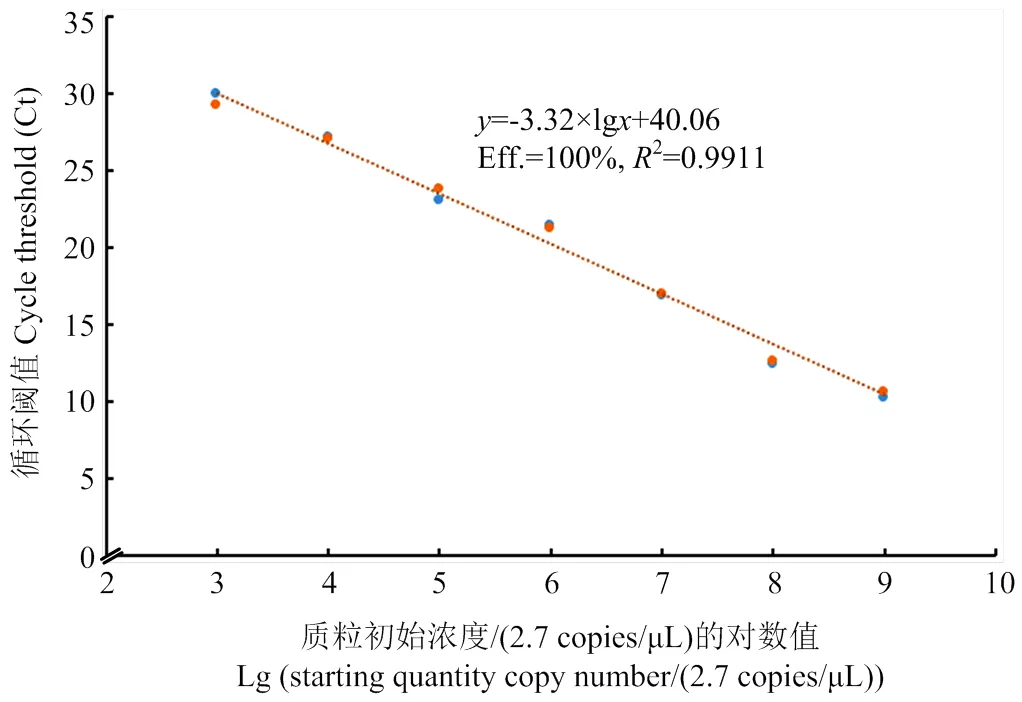
圖2 ToCV的RT-qPCR標準曲線圖
2.3 實時熒光定量PCR的靈敏度檢測
RT-qPCR和常規RT-PCR的靈敏度檢測比對結果表明,運用基于RT-qPCR的ToCV檢測方法能夠最低檢測出2.7×103copies/μL的病毒樣品(圖3),而常規RT-PCR僅能夠檢測到2.7×105copies/μL的病毒樣品(圖4),表明RT-qPCR檢測ToCV的靈敏度比常規RT-PCR檢測提高了100倍。
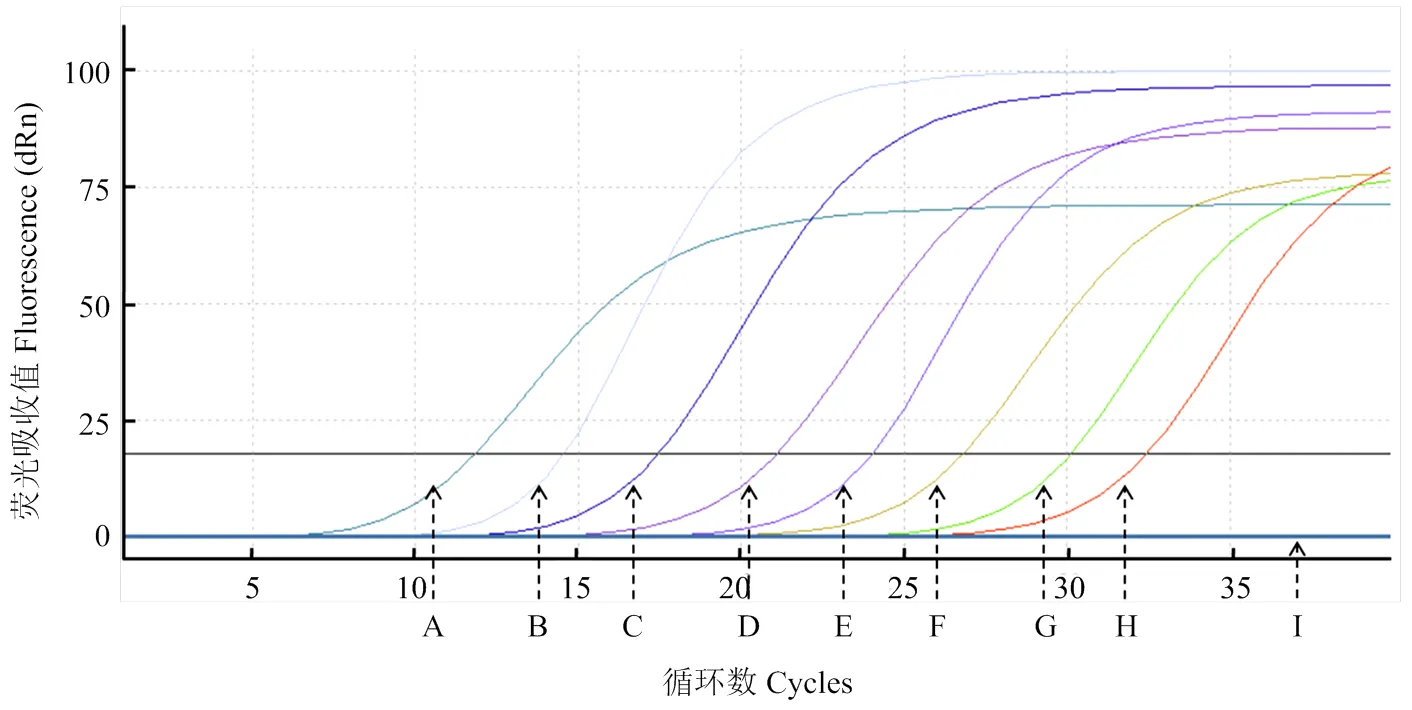
A—H:2.7×1010—2.7×103 copies/μL質粒標準品2.7×1010-2.7×103 copies/μL standard plasmid;I:空白對照Blank control
M:2000 bp分子量標準2000 bp DNA Marker;1—8:2.7×1010—2.7×103 copies/μL質粒標準品2.7×1010-2.7×103 copies/μL standard plasmid;9:空白對照 Blank control
2.4 田間番茄樣品的ToCV檢測
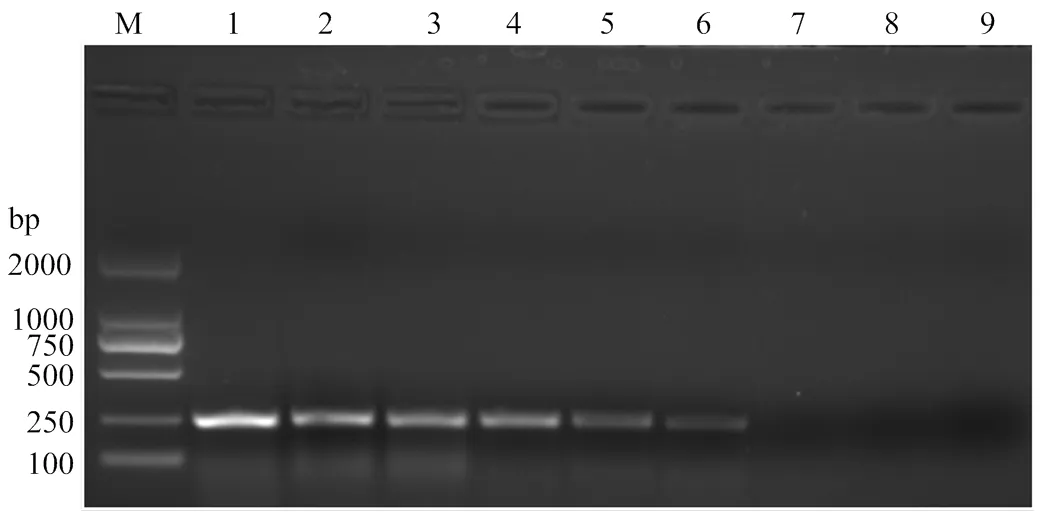
運用RT-qPCR方法對采自田間的8份疑似ToCV感染癥狀的番茄樣品進行檢測,結果表明6份田間采集樣品(樣品1、2、4、5、7、8)均和陽性對照(實驗室保存ToCV樣品)一樣,擴增曲線良好(圖5-I);并且此6份田間樣品和陽性對照在熔解曲線中均出現單一熔解峰,位置相同(圖5-II);而其余兩份樣品(樣品3和6)同陰性對照(健康番茄樣品)和空白對照(ddH2O)一樣均未出現擴增(圖5-I),并且熔解曲線圖中無單一峰出現(圖5-II)。說明這8份疑似ToCV感染的樣品中有6份攜帶ToCV。
6份感染ToCV樣品的Ct值分別為23.58、23.75、25.22、16.35、16.50和20.10,結合ToCV質粒標準品的標準曲線,計算出6份樣品中ToCV的含量為2.48×105、2.21×105、7.97×104、3.74×107、3.37×107、2.78×106copies/μL。
此外對上述樣品進行常規RT-PCR檢測,結果發現樣品1、2、4、5、7、8和陽性對照一樣,均在相同位置(230 bp)出現了特異單一條帶;而樣品3和6同陰性對照、空白對照一樣,無特異條帶出現(圖6)。常規RT-PCR進一步證實了RT-qPCR方法的檢測結果。
2.5 單頭煙粉虱體內的ToCV含量測定
運用RT-qPCR方法對獲毒24 h后單頭煙粉虱體內的ToCV進行定量檢測,試驗分3組進行,結果發現(表1),煙粉虱在感染ToCV的番茄毒株上獲毒24 h后,帶毒率為100%,單頭煙粉虱最高攜帶ToCV量為2.55×104copies/μL,最低為6.46× 102copies/μL。

I:A、B、D、E、F、G:感染ToCV樣品ToCV-infected samples;C:陽性對照Positive control;H:未感染ToCV樣品、陰性對照、空白對照ToCV-uninfected samples, negative control and blank control。II:A、B、D、E、F、G:感染ToCV樣品ToCV-infected samples;C:陽性對照Positive control;H—K:未感染ToCV樣品、陰性對照、空白對照ToCV-uninfected samples, negative control and blank control
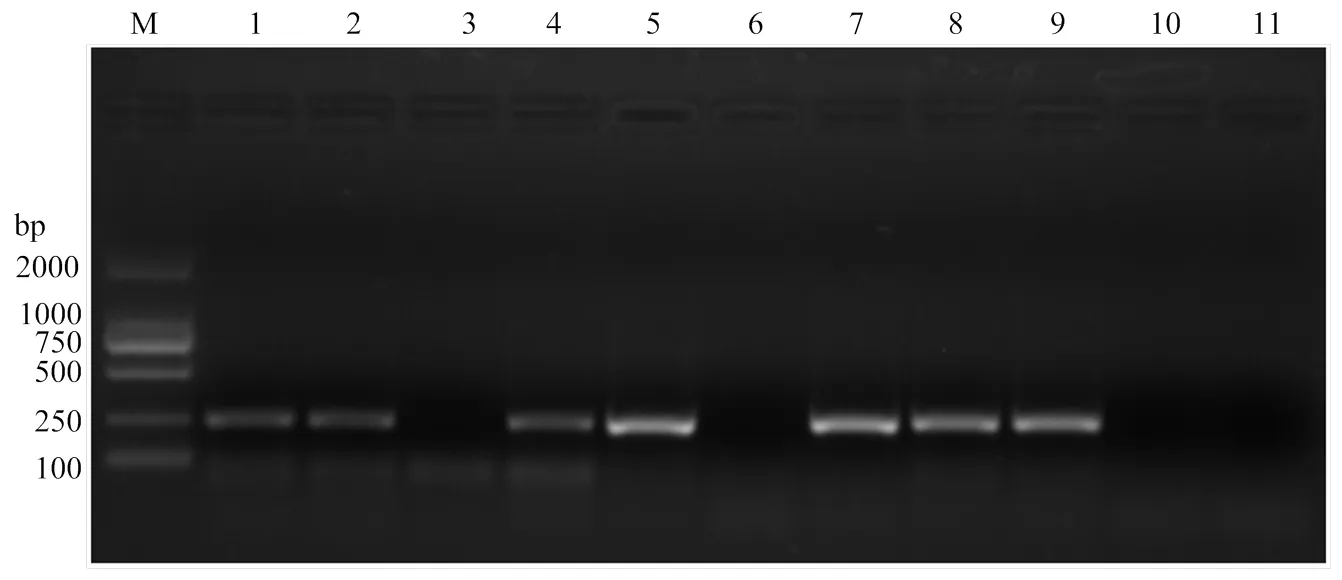
圖6 田間樣品的常規RT-PCR檢測

表1 實時熒光定量PCR檢測單頭煙粉虱體內ToCV含量
Nc:陰性對照Negative control
3 討論
ToCV是一種重要的世界性蟲傳病毒,近年來對于ToCV檢測的相關報道也逐漸增多。目前來看,針對ToCV檢測使用最為普遍的方法是RT-PCR法,其檢測步驟較為繁瑣,整體流程耗時較長;Kil等[18]將LAMP法進行改進,建立了一種快速、相對靈敏并有效避免攜帶污染的ToCV檢測方法。但上述兩種方法都存在檢測靈敏度有限,且不能準確定量的缺點,而RT-qPCR檢測方法能夠很好地彌補上述缺陷,并廣泛應用于多種植物病毒的檢測和研究中,例如番茄黃化曲葉病毒[22]、玉米褪綠斑駁病毒(,MCMV)[23]等。故本研究基于SYBR Green I,建立一種準確、靈敏且成本較低的RT-qPCR檢測ToCV的方法,能夠成功運用于植株樣品及媒介昆蟲帶毒情況及病毒含量檢測。
針對ToCV檢測引物的設計區域,研究者多集中于外殼蛋白(coat protein,CP)[7,24]和熱激蛋白(heat shock protein,HSP)[25],本研究則選取ToCV CPm的保守區域設計出用于ToCV的RT-qPCR檢測的特異引物ToCVqF/R,通過常規PCR擴增發現ToCV樣品在目的大小處條帶單一,并且不能擴增出其他兩種番茄常見病毒片段,說明該對引物特異性較強,能夠滿足后續RT-qPCR驗證試驗;RT-qPCR結果發現該對引物擴增曲線良好,且具備特異熔解峰,結合本研究摸索的反應體系和條件,能夠最大程度保證RT-qPCR過程中ToCV的有效擴增,增強反應特異性。本檢測方法涉及樣品病毒含量的絕對定量,因此標準品的選擇尤為關鍵,筆者選擇純化的重組質粒DNA作為標準品,較許多體外反轉錄而成的cRNA標準品,具有穩定易保存,方便標準化等優點[26]。以ToCV重組質粒DNA作為標準品構建而成的標準曲線,質粒標準品中ToCV拷貝數的對數值同Ct值之間呈現良好的線性關系,且技術重復間差異性小,決定系數達0.9911;并且擴增效率為100%,完全滿足樣品中ToCV含量測定的需求。通過比較常規PCR和RT-qPCR檢測ToCV的靈敏度,結果發現RT-qPCR方法能最低檢測到2.7×103copies/μL的病毒樣品,比常規RT-PCR的檢測靈敏度高出100倍,因此對田間低豐度病毒樣品以及微小媒介昆蟲體內ToCV的準確有效檢測成為現實。高利利[27]基于ToCV的HSP70基因保守區建立了ToCV SYBR Green I RT-qPCR檢測方法,該方法中同樣選取質粒標準品建立標準曲線,擴增效率高達99.8%,進一步暗示了重組化質粒DNA可作為標準品的較優選擇;該研究選取瓜類褪綠黃化病毒(,CCYV)、黃瓜花葉病毒(,CMV)、番茄花葉病毒(,ToMV)和TSWV進行特異性試驗,均無交叉反應,特異性好,而本研究僅選取TYLCV和TSWV作為陰性對照,尚需在后續驗證中擴大檢測范圍;研究者同樣應用該體系進行了大規模感病植株的有效檢測,但對于單頭媒介昆蟲體內ToCV的檢測適用性研究尚未涉及。
在本研究中,對田間采集的8份疑似攜帶ToCV樣品進行檢測,通過分析擴增曲線、熔解曲線并與陽性、陰性和空白對照進行對比,表明其中有6份樣品攜帶ToCV,結合常規RT-PCR驗證,證實了該方法對于植株病毒樣品的檢測適用性。煙粉虱在中國屬于優勢粉虱種群,多種病毒的擴散均同其具有密切關系,最為典型的屬番茄黃化曲葉病毒[28];并且有調查研究發現ToCV發病株率隨煙粉虱種群數量增加而升高[15]。煙粉虱作為ToCV的“收集器”和“注射器”,通過對其攜毒情況的檢測,對田間ToCV的早期預警以及流行趨勢預測具有重要的意義。因此本研究運用該方法對單頭煙粉虱體內攜毒情況和帶毒量進行檢測,結果發現,煙粉虱獲毒24 h后,帶毒率達到100%,攜毒量主要集中在103數量級,占據帶毒煙粉虱總數的79.17%。褐色橘蚜()同樣作為半持久性病毒——柑橘衰退病毒(,CTV)的有效傳播媒介之一[29],李玲娣等[30]對單頭褐色橘蚜獲毒24 h后蟲體帶毒量進行研究,發現多數帶毒量集中在104—105數量級,也暗示不同媒介昆蟲獲毒能力差異較大。Papayiannis等[31]運用TaqMan探針法對感染ToCV番茄上的煙粉虱和溫室白粉虱()體內ToCV進行檢測,其Ct值約為25,略低于本研究測定的煙粉虱帶毒量的Ct值(26.86—32.16),此二者研究的差異可能由于粉虱來源不同,感染ToCV番茄上的煙粉虱種群獲毒時間相對較長,故其帶毒量稍大于煙粉虱24 h的獲毒量。此外,檢測方法的不同也是造成結果差異的原因之一。
4 結論
基于SYBR Green I建立的RT-qPCR檢測ToCV的方法,特異性強、靈敏度高,能夠滿足針對植物樣品和媒介昆蟲中ToCV的檢測和帶毒量測定,且成本較低,適用于批量樣品的集中、快速檢測,該技術體系可用于ToCV的長期監測預警和流行趨勢研究。
[1] WINTERMANTEL W M, WISLER G C. Vector specificity, host range, and genetic diversity of., 2006, 90(6): 814-819.
[2] WISLER G C, LI R H, LIU H Y, LOWRY D S, DUFFUS J E.: a new whitefly-transmitted, phloem-limited, bipartite closterovirus of tomato., 1998, 88(5): 402-409.
[3] BARBOSA J C, TEIXEIRA A P M, MOREIRA A G, CAMARGO L E A, BERGAMIN-FILHO A, KITAJIMA E W, REZENDE J A M. First report ofinfecting tomato crops in Brazil., 2008, 92(12): 1709.
[4] FIALLO-OLIVé E, HAMED A A, MORIONES E, NAVAS- CASTILLO J. First report ofin infecting tomato in Sudan., 2011, 95(12): 1592.
[5] LOURO D, ACCOTTO G P, VAIRA A M. Occurrence and diagnosis ofin Portugal., 2000, 106(6): 589-592.
[6] TSAI W S, SHIH S L, GREEN S K, HANSON P. First report of the occurrence ofandin Taiwan., 2004, 88(3): 311.
[7] ZHAO R, WANG R, WANG N, FAN Z F, ZHOU T, SHI Y C, CHAI M. First report ofin China., 2013, 97(8): 1123.
[8] 劉永光, 魏家鵬, 喬寧, 李美芹, 劉曉明, 竺曉平. 番茄褪綠病毒在山東暴發及其防治措施. 中國蔬菜, 2014(5): 67-69.
LIU Y G, WEI J P, QIAO N, LI M Q, LIU X M, ZHU X P. The occurrence and management ofin Shandong Province., 2014(5): 67-69. (in Chinese)
[9] 高利利, 孫國珍, 王勇, 高葦, 張春祥, 張安勝, 竺曉平. 天津地區番茄褪綠病毒的分子檢測和鑒定. 華北農學報, 2015, 30(3): 211-215.
GAO L L, SUN G Z, WANG Y, GAO W, ZHANG C X, ZHANG A S, ZHU X P. Molecular detection and identification ofin Tianjin., 2015, 30(3): 211-215. (in Chinese)
[10] 胡京昂, 萬秀娟, 李自娟, 黃文, 李武高, 應芳卿. 河南番茄褪綠病毒的分子鑒定. 中國蔬菜, 2015(12): 25-28.
HU J A, WAN X J, LI Z J, HUANG W, LI W G, YING F Q. Molecular identification onin Henan Province., 2015(12): 25-28. (in Chinese)
[11] 吳淑華, 李廷芳, 趙文浩, 程兆榜, 郭青云, 趙統敏, 余文貴, 朱葉芹, 季英華. 江蘇省番茄黃化曲葉病毒和褪綠病毒復合侵染的分子檢測. 園藝學報, 2016, 43(1): 89-99.
WU S H, LI T F, ZHAO W H, CHENG Z B, GUO Q Y, ZHAO T M, YU W G, ZHU Y Q, JI Y H. Molecular identification on mixed infection ofandon tomato in Jiangsu Province., 2016, 43(1): 89-99. (in Chinese)
[12] 鄭慧新, 夏吉星, 周小毛, 張友軍. 警惕煙粉虱傳播的番茄褪綠病毒病在我國快速擴散. 中國蔬菜, 2016(4): 22-26.
ZHENG H X, XIA J X, ZHOU X M, ZHANG Y J. Be on alert of rapid diffusion oftransmitted by whitefly in China., 2016(4): 22-26. (in Chinese)
[13] 湯亞飛, 何自福, 佘小曼, 藍國兵. 侵染廣東番茄的番茄褪綠病毒分子鑒定. 植物保護, 2017, 43(2): 133-137.
TANG Y F, HE Z F, SHE X M, LAN G B. Molecular identification ofinfecting tomato in Guangdong Province., 2017, 43(2): 133-137. (in Chinese)
[14] 魏可可, 李潔, 丁天波, 褚棟. 番茄褪綠病毒在國內外的分布、鑒別方法及粉虱傳毒特性的研究進展. 中國蔬菜, 2018(1): 19-24.
WEI K K, LI J, DING T B, CHU D. Research progress on distribution, identification method of(ToCV) and whitefly transmission characteristics., 2018(1): 19-24. (in Chinese)
[15] 代惠潔, 劉永光, 竺曉平, 劉永杰, 趙靜. 山東壽光地區Q型煙粉虱對番茄褪綠病毒的傳播. 植物保護學報, 2016, 43(1): 162-167.
DAI H J, LIU Y G, ZHU X P, LIU Y J, ZHAO J.(ToCV) transmitted bybiotype Q of Shouguang in Shandong Province., 2016, 43(1): 162-167. (in Chinese)
[16] JACQUEMOND M, VERDIN E, DALMON A, GUILBAUD L, GOGNALONS P. Serological and molecular detection ofandin tomato., 2009, 58(2): 210-220.
[17] KARWITHA M, FENG Z, YAO M, CHEN X J, ZHANG W N, LIU X F, TAO X R. The complete nucleotide sequence of the RNA1 of a Chinese isolate of., 2014, 162(6): 411-415.
[18] KIL E J, KIM S H, LEE Y J, KANG E H, LEE M J, CHO S H, KIM M K, LEE K Y, HEO N Y, CHOI H S, KWON S T, LEE S. Advanced loop-mediated isothermal amplification method for sensitive and specific detection ofusing a uracil DNA glycosylase to control carry-over contamination., 2015, 213: 68-74.
[19] RIZZA S, NOBILE G, TESSITORI M, CATARA A, CONTE E. Real time RT-PCR assay for quantitative detection ofin plant tissues., 2009, 58(1): 181-185.
[20] 劉科宏, 周常勇, 宋震, 周彥, 李中安, 唐科志. 運用實時熒光RT-PCR技術檢測柑橘碎葉病毒. 果樹學報, 2009, 26(5): 748-751.
LIU K H, ZHOU C Y, SONG Z, ZHOU Y, LI Z A, TANG K Z. Detection of(CTLV) by real-time RT-PCR., 2009, 26(5): 748-751. (in Chinese)
[21] ORFANIDOU C G, PAPPI P G, EFTHIMIOU K E, KATIS N I, MALIOGKA V I. Transmission of(ToCV) bybiotype Q and evaluation of four weed species as viral sources., 2016, 100(10): 2043-2049.
[22] 林銘, 胡鴻, 杜永臣, 高建昌, 王孝宣, 國艷梅. 番茄黃化曲葉病毒的實時熒光定量PCR檢測. 中國蔬菜, 2013(2): 20-26.
LIN M, HU H, DU Y C, GAO J C, WANG X X, GUO Y M. Real-time PCR for quantification ofin tomato plants., 2013(2): 20-26. (in Chinese)
[23] 聞偉剛, 張建成, 崔俊霞, 張穎. 玉米褪綠斑駁病毒實時熒光RT-PCR檢測方法研究. 植物檢疫, 2011, 25(1): 39-42.
WEN W G, ZHANG J C, CUI J X, ZHANG Y. Detection ofby real-time fluorescent RT-PCT., 2011, 25(1): 39-42. (in Chinese)
[24] PANNO S, DAVINO S, RUBIO L, RANGEL E, DAVINO M, GARCíA-HERNáNDEZ J, OLMOS A. Simultaneous detection of the seven main tomato-infecting RNA viruses by two multiplex reverse transcription polymerase chain reactions., 2012, 186(1/2): 152-156.
[25] HIROTA T, NATSUAKI T, MURAI T, NISHIGAWA H, NIIBORI K, GOTO K, HARTONO S, SUASTIKA G, OKUDA S. Yellowing disease of tomato caused bynewly recognized in Japan., 2010, 76(2): 168-171.
[26] 胡加誼, 羅志文, 范鴻雁, 李向宏, 劉志昕, 何凡. 菠蘿凋萎相關病毒-2實時熒光定量RT-PCR檢測方法的建立. 園藝學報, 2014, 41(6): 1257-1266.
HU J Y, LUO Z W, FAN H Y, LI X H, LIU Z X, HE F. Development of a real-time fluorescent quantitative RT-PCR method for the detection of., 2014, 41(6): 1257-1266. (in Chinese)
[27] 高利利. 番茄褪綠病毒的分子鑒定及熒光定量PCR檢測體系的建立與應用[D]. 泰安: 山東農業大學, 2016.
GAO L L. Molecular identification ofand development and application of real-time PCR assay[D]. Taian: Shandong Agricultural University, 2016. (in Chinese)
[28] 李廷剛, 李長松. 番茄黃化曲葉病毒研究進展. 中國農學通報, 2011, 27(2): 90-94.
LI T G, LI C S. Advances in research of., 2011, 27(2): 90-94. (in Chinese)
[29] Rocha-Pena M A, Lee R F, Lastra R, Niblett C L, Ochoa-Corona F M, Garnsey S M, Yokomi R K.and its aphid vector: threats to citrus production in the carribean and central and North America., 1995, 79(5): 437-445.
[30] 李玲娣, 周常勇, 李中安, 田曉, 王永江, 唐科志, 周彥, 劉金香. 褐色橘蚜中柑橘衰退病毒實時熒光定量RT-PCR檢測方法的建立與應用. 中國農業科學, 2013, 46(3): 525-533.
LI L D, ZHOU C Y, LI Z A, TIAN X, WANG Y J, TANG K Z, ZHOU Y, LIU J X. Development and application of a real-time RT-PCR approach for quantification of CTV in., 2013, 46(3): 525-533. (in Chinese)
[31] PAPAYIANNIS L C, HARKOU I S, MARKOU Y M, DEMETRIOU C N, KATIS N I. Rapid discrimination of,and co-amplification of plant internal control using real-time RT-PCR., 2011, 176(1/2): 53-59.
(責任編輯 岳梅)
Development of a Real-time Fluorescent Quantitative PCR Method for the Detection ofand its application
DING TianBo, LIU XiaoBei, LI Jie, WEI KeKe, CHU Dong
(Key Laboratory of Integrated Crop Pest Management of Shandong Province, College of Plant Health and Medicine, Qingdao Agricultural University, Qingdao 266109, Shandong)
【Objective】The objective of this study is to develop a real-time fluorescent quantitative PCR (RT-qPCR) method to detect the(ToCV) and its concentration in plant and the vector.【Method】Firstly, the special primers ToCVqF/R were designed using Primer 3.0 for RT-qPCR based on the highly conserved region of the minor coat protein (CPm). The primers specificity was evaluated by Primer-BLAST. Secondly, the fragment was amplified using the primers ToCVqF/R by PCR within the ToCV-infected,(TYLCV)-infected, and(TSWV)-infected tomato samples, and cloned into pMDTM18-T Vector. The positive clone was selected and multiplied in LB liquid medium containing ampicillin. Furthermore, the recombinant plasmid was extracted from the clone and served as the ToCV standard. Then, the standard curve was generated for quantitative analysis using the ten-fold dilution of the recombinant plasmid. In addition, the detection sensitivity of RT-qPCR was also evaluated and compared to that of reverse transcription-polymerase chain reaction (RT-PCR). Finally, this method was used to detect and quantify ToCV in eight tomato samples with suspected ToCV infection and singleafter acquiring ToCV for 24 h, according to the amplification curves, melting curves and Ct values.【Result】The purpose strips could be successfully amplified with the primers ToCVqF/R only in the ToCV-infected tomato sample and positive control, which indicated that the primers was highly specific. Additionally, the sequencing result of the fragment was in according with the target gene CPm. The ToCV standard curve showed that the Ct values gradually increased as the concentration of recombinant plasmid decreased. Among the concentration range of 2.7×103-2.7×109copies/μL, the standard curve showed a good linear relationship between Ct values and plasmid concentration. The correlation coefficient of the standard curve was 0.9911, and the amplification efficiency was 100%. The Straight-line equation is=-3.32×lg+40.06 (andrepresent the Ct value and plasmid concentration, respectively). The sensitivity of RT-qPCR was 100 times higher than regular RT-PCR. The minimum detectable concentration of ToCV plasmid standard in RT-qPCR assay is 2.7×103copies/μL, while that in RT-PCR assay is 2.7×105copies/μL. This method could successfully detect the ToCV within tomato samples, and the result was consistent with RT-PCR assay. Six of eight tomato samples were infected by ToCV, the viral titers of which were 2.48×105, 2.21×105, 7.97×104, 3.74×107, 3.37×107and 2.78×106copies/μL, respectively. After 24 h feeding on ToCV infected tomato plants, 100% of theacquired this virus successfully, and the virus concentration in single whitefly ranged from 6.46×102to 2.55×104copies/μL.【Conclusion】The RT-qPCR method is applicable for accurate and sensitive detection of ToCV both in plants and vector insects, which will provide a technical support for the monitoring and early warning of this virus.
(ToCV); real-time fluorescent quantitative PCR (RT-qPCR);; detection
10.3864/j.issn.0578-1752.2018.10.020
2017-11-29;
2018-01-25
國家自然科學基金青年科學基金(31501707)、泰山學者建設工程專項經費、山東省農業科學院農業科技創新工程(CXGC2016B11)、 青島農業大學高層次人才科研基金(6631115033)
丁天波,E-mail:tianboding@126.com。通信作者褚棟,Tel:0532-88030319;E-mail:chinachudong@sina.com

