2018年ASCO GI會議結直腸癌診療進展
孫婧 陳曉鋒 顧艷宏
結直腸癌是世界上發病率最高的腫瘤之一,在中國發達城市,其患病率逐年上升。超過50%的結直腸癌患者錯過最佳診治時間,就診時已到III~IV期,5年存活率不及40%[1]。近年來,靶向治療使IV期患者的總生存最長可以達到30個月以上[2],而免疫治療可讓少數患者的生存顯著延長[3],但是絕大多數結直腸癌患者在三線之后仍然面臨缺乏有效藥物治療的狀況,因此結直腸癌的早篩早診和藥物治療一直是研究的熱點。美國臨床腫瘤學會-胃腸道腫瘤研討會(Gastrointestinal cancer symposium of American Society of Clinical Oncology,ASCO GI)是胃腸道腫瘤領域最高水平的世界級學術盛會,其內容引領胃腸道腫瘤的國際學術前沿和最新研究方向。筆者現將2018 ASCO GI結直腸癌研究的主要進展整理如下。
一、結直腸癌的早期篩查
目前,美國FDA批準的腸癌篩查方法主要有:腸鏡、糞便DNA檢測、糞潛血檢測(fecal occult blood test,FOBT)、血液Septing9甲基化檢測和常規血液癌胚抗原(carcinoembryonic antigen,CEA)指標[4]。FOBT對癌前病變的特異性和敏感性很低;血液Septing9甲基化檢測目前在國內的研究數據仍然有限;CEA特異性較強,但假陰性率較高,部分患者容易漏診;糞便DNA檢測可以有效的檢出腺瘤和早期腸癌,而且因為無創無痛,簡便快捷,越來越被廣大人群接受,但在國內還需要進一步擴大樣本進行臨床驗證;結腸鏡前期準備繁瑣,侵入性強,易受操作者操作技術和臨床經驗的主觀影響,但毫無疑問,它仍是腸癌早篩最被公認的方法;外周血循環腫瘤細胞(circulating tumor cell,CTC)檢查采血方便,大眾接受度高,有很大的前景成為未來的檢測手段[5]。本次會議,由來自臺灣的Tsai教授介紹了其團隊采用血液中循環腫瘤細胞檢測早期CRC的一項前瞻性臨床研究。
該研究納入620例受試者,其中438例患有腺瘤、息肉或I~IV期CRC,182例為健康對照者。使用CellMax仿生平臺(CMx)處理常規抽血收集的2 ml外周血,檢測并計數CTC,采用多因素分析評估CMx的臨床表現特點。在所有受試者中,CMx檢出的敏感性為84.0%,特異性為97.3%。在438例患者中,111例(25%)為癌前病變,327例(75%)為CRC,CMx檢出癌前病變的敏感性為76.6%,特異性為97.3%;檢出腫瘤的敏感性為86.9%,特異性為97.3%。CMx檢出癌前病變和各階段腸癌的總準確率達88%。該檢測手段與傳統的糞便潛血試驗(FOBT)和結腸鏡檢查相比,具有其獨特的優勢。但是,此項技術的應用仍然存在很多問題,比如陽性結果仍需腸鏡確認,CTC檢測的適合間隔時間,CTC檢測陽性而腸鏡檢測陰性的患者如何隨訪等問題仍需進一步探索。
筆者認為,在腸癌早篩領域,對具有高危因素并且恐懼腸鏡檢查的患者,未來液體活檢聯合糞便DNA檢測,陽性者再進行腸鏡的確認,應該是比較合理的選擇。當然,我們還需要進一步的數據進行臨床驗證。
二、結直腸息肉的隨訪監測
結腸息肉是指結直腸黏膜突向腸腔的息肉樣病變,屬于起源于上皮組織的非黏膜下腫瘤性隆起。其分類方法有很多,按組織學分類可分為腫瘤性息肉和非腫瘤性息肉[6]。腫瘤性息肉又可分為腺瘤性和非腺瘤性息肉,腺瘤性息肉又包括管狀腺瘤、管狀絨毛狀腺瘤、絨毛狀腺瘤等;非腺瘤性息肉又可分為類癌、脂肪瘤、平滑肌瘤等。非腫瘤性息肉又可分為反應性、錯構瘤性等。如果腸鏡篩查發現了息肉,通常是根據息肉的病理類型、大小和數目來決定后續的篩查方案[7]。如果息肉病理為高級別不典型增生,有絨毛狀成分,腺瘤大于等于1 cm或數目大于3個即為高危人群,建議3年后復查,其他低危可以5~10年后復查。正如所有的臨床指南一樣,僅依靠簡單的病理和大體分型,部分高危患者會發生脫漏。今年來自西班牙的Oscar Murcia報告了一項“結腸息肉的遺傳特性與異時性進展病變風險”的研究。
該研究納入了2007年至2009年間308例結腸息肉患者,并隨訪至2014年。通過RT-PCR和DNA測序的方法進行突變檢測,并用MS-MLPA的方法對CpG島高甲基化(CpG island methylaton phenotype,CIMP)程度進行檢測。研究定義的復發概念為:后續出現的息肉直徑>9 mm,高度不典型增生或有絨毛成分存在的息肉病灶。共分析收集的995個息肉,首次發現息肉中有21%為CIMP-H,而KRAS和BRAF突變的比例分別為25%和17%。單因素分析發現息肉存在KRAS突變的患者復發風險更高(P=0.01);同樣,息肉存在CIMP-H的患者復發風險也較高(P=0.006)。但Logistics回歸顯示,CIMP-H是息肉高復發風險的獨立因素。從復發的時間間隔來看,KRAS突變和CIMP-H患者的復發間隔時間均較短,但是,如前一樣,多因素分析證實,CIMP-H才是獨立遺傳因素。因此,研究認為,CIMP-H的存在是息肉復發風險增加和復發間隔縮短的獨立遺傳特性,建議在腸鏡篩查后進行息肉CIMP-H檢測,從而篩選出短期內高復發風險的患者。
該研究啟發我們可以充分應用分子生物學手段,按息肉分子特征繼續細化分型,有可能進一步篩選出高危患者。在臨床工作中,我們不僅僅要關注息肉的形態學特征,腫瘤內外科及病理科醫生還需重視進行遺傳特性方面的檢測,因為息肉的分子特征也可能是一個考量腸鏡復查間隔的重要因素。當然,該研究僅有的CIMP-H單一遺傳特性在復發風險的預測上仍然比較有限,而且這個回顧性研究的樣本量不夠多,但是它提示我們,應充分利用腫瘤分子生物學研究方法和手段,尋找更多有價值的可疑基因和更準確的預測模型。后續的研究可以擴大樣本量,擴大檢測范圍,以明確CIMP-H的預測價值,和繼續發現有價值的檢測標志物。
三、結直腸癌的免疫治療
目前腫瘤免疫治療被認為是繼手術、化療、放療三大常規治療模式外的第四種治療手段。特別是隨著免疫檢查點單抗與轉基因CAR-T細胞治療技術的崛起,免疫治療的療效逐漸獲得肯定,甚至被醫學界認為是腫瘤治療領域最具前景及最有可能治愈癌癥的方向。其中免疫檢查點單抗包括PD-1抑制劑,PD-L1抑制劑,CTLA4抑制劑等[8]。這些免疫檢查點抑制劑的優勢人群在不同的實體腫瘤中不盡相同。如在非小細胞肺癌中,PD-L1大于50%的患者對PD-1和PD-L1抑制劑療效較好[9],而在結直腸癌中,僅有少數微衛星高度不穩定(microsatellite instability-high,MSI-H)的患者可以從PD-1抑制劑獲益[10]。2015年8月FDA批準PD-L1抑制劑用于治療PD-L1陽性的轉移性膀胱癌,同年11月又批準了PD-1抑制劑治療晚期(轉移性)腎細胞癌。而2017年FDA已批準所有實體腫瘤只要存在微衛星不穩定性均可使用PD-1抑制劑。目前國內外的研究聚焦于免疫治療聯合其他治療的應用,比如免疫治療聯合靶向治療/化療藥物,或是兩種免疫治療藥物的聯合[11]。
Checkmate-142是一項旨在探索免疫治療藥物nivolumab單藥及nivolumab與ipilimumab聯用在dMMR/MSI-H轉移性結直腸癌的療效與安全性的研究。共分成3個不同治療組進行研究:(1)nivolumab 3 mg/kg單 藥 組;(2)nivolumab 3 mg/kg+ipilimumab 1 mg/kg聯合組;(3)nivolumab 1 mg/kg+ipilimumab 3 mg/kg聯合組。本次會議更新了前兩個治療組的研究結果。nivolumab單藥組按前期治療分成A和B兩組。A組是53例經氟尿嘧啶,奧沙利鉑和伊立替康均治療失敗的患者;B組是21例經一線或二線治療失敗的患者。結果表明nivolumab對dMMR/MSI-H患者是有效的,總體的客觀緩解率(objective response rate,ORR)為34%,B組ORR顯著高于A組(52%vs.26%)。完全緩解率從之前報道的3%上升至9%,整組的中位無進展生存期(progression free survival,PFS)為6.6個月,其中A組為4.2個月,B組尚未達到。整組及各亞組的中位總生存期(overall survival,OS)均未達到。沒有治療相關死亡的發生,整組患者3~4級不良反應發生率為20%,其中A組為25%,明顯高于B組10%。
nivolumab 3 mg/kg+ipilimumab 1 mg/kg聯合組共入組119例患者,76%是經過至少二線治療失敗的mCRC患者,ORR達到55%,疾病控制率(disease control rate,DCR) 達到80%,77%患者有不同程度的腫瘤退縮;中位緩解持續時間(duration of response,DOR),PFS和OS均未達到。2017年9月時,整組患者9個月的PFS率達到76%,9個月OS率達到87%。特別提出的是,BRAF突變患者,ORR也達到了55%。沒有治療相關死亡的發生,但有部分病人出現3~4級不良反應,中斷了治療。
該研究在既往的ASCO會議上報道過,此次內容主要是在隨訪時間延長后,對兩組的療效和安全性進行比較。兩組的DOR和OS均未達到,從這些結果可以初步看出,對晚期結直腸治療而言,如果符合dMMR/MSI-H的標準,相比三線標準推薦的瑞戈非尼,聯合雙藥治療的優勢更加明顯,不出意外,免疫治療可以獲得長期的疾病控制。而在不良反應方面,雙藥聯用組較單藥組多一些,但大多數都在可控制范圍內。這說明nivolumab聯合CTLA-4抑制劑ipilimumab的雙靶向治療,在dMMR/MSI-H的晚期mCRC患者中無論是療效和安全性都得到了證實,尤其中BRAF突變患者中的效果更加令人振奮。
自2015年ASCO會議以來,我們看到了免疫檢查點單抗在晚期結直腸癌患者治療中的前景。當時報道MSI-H的腸癌患者使用PD-1抗體單藥治療有效率就高達60%,本次Checkmate142更新的結果進一步證實了免疫檢查點單抗治療的效果[12]。雖然由于兩組間入組人群的不均衡,進行直接的比較結果會有一些偏差。而且對于免疫治療而言,采用什么樣的標準進行療效評判本身就存在爭議,但是這樣的探索還是非常有意義的。關于免疫治療聯合靶向治療,特別是對于 dMMR/MSI-H優勢人群,是否可以通過聯合治療等方法達到更好的療效?在輔助治療中,如果化療聯合免疫治療,是否可以更有效?已經有一些相關的臨床實驗在開展中,例如A021502研究納入dMMR/MSI-H III 期結腸癌根治術后的患者,比較FOLFOX+atezolizumab對比FOLFOX對患者生存的影響。我們期待這樣的結果盡快出現,從而進一步優化腸癌晚期及輔助治療的策略。而對于接受免疫治療療效不好的患者(即MSS人群)來說,如何才能把他們轉化為可以獲益的人群?這是近年來一系列研究的核心問題,筆者認為這部分人群應該是我們著力重視的,因為畢竟dMMR/MSI-H的人群在腸癌中只占少數。針對MSS的人群,我們需要進一步的探索。目前已經開展的研究包括PD1/PDL1聯合靶向,聯合化療,聯合其他單抗等等都在進行中,如表1所示。
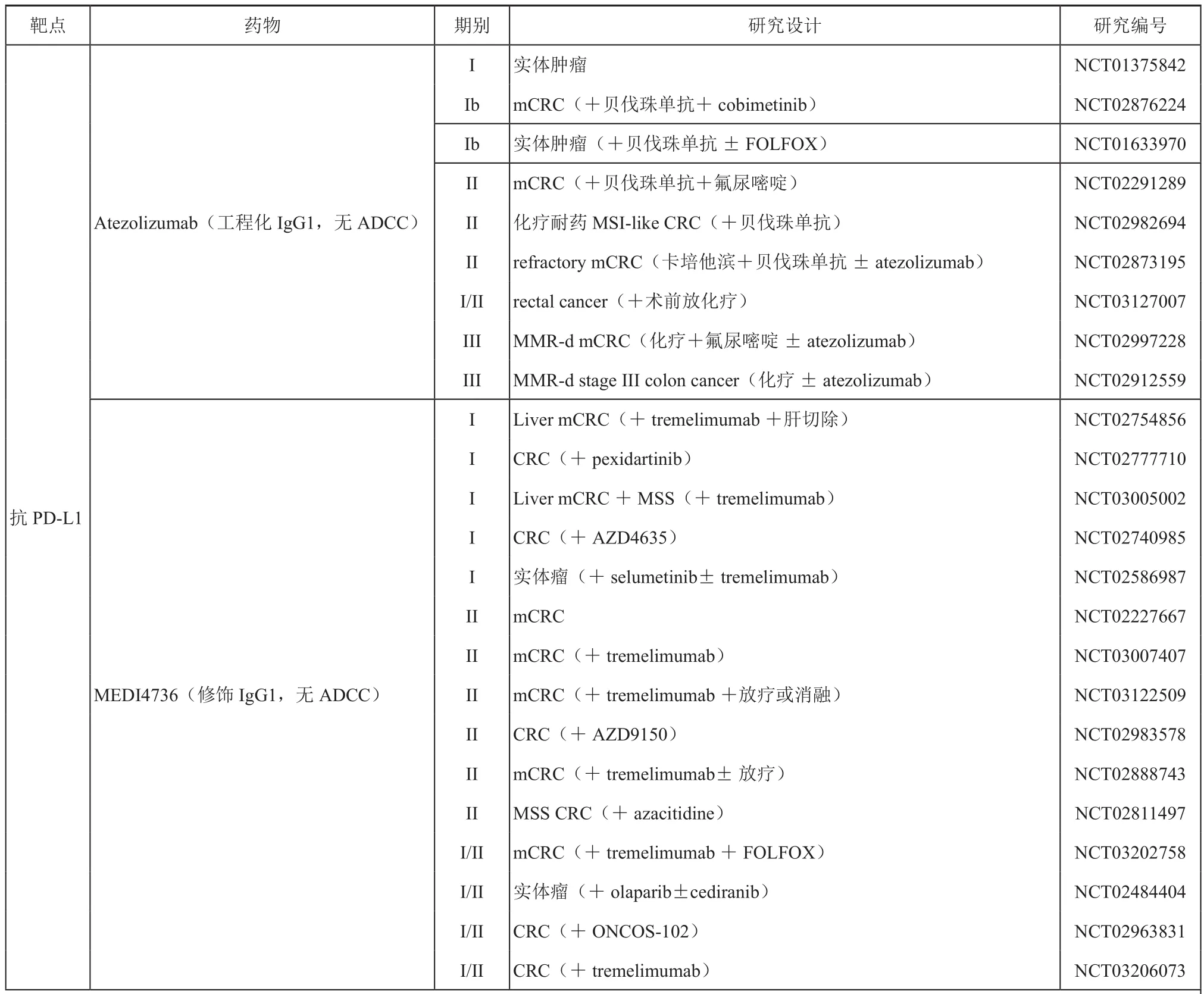
表1 正在進行的涉及結直腸癌免疫治療的研究匯總
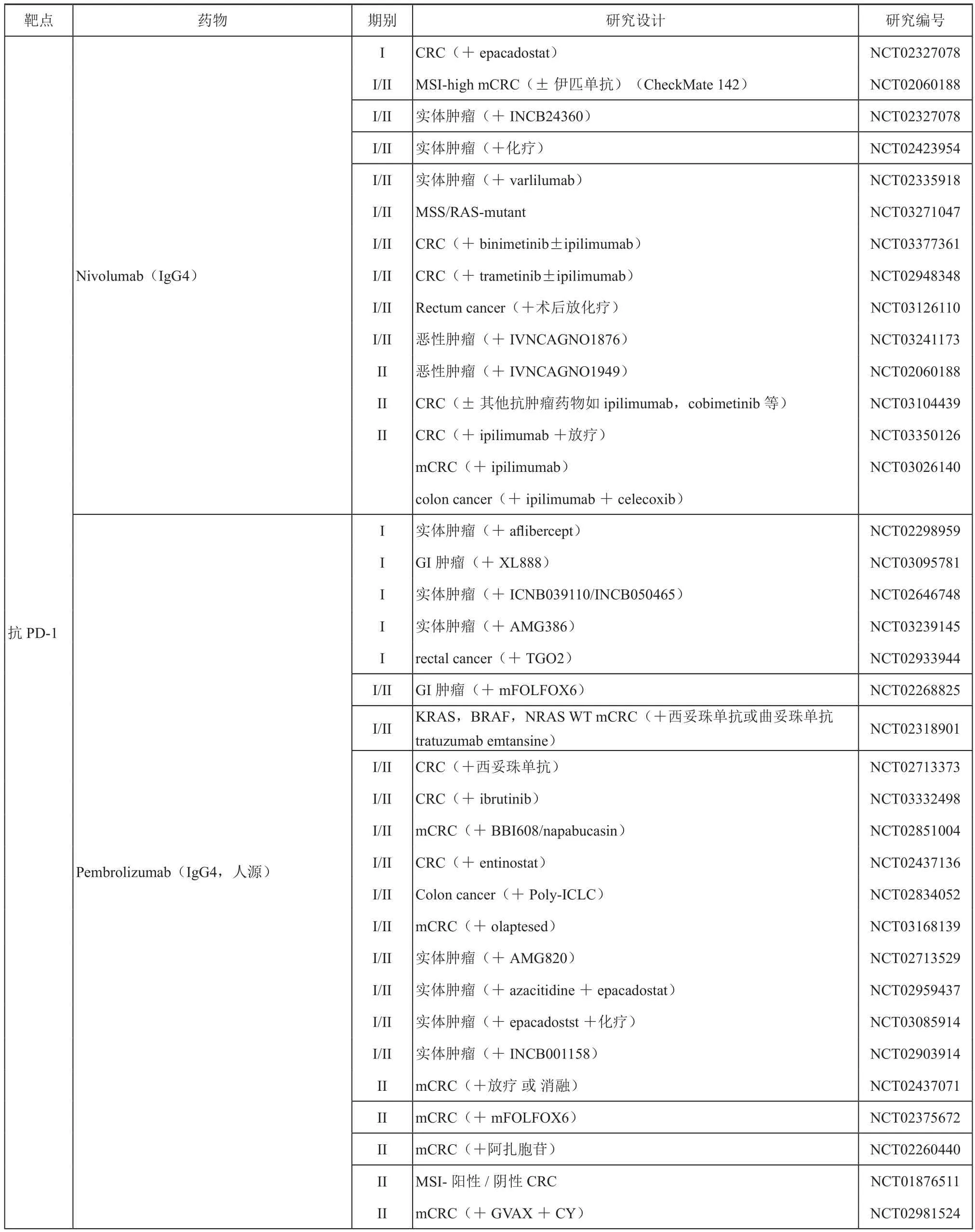
續表
四、結直腸癌的靶向治療進展
本次會議日本的REVERCE研究[13]應該是今年結直腸領域最大的看點,對既往接受過氟尿嘧啶/奧沙利鉑/伊立替康治療失敗的轉移性結直腸癌,瑞戈非尼(R)序貫西妥昔單抗(C)對比相反治療順序的隨機研究。這是第一項比較R和C兩種藥物不同用藥順序治療mCRC的隨機研究。
該研究共納入2013~2016年間的101例患者(R-C組51例:瑞戈非尼序貫西妥昔單抗±伊立替康)(C-R組50例:西妥昔單抗±伊立替康)隨機進行療效分析,兩組的基線特征平衡良好,連續治療到疾病進展或毒性不可耐受,然后交叉到對組。R-C組和C-R組中分別有96%和98%患者既往接受過貝伐珠單抗的治療,兩組中約有86%患者接受了序貫模式治療。中位隨訪29個月后共有81例患者死亡,觀察終點為OS和PFS。R-C組觀察到了73%的終點事件,中位OS期為17.4個月,PFS1(R-C組里的R對比C-R組里C)和PFS2(R-C組里C對比C-R 組里 R)分別是2.4個月和5.2個月;而C-R組則是88%的終點事件,中位OS期為11.6個月,PFS1和PFS2分別是4.2個月和 1.8個月。PFS1的 HR 為 0.97(95%CI,0.61~1.54),PFS2的 HR 為 0.29(95%CI,0.17~0.50)。該研究結果提示,這類患者的最優后線治療模式應該是瑞戈非尼序貫西妥昔單抗。兩組PFS1的時間近似,PFS2顯著改善,也就是后使用西妥昔單抗貢獻的PFS2,可能是OS延長的主要原因。
從研究設計來看,REVERCE研究的主要終點是OS,檢驗的是兩組治療的療效相似性,效力為80%,即預期中位OS為12個月,HR=0.8~1.25;一共需要180例樣本量,觀察到132個終點事件發生。研究隨機分層因素包括隨機時伊立替康的使用意向、既往貝伐珠單抗的使用情況以及研究中心。而事實上由于入組速度太慢,該研究在入組101例后提前關閉,在樣本量不足的情況下,研究結論需要謹慎對待,不過基于該研究顯著的生存差異,仍然值得我們充分的重視。
值得深思的是REVERSE研究的左右半和RAS/BRAF兩個亞組的分析結果。在右半和RAS/BRAF突變患者中,無論是R-C模式還是C-R模式,對OS的影響均不大,這可能和該類患者對EGFR單抗療效不佳相關。而RAS/BRAF雙野生型或左半的患者中,結果仍然支持繼續首先使用抗血管生成治療,不過需要注意的是,這并不是說瑞戈非尼本身給患者帶來多長時間的生存獲益,而是這個順序對西妥昔單抗療效的影響明顯。仔細分析兩組數據會發現,兩組中瑞戈非尼帶來的PFS分別為2.4個月和1.8個月,而西妥昔單抗的PFS則分別為4.2個月和5.2個月。因此,哪怕是在后線治療,藥物使用順序和布局同樣很重要。
結直腸癌治療藥物使用順序的討論由來已久。在化療時代,奧沙利鉑與伊立替康誰先用更好的爭議持續了多年。2005年Grothey教授在JCO上發表綜述分析認為盡可能暴露在三種有效藥物中可能使患者獲得最佳獲益,才基本結束了這一爭論[14]。在抗EGFR單抗和抗VEGF單抗均很強勢的年代,自然也出現了靶向藥物的治療順序之爭,尤其是在2013年至2014年,兩項關于西妥昔單抗和貝伐珠單抗頭對頭比較的研究,FIRE-3[15-16]和CALGB 80405[17]研究將這一爭議推到頂峰。早期研究結果并不一致,FIRE-3研究顯示一線使用西妥昔單抗的OS數據優于一線使用貝伐珠單抗,但CALGB 80405則顯示一線不管使用哪一種單抗,OS均沒有差異。2016年將左右半mCRC與療效進行深入分析,兩個研究終于得出基本一致的結論,在右半mCRC,一線使用貝伐珠單抗療效更優,而在左半mCRC,則推薦首先使用抗EGFR單抗[18]。
我們對一線使用抗EGFR單抗治療的研究進行了薈萃分析,從早期的CRYSTAL,PRIME,到后期的FIRE3,PEAK研究,結果發現隨著二線治療使用抗VEGF單抗的比例增高,患者生存時間越長[19]。而在一線使用抗VEGF單抗的研究中,則未能發現這一趨勢。遺憾的是,這一分析中沒有得到足夠的左右半二線治療的數據,也沒有得到80405研究詳細的二線治療相關的生存數據信息。不過,抗VEGF單抗治療后接著使用抗EGFR單抗不是個好的選擇,還有其他的證據,比如PRODIGE 18[20]和SPIRIT研究[21]均顯示一線使用貝伐珠單抗后二線交叉到抗EGFR單抗不如繼續使用抗VEGF單抗跨線治療。有意思的是,COMETS研究[22]顯示,如果在貝伐珠單抗與EGFR單抗使用之間用細胞毒化療“洗脫”一段時間,則可以得到部分消除,EGFR單抗的療效才能得到更好發揮。
再回到REVERCE研究中來看,先使用西妥昔單抗治療組療效不如使用瑞戈非尼組,一個可能的原因就是絕大多數患者都使用了抗VEGF單抗治療,西妥昔單抗的療效受到了前面貝伐珠單抗的影響。而先使用瑞戈非尼,也可能充當了一個洗脫的作用,讓后續的西妥昔單抗能正常發揮作用,更或者,瑞戈非尼對西妥昔單抗起了增敏的作用,畢竟西妥昔單抗在四線治療的PFS還達到了5.2個月。另一方面,也提示我們,雖然瑞戈非尼具有抗血管生成治療的作用,但它與貝伐珠單抗的作用機制卻并不完全相同,在貝伐珠單抗獲得的經驗,包括貝伐珠單抗與西妥昔單抗之間的順序,在瑞戈非尼與西妥昔單抗之間可能并不適用。
關于目前結直腸癌診療需要探索的還很多,與其他瘤種不同,晚期結直腸癌患者往往身體狀況還不錯,但卻無藥可用。所以新藥的開發,以及轉化治療和免疫治療相關的探索顯得至關重要。另外,從最近的國際會議來看,臨床科學家們對于 “防治”越來越重視,今年ASCO GI四篇口頭摘要就有兩篇關于早篩。這也符合我們“防”大于“治”的理念。
[1]Jeon J, Du M, Schoen RE, et al. Determining Risk of Colorectal Cancer and Starting Age of Screening Based on Life style,Environmental, and Genetic Factors [J]. Gastroenterology, 2018,S0016-5085 (18): 30224-30225.
[2]Qiu T, Chen W, Li P, et al. Subsequent anti-VEGF therapy after firstline anti-EGFRtherapy improved overall survival of patients with metastaticcolorectal cancer [J]. Onco Targets Ther, 2018, 11: 465-471.
[3]Viale G, Trapani D, Curigliano G. Mismatch Repair Deficiency as a Predictive Biomarker for Immunotherapy Efficacy [J]. Biomed Res Int, 2017, 2017: 4719194.
[4]Dekker E, Rex DK. Advances in CRC prevention: screening and surveillance [J]. Gastroenterology, 2018, S0016-5085 (18): 30219-30211.
[5]Khakoo S, Georgiou A, Gerlinger M, et al. Circulating tumour DNA,a promising biomarker for the management of colorectal cancer [J].Crit Rev Oncol Hematol, 2018, 122 :72-82.
[6]Allen JE, Sharma P. Polyp characterization at colonoscopy: Clinical implications [J]. Best Pract Res Clin Gastroenterol, 2017, 31(4):435-440.
[7]Angarita FA, Feinberg AE, Feinberg SM. Management of complex polyps of the colon and rectum [J]. Int J Colorectal Dis, 2018,33(2):115-129.
[8]Li K, Tian H. Development of small-molecule immune checkpoint inhibitors of PD-1/PD-L1 as a new therapeutic strategy for tumour immunotherapy [J]. J Drug Target, 2018:1-13.
[9]Jean F, Tomasini P, Barlesi F. Atezolizumab: feasible second-line therapy for patients with non-small cell lung cancer? A reviewof efficacy, safety and place in therapy [J]. Ther Adv Med Oncol, 2017,9(12): 769-779.
[10]Lemery S, Keegan P, Pazdur R. First FDA Approval Agnostic of Cancer Site - When a Biomarker Defines the Indication [J]. N Engl J Med, 2017, 377(15):1409-1412.
[11]Atkins MB, Plimack ER, Puzanov I, et al. Axitinib in combination with pembrolizumab in patients with advanced renal cell cancer: a non-randomised, open-label, dose-finding, and dose-expansion phase 1b trial [J]. Lancet Oncol, 2018, 19(3): 405-415.
[12]Overman MJ, Lonardi S, Wong KYM, et al. Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer [J]. J Clin Oncol, 2018, 10; 36(8): 773-779.
[13]Kohei Shitara, Kentaro Yamazaki, Hiroyuki Uetake. et al.Randomized phase II study of regorafenib followed by cetuximab versus the reverse sequence for metastatic colorectal cancer patients previously treated with fluoropyrimidine, oxaliplatin, and irinotecan(REVERCE) [J]. J Clin Oncol, 2014, 32:15 suppl, TPS3662-TPS3662.
[14]Grothey A, Sargent D. Overall survival of patients with advanced colorectal cancer correlates with availability of fluorouracil,irinotecan, and oxaliplatin regardless of whether doublet or single-agent therapy is used first line [J]. J Clin Oncol, 2005, 23(36):9441-9442.
[15]Heinemann V, von Weikersthal LF, Decker T, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3):a randomised, open-label, phase 3 trial [J]. Lancet Oncol, 2014,15(10): 1065-1075.
[16]Stintzing S, Modest DP, Rossius L, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab for metastatic colorectal cancer(FIRE-3): a post-hoc analysis of tumour dynamics in the final RAS wild-type subgroup of this randomised open-label phase 3 trial [J].Lancet Oncol, 2016, 17(10): 1426-1434.
[17]Venook AP, Niedzwiecki D, Lenz HJ, et al. Effect of First-Line Chemotherapy Combined With Cetuximab or Bevacizumab on Overall Survival in Patients With KRAS Wild-Type Advanced or Metastatic Colorectal Cancer: A Randomized Clinical Trial [J].JAMA, 2017, 317(23): 2392-2401.
[18]Arnold D, Lueza B, Douillard JY, et al. Prognostic and predictive value of primary tumor side in patients with RAS wild-type metastatic colorectal cancer treated with chemotherapy and EGFR directed antibodies in six randomized trials [J]. Ann Oncol, 2017,28(8):1713-1729.
[19]Qiu T, Chen W, Li P, et al. Subsequent anti-VEGF therapy after first-line anti-EGFR therapy improved overall survival of patients with metastatic colorectal cancer [J]. Onco Targets Ther, 2018,11:465-471.
[20]J. Bennouna S, Hiret C, Borg A, et al. Bevacizumab (Bev) or cetuximab (Cet) plus chemotherapy after progression with bevacizumab plus chemotherapy in patients with wild-type (WT)KRAS metastatic colorectal cancer (mCRC): Final analysis of a French randomized, multicenter, phase II study (PRODIGE 18) [J].Ann Oncol, 2017, 28, suppl_5, abs 4770.
[21]Hecht JR, Cohn A, Dakhil S, et al. SPIRITT: A Randomized,Multicenter, Phase II Study of Panitumumab with FOLFIRI and Bevacizumab with FOLFIRI as Second-Line Treatment in Patients with Unresectable Wild Type KRAS Metastatic Colorectal Cancer [J].Clin Colorectal Cancer, 2015, 14(2): 72-80.
[22]Cascinu S, Rosati G, Nasti G, et al. Treatment sequence with either irinotecan/cetuximab followed by FOLFOX-4 or the reverse strategy in metastatic colorectal cancer patients progressing after first-line FOLFIRI/bevacizumab: An Italian Group for the Study of Gastrointestinal Cancer phase III, randomised trial comparing two sequences of therapy in colorectal metastatic patients [J]. Eur J Cancer, 2017, 83:106-115.

