Lynch綜合征相關結直腸癌的遺傳基因及分子病理篩查策略
王雯邈 董林 李文斌 鄒霜梅 呂寧
一、前言
Lynch 綜合征,舊稱遺傳性非息肉病性結直腸癌(hereditary nonpolyposis colorectal cancer,HNPCC),是一種常染色體顯性遺傳綜合征。正常人患結直腸癌的風險是5~6%,而Lynch綜合征人群則升高至70~80%,占所有大腸癌的2~3%[1]。此外,該綜合征同時增加了罹患胃、子宮內膜和卵巢惡性腫瘤的風險,而泌尿系、肝膽道及胰腺惡性腫瘤風險則相對較低。因此,提高Lynch綜合征的篩檢率,進而加強對該類人群的監測和隨訪可有效降低結直腸癌的發病率及死亡率。
二、遺傳學基礎
Lynch綜合征是由于編碼錯配修復基因(mismatch repair,MMR)的種系突變、失活導致的遺傳性疾病[1]。現已闡明,人類MMR基因編碼的錯配修復蛋白可相互作用形成一種多聚復合物,參與細胞錯配修復反應。錯配修復反應既可以修復DNA復制過程中出現的堿基錯配,可以消除由于含簡單重復序列的同源序列之間的遺傳重組出現的不配對堿基序列,這樣可有效防止DNA復制差錯的發生,MMR系統在識別和修復DNA復制過程中出現的錯配堿基,維持細胞DNA中微衛星乃至整個基因組的穩定方面發揮重要作用。MMR基因在人類多達12個,但目前已知與Lynch綜合征的發生明確有關的有4個,分別是MSH2,MLH1,MSH6 和 PMS2[2]。其中 70~85% 的 Lynch綜合征與MLH1或MSH2的突變有關,其產生的腫瘤大多為結直腸癌,而MSH6突變約占14%,其突變者中子宮內膜癌的患病率明顯高于其他基因突變者[3-4]。
此外,作為錯配修復系統的一部分,MLH3和Exo140與Lynch綜合征的相關性研究進展仍然值得期待[5]。
微衛星是由2~6個核苷酸組成的具有高度多態性的簡單串聯重復序列,在不同個體間各不相同,而在同一個體的不同組織中保持一致。微衛星廣泛分布于整個基因組序列中,常見的有核苷酸重復序列,尤以二核苷酸的重復序列最為常見。微衛星不穩定性(microsatellite instability,MSI)是指微衛星序列中重復單位的增加或減少,是發生在核苷酸水平的不穩定現象[1]。大量研究表明,MMR系統功能缺失可導致MSI顯著增加,從而導致腫瘤的發生。Lynch綜合征的患者出生時已攜帶一個MMR等位基因突變(通常稱為雜合性突變),當其另一個遺傳自健康親代等位基因受到點突變、雜合性缺失或甲基化等二次打擊時,可以引起錯配修復系統的功能下降,從而使得復制錯誤累積引起MSI,增加細胞自發突變的頻率,進而促進結直腸癌的發生。
大約有12~17%的結腸癌可檢測到微衛星不穩定(因檢測方式不同,比例有所異)[6],其中約27.1%的微衛星不穩定是由MMR種系突變所致,即Lynch綜合征;而大部分具有微衛星不穩定的結腸癌則為散發的[7]。主要原因是在散發的結直腸癌中MLH1上游啟動子甲基化引起MLH1基因沉默,MMR蛋白功能受損,進而導致微衛星不穩定。
三、臨床病理特點
Lynch綜合征的患者具有以下臨床特點:(1)發病年齡早,對于MLH1和MSH2突變攜帶者,結直腸癌的中位發病年齡為45歲;(2)好發于右半結腸,約占70.9%;(3)第二原發結直腸癌的發病率高,其中同時性占18.1%,異時性約占24.2%,其發病率還與原發病灶手術切除范圍相關[8-9]。因此,提高Lynch綜合征的診斷率,加強高危人群的篩查尤為重要。
四、診斷流程及常用實驗室方法
自從1991年HNPCC國際合作組織(HNPCCICG)制定了Amesterdam標準以來,Lynch綜合征的臨床診斷標準歷經數次變革。目前常用的臨床標準有Amesterdam II和改良的Bethesda指南[10](圖1)用于在臨床中選擇進行MSI檢測的患者。但二者均難以兼具敏感性及特異性:前者的特異性較高,敏感性低;后者反之。

圖1 改良版Bethesda標準
近期一項針對4項大型結直腸癌家系人群研究的數據分析顯示,廣泛的MMR篩查對于Lynch綜合征的診斷敏感性為100%,優于Bethesda標準的87.8%的敏感性[7]。因此,利用分子遺傳學檢測在MMR基因中發現致病性胚系突變仍為目前Lynch綜合征的診斷的金標準。NCCN指南已明確指出,對于發病年齡小于70歲的或雖大于70歲但滿足改良Bethesda標準的所有結直腸癌患者在術后選擇輔助化療前均需進行Lynch綜合征的篩查,流程見圖2。
對于MSI的檢測可采用兩種途徑。一種是免疫組化的方法觀察4種MMR蛋白在細胞核和臨近腫瘤組織中的表達情況。若4個蛋白均表達,說明該患者為錯配修復功能完整(pMMR);若其中任一陰性表達,則判斷為錯配修復功能缺陷(dMMR)。另一種是通過PCR的方法擴增微衛星位點,常用檢測位點是美國NCI專家推薦的5個標準位點:BAT26、BAT25、D2S123、D5S346 和 D17S250。比較正常組織和腫瘤組織,如果兩個以上位點存在MSI則認為該患者高度微衛星不穩定(MSI-H),即dMMR,小于2個位點MSI或無一位點存在MSI者被認定為低度微衛星不穩定(MSI-L)或微衛星穩定(MSS),即pMMR。此方法之后又經過不斷完善,目前認為兩種方法是等效的,一致性高達97.8[11]。免疫組化的好處在于其結果可直接指導對應基因的突變檢測,因為某個蛋白的丟失往往意味著其基因水平的缺陷。
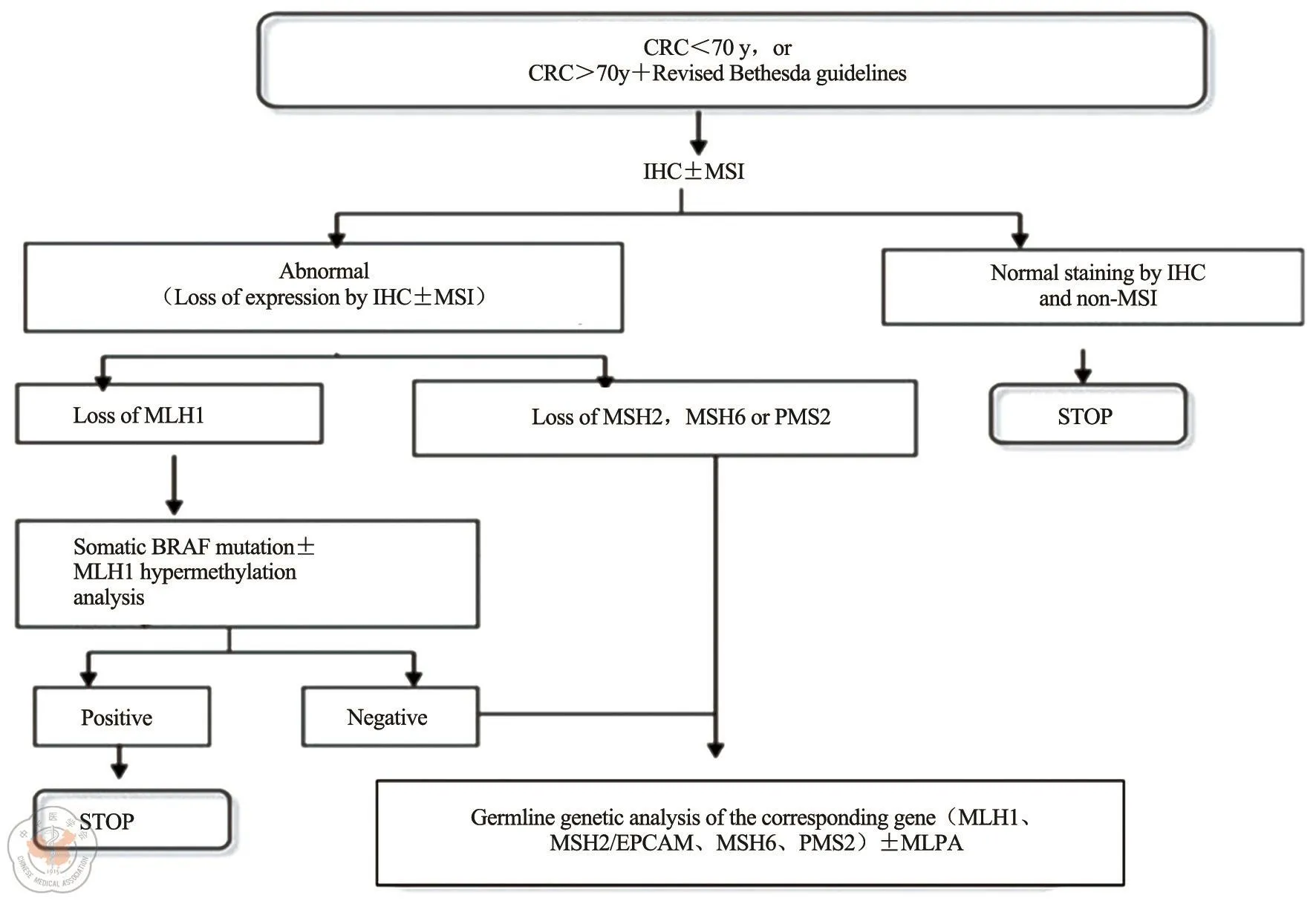
圖2 篩查流程
由于部分散發性結直腸癌可因MLH1啟動子區域的甲基化而表現為MLH1表達缺失,且這部分患者常伴隨BRAF(通常為V600E)突變,而在Lynch綜合征的患者中則無此突變[12]。因此,在觀察到MLH1/PMS2表達缺失時,首先需完善BRAF V600E體細胞突變或MLH1啟動子甲基化的檢測,以除外散發性結直腸癌。
長久以來,BRAF突變的檢測主要依賴于測序的方法,包括Sanger 一代測序、焦磷酸鹽測序以及質譜分析等方法。Capper D等[13]于2011年報道了一個可用免疫組化手段檢測的BRAF V600E突變情況新型特異性抗體VE1,但在結直腸癌的檢測中,該抗體一度因與Sanger等其他基因檢測結果的一致性較低而備受爭議。目前學界普遍認為,造成IHC在結直腸癌中檢測的準確率低下的主要原因之一在于研究者過于寬松的陽性標準。研究發現,當把BRAF IHC染色中——強陽定義為陽性結果時,VE1抗體的敏感性和特異性分別為85%和68%。若將任何強度的染色陽性定義為陽性結果,則特異性會降至51%,而敏感性卻沒有提升。因此建議僅將VE1抗體染色強陽性的標本定義為陽性病例[14]。Vakiani E等對117例結直腸癌標本的BRAF V600E突變情況進行了檢測,研究將>80%的腫瘤細胞染色彌漫陽性定義為IHC陽性病例,結果發現,IHC方法與測序一致性較高,敏感性93.7%,特異性95.6%[15]。高度提示應用IHC的方法對Lynch綜合征進行篩選,除外MLH1啟動子甲基化的散發性患者的可行性。
根據最新的篩查指南,MLH1表達缺失的患者除BRAF V600E突變檢測外,可選擇性進行MLH1啟動子區域的甲基化的檢測。目前應用較多的是第二代甲基化特異性的PCR 法(methylation-specific PCR,MS-PCR)和特異性甲基化多重連接依賴的探針擴增(methylation specific-multiplex probe amplification,MS-MLPA)。二者優點在于所需DNA總量較小,適用于微切割的石蠟組織,臨床應用較多;而甲基熒光技術Methy Light盡管是甲基化檢測的金標準,但所需技術水平較高。Pérez-Carbonell L等利用上述兩平臺對73例MLH-1表達缺失的結腸癌的MLH1甲基化水平進行檢測,結果發現二者的一致性達92%,可分別使67%和64%的患者免于進行MLH1胚系突變檢測[16]。只有對BRAF V600E突變和(或)MLH1啟動子甲基化檢測陰性的MLH1失表達的結直腸癌患者,考慮Lynch綜合征可能性大。此時需進行最終的胚系突變檢測。既往對于MSH2、MSH6或PMS2表達缺失者,可直接進行相關基因的胚系突變檢測以確診Lynch綜合征。近年研究發現,位于2號染色體臨近MSH2的EPCAM基因(又稱TACSTD 1)的3`區域的常見缺失,可引起MSH2基因體細胞高甲基化,而繼發于EPCAM基因突變的腫瘤表現為MSH2和(或)MSH6的表達缺失,但胚系突變檢測陰性,提示EPCAM基因的胚系突變是除4個已知MMR基因外造成Lynch綜合征的重要原因[17]。據估計,高達30% MSH2免疫組化檢測陰性的結直腸癌存在EPCAM基因的胚系突變。而這部分患者占全部Lynch綜合征的6%[18]。因此,目前推薦對于MSH2/MSH6免疫組化陰性的患者首先進行MSH2基因的胚系突變檢測,陰性者再依次進行EPCAM及MSH6的突變檢測。
目前常用的有1、2代測序兩種方法,相比于Sanger一代測序技術,二代測序(next generation sequencing,NGS)采用不同顏色的熒光標記四種不同的dNTP,當DNA聚合酶合成互補鏈時,每添加一種dNTP就會釋放出不同的熒光,根據捕捉的熒光信號并經過特定的計算機軟件處理,從而獲得待測DNA的序列信息。與一代相比,二代測序方法更加高效、便捷,而且大大降低了成本,成為目前主要檢測手段。但由于其讀長相對較低的局限性,尚無法撼動Sanger一代測序的金標準地位。由于大片段缺失和重排占已知突變的20%,因此,對于MMR相關的胚系突變檢測需包括DNA測序及大片段缺失和重排的檢測[19]。而多重連接依賴的探針擴增(multiplex ligation-dependent probe amplification,MLPA)方法是國際上通用的檢測大片段缺失的方法,因此,對于NGS檢測陰性者,需進行MLPA檢測。
二代測序結果發現突變的患者,我們利用LOVD 數 據 庫(http://chromium.lovd.nl/LOVD2/colon_cancer/variants.php)和NCBI Clinvar數據庫(http://www.ncbi.nlm.nih.gov/clinvar/)進行基因突變致病性判讀。判讀結果分為5類:致病突變、疑似致病突變、臨床意義未明突變、疑似非致病突變、非致病突變。對于陽性結果需進一步采用Sanger測序進行驗證。但是目前參考的數據來源大多為歐美人種的研究結果,而越來越多的研究顯示中國Lynch綜合征的人群在發病特點和突變基因的分布上與歐美人種存在差異。國外研究一致顯示子宮內膜癌是發病率最高的腸外腫瘤,累計終身患病風險在15~71%[20],而國內以胃癌最為常見,且不斷有基于中國人群的研究發現新的MLH1、MSH2、MSH6突變位點[21]。以上均提示Lynch綜合征作為一種遺傳性疾病,其致病基因譜在人種間的差異,進一步說明在國內積極開展Lynch綜合征的篩查,建立中國人群Lynch綜合征相關數據庫的必要性。
五、累計風險及長期隨訪
經過上述檢測確診Lynch綜合征的患者,意味著終身患癌風險的顯著增加。目前對于藥物降低腫瘤風險的證據不足。僅CAPP-2一項隨機對照研究顯示,相比于安慰劑對照組,長于兩年每日口服600 mg 阿司匹林的患者結直腸癌及Lynch相關腫瘤的發生率降低且有統計學意義[22]。但長期高劑量的阿司匹林的副作用堪憂,目前尚不作為常規推薦應用。而一項前瞻性的研究顯示,嚴格的隨訪和監測可顯著降低結直腸癌的發病率和死亡率[23]。因此,2015年的NCCN/ASCO/ESMO等Lynch綜合征的相關指南均建議對于MLH1/MSH2/EPCAM突變的患者,自20~25歲開始每1~2年進行結腸鏡檢查,若家族中先證者于25歲前發病,則隨診時間提前至發病年齡前的2~5年開始。不同于MLH1突變者早發、高發結直腸癌的特點,MSH6突變的患者子宮內膜癌的發病風險更高;而PMS2突變的患者,結直腸癌及子宮內膜癌的發病風險均相對較低。因此,NCCN指南建議對這部分患者的結腸鏡檢查可開始于25~30歲,若先證者發病年齡早于30歲,則于發病年齡前2~5年開始結腸鏡篩查,每1~2年一次。鑒于Lynch綜合征的患者同時增加了罹患腸外腫瘤的風險(中樞神經系統1.2%~3.7%,胰腺4%)[24],對于該部分患者的篩查還需包括腸外器官的監測和隨訪。目前NCCN明確推薦,對于已生育女性,選擇性口服避孕藥或預防性雙側輸卵管切除以預防子宮內膜癌及卵巢癌的風險;同時明確非功能性子宮出血需及時檢查。但尚無證據顯示定期的B超、CA125檢測及子功內膜活檢有助于降低子宮內膜癌及卵巢癌的風險,僅作為臨床醫生選擇性應用。此外,指南還建議自25~30歲開始,考慮每年行尿常規檢查以降低尿路上皮癌的發生。而對于胃、小腸、胰腺、乳腺以及中樞神經系統,盡管有研究顯示上述器官的發病風險有所增加,但尚無明確的證據顯示定期的監測隨訪有助于發病率的降低[25]。
綜上,Lynch綜合征作為結直腸癌中最常見的一類遺傳性腫瘤綜合征,發病率相對較高,且具有發病年齡早、易發生腸外及第二腫瘤的特點。現有的臨床診斷標準難以兼具敏感性及特異性。因此,臨床中對于結直腸癌患者應積極選取以分子病理及遺傳基因為基礎的檢測手段,對Lynch綜合征的患者及其家系進行篩查,并對陽性患者進行科學的監測、隨訪以降低該病的發病率及死亡率。
[1]Boland CR. Evolution of the nomenclature for the hereditary colorectal cancer syndromes [J]. Fam Cancer, 2005, 4(3): 211-218.
[2]Peltomaki P. Lynch syndrome genes [J]. Fam Cancer, 2005, 4(3):227-232.
[3]Baglietto L, Lindor NM, Dowty JG, et al. Risks of Lunch syndrome cancers for MSH6 mutation carriers [J]. J Natl Cancer Inst, 2010,102(3): 193-201.
[4]Goodenberger M, Lindor NM. Lynch syndrome and MYH associated polyposis: review and testing strategy [J]. J Clin Gastroenterol, 2011,45(6): 488-500.
[5]Lipkin SM, Wang V, Jacoby R, et al. MLH3, a DNA mismatch repair gene associated with mammalian microsatellite instability [J]. Nat Genet, 2000, 24(1): 27-35.
[6]Goodfellow PJ, Billingsley CC, Lankes HA, et al. Combined Microsatellite Instability, MLH1 Methylation Analysis, and Immunohistochemistry for Lynch Syndrome Screening in Endometrial Cancers From GOG210: An NRG Oncology and Gynecologic Oncology Group Study [J]. J Clin Oncol, 2015, 33(36):4301-4308.
[7]Moreira L, Balaguer F, Lindor N et al . Identification of Lynch syndrome among patients with colorectal cancer [J]. JAMA, 2012,308(15): 1555-1565.
[8]Lynch HT, de la Chapelle A. Hereditary colorectal cancer [J]. N Engl J Med, 2003, 348(10): 919-932.
[9]M?ller P, Sepp?l? T, Bernstein I, et al. Incidence of and survival after subsequent cancers in carriers of pathogenic MMR variants with previous cancer: a report from the prospective Lynch syndrome database [J]. Gut, 2017 , 66(9): 1657-1664.
[10]Umar A, Boland CR, Terdiman JP, et al. Revised Bethesda Guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability [J]. J Natl Cancer Inst ,2004, 96(4): 261-268.
[11]Bartley AN, Luthra R, Saraiya DS, et al.Identification of cancer patients with Lynch syndrome: clinically significant discordances and problems in tissue-based mismatch repair testing [J]. Cancer Prev Res (Phila) , 2012, 5(2): 320-327.
[12]Parsons MT, Buchanan DD, Thompson B, et al. Correlation of tumour BRAF mutations and MLH1 methylation with germline mismatch repair (MMR) gene mutation status: a literature review assessing utility of tumour features for MMR variant classification [J].J Med Genet, 2012, 49(3): 151-157.
[13]Capper D, Preusser M, Habel A, et al. Assessment of BRAF V600E mutation status by immunohistochemistry with a mutation-specific monoclonal antibody [J]. Acta Neuropathol, 2011, 122(1): 11-19.
[14]Lasota J, Kowalik A, Wasag B, et al. Detection of the BRAF V600E mutation in colon carcinoma: critical evaluation of the imunohistochemical approach [J]. Am J Surg Pathol, 2014, 38(9):1235-1241.
[15]VakianiE, YaegerR, BrookeS, et al. Immunohistochemical detection of the BRAF V600E mutant protein in colorectal neoplasms [J].Appl Immunohistochem mol Morphol, 2015, 23(6): 438-443.
[16]Pérez-Carbonell L, Alenda C, Payá A, et al. Methylation analysis of MLH1 improves the selection of patients for genetic testing in Lynchsyndrome [J]. J Mol Diagn, 2010, 12(4): 498-504.
[17]Ligtenberg MJ, Kuiper RP, Chan TL, et al. Heritable somatic methylation and inactivation of MSH2 in families with Lynch syndrome due to deletion of the 3’ exons of TACSTD1 [J]. Nat Genet, 2009, 41(1): 112-117.
[18]Niessen RC, Hofstra RM, Westers H, et al. Germline hypermethylation of MLH1 and EPCAM deletions are a frequent cause of Lynch syndrome [J]. Genes Chromosomes Cancer, 2009,48(8): 737-744.
[19]Hampel H. Genetic testing for hereditary colorectal cancer [J]. Surg Oncol Clin N Am, 2009, 18(4): 687-703.
[20]Bonadona V, Bona?ti B, Olschwang S, et al. Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome [J]. JAMA, 2011, 305(22): 2304.
[21]Zhang YZ, Sheng JQ, Li SR, et al. Clinical phenotype and prevalence of hereditary nonpolyposis colorectal cancer syndrome in Chinese population [J]. World J Gastroenterol, 2005, 11(10):1481-1488.
[22]Burn J, Bishop DT, Mecklin JP, et al.Effect of aspirin or resistant starch on colorectal neoplasia in the Lynch syndrome [J]. N Engl J Med, 2008, 359 (24): 2567-2578.
[23]J?rvinen HJ, Aarnio M, Mustonen H, et al.Controlled 15-year trial on screening for colorectal cancer in families with hereditary nonpolyposis colorectal cancer [J]. Gastroenterology, 2000, 118(5):829-834.
[24]Engel C, Loeffler M, Steinke V, et al. Risks of less common cancers in proven mutation carriers with lynch syndrome [J]. J Clin Oncol,2012, 30(35): 4409-4415.
[25]Provenzale D, Gupta S, Ahnen DJ, et al.Genetic/Familial High-Risk Assessment: Colorectal Version 1.2016, NCCN Clinical Practice Guidelines in Oncology [J]. J Natl Compr Canc Netw, 2016, 14(8):1010-1030.

