糖尿病大鼠尿道舒張功能觀察及尿道組織NGF、p75NTR表達變化
張冰,紀洪,張兆存,陳守臻,史本康(濱州醫學院附屬醫院,山東濱州56600;山東大學齊魯醫院)
糖尿病是嚴重威脅著人類健康的常見疾病,糖尿病神經源性膀胱尿道功能障礙(NVUDD)是糖尿病引起的泌尿系統并發癥,40%~85%的糖尿病患者可并發此癥[1]。除了因糖尿病引發的膀胱逼尿肌收縮無力之外,可能存在糖尿病引發的尿道舒張機制的異常,從而加劇了NVUDD病變進程。神經生長因子(NGF)是一種多肽物質,是維持周圍神經正常功能的重要的細胞因子,在因各種疾病導致的神經系統變性與修復過程中起重要作用[2]。研究發現,NGF在糖尿病膀胱病變中起重要作用[3]。p75神經營養素受體(p75NTR)是NGF受體,能介導施旺細胞對神經生長因子的功能性反應,在人類及大鼠膀胱中存在陽性表達[4,5]。研究發現,p75NTR在糖尿病感覺神經病變乃至尿道病變的發病機理中起重要作用[6]。2014年7~12月,我們觀察了糖尿病模型大鼠的尿道舒張功能障礙情況,探討NGF及其受體p75NTR在糖尿病尿道舒張功能病變中的作用。
1 材料與方法
1.1 實驗動物及分組 健康成年雌性SPF級Wistar大鼠24只(體質量250~300 g),由上海斯萊克實驗動物有限責任公司提供,均飼養于山東大學實驗動物中心SPF實驗室。大鼠隨機分為2組,對照組、糖尿病組各12只。
1.2 糖尿病大鼠模型制備 糖尿病組大鼠按65 mg/kg(溶解在0.1 mol/L枸櫞酸緩沖液中,pH 4.5)單劑量腹腔注射鏈脲佐菌素(STZ)制備糖尿病模型,對照組大鼠腹腔注射等量枸櫞酸緩沖液。48~72 h后尾靜脈采血,用血糖儀測定全血血糖。以血糖≥300 mg/dL為糖尿病模型建立。
1.3 尿道壓(UPP)、等容膀胱壓檢測 造模8周后,經頸靜脈插管注射烏拉坦麻醉;腹部正中切口,清理降結腸內污物,于降結腸近心端行松解結扎術;切斷雙側輸尿管,使輸尿管遠端表面化。于膀胱頂部插入膀胱導尿管和雙腔尿道導管(后者包括尿道內的PE-50管子用于UPP測定,PE-160管子用于注入生理鹽水),用于導管尖端的錐形塞子被置于膀胱頸。逐層關閉腹腔。使用生理鹽水通過尿道導管的外腔,以0.075 mL/min的速度注入尿道,通過尿道導管的內腔記錄UPP。逐漸注入生理鹽水,直至誘導出等容膀胱節律收縮并記錄。于恥骨聯合高度放置壓力傳感器,使用POWERLAB進行數據采集。在穩定的膀胱基礎活性的條件下(≥30 min),對UPP基線值、UPP最低值及誘發尿道舒張的膀胱壓閾值進行檢測。
1.4 大鼠尿道組織NGF、p75NTR mRNA檢測 UPP及等容膀胱壓檢測后,斷頸處死大鼠,完整切取尿道組織,采用實時定量RT-PCR法檢測尿道組織NGF、p75NTR mRNA表達。以常規TRIzol 法提取尿道總RNA,用紫外分光光度計在波長260 nm處測量所提取RNA濃度。兩步法試劑盒反轉錄為cDNA,條件為42 ℃ 50 min、85 ℃ 10 min。所用引物由北京奧科生物技術公司負責合成。NGF上游引物5′-AACAGGACTCACAGGAGCAA-3′,下游引物5′-CTTCCTGCTGAGCACACACA-3′;p75NTR上游引物5′-GAGGGCACATACTCAGACGAAGCG-3′,下游引物5′-GTCTATATGTTCAGGCTGGTAACC-3′。
1.5 大鼠尿道組織NGF、p75NTR蛋白檢測 采用Western blotting法。取大鼠尿道組織,常規提取總蛋白,BCA法檢測蛋白濃度;蛋白變性后SDS-PAGE電泳分離,電轉至硝酸纖維素膜;5%脫脂牛奶室溫封閉2 h,分別加入相應的一抗(1∶500)封閉過夜;TBST洗膜3次,加入辣根過氧化物酶標記二抗(1∶4 000羊抗鼠多抗),室溫孵育2 h;常規洗膜3次,化學發光法顯像;用凝膠圖像處理系統分析免疫印跡條帶進行光密度測定,以目的蛋白與Actin光密度比值表示蛋白表達量。
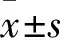
2 結果
2.1 各組UPP及誘發尿道舒張的膀胱壓閾值比較 糖尿病組UPP最低值及誘發尿道舒張的膀胱壓閾值均高于對照組(P<0.01)。兩組UPP基線值差異無統計學意義。見表1。
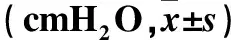
表1 兩組UPP及誘發尿道舒張的膀胱壓閾值比較
注:與對照組比較,*P<0.01。
2.2 各組尿道組織NGF、p75NTR mRNA及蛋白表達比較 糖尿病組尿道組織NGF、p75NTR mRNA及蛋白表達均低于對照組(P均<0.01)。見表2。
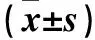
表2 各組尿道組織NGF、p75NTR mRNA及蛋白表達比較
注:與對照組比較,*P<0.01。
3 討論
糖尿病是臨床常見的內分泌疾病,其對膀胱、尿道功能的損傷受到越來越多的關注。目前對NVUDD的研究主要集中在膀胱本身的病變,對尿道病變的研究很少。對于由糖尿病引發的下尿路功能障礙,單純的糖尿病膀胱病變不能完全或很好地解釋。近年研究發現,尿道結構和功能異常在NVUDD發生發展過程中發揮重要作用[7]。Ueda等[8]研究發現,糖尿病可誘發多種神經病變,包括影響感覺神經和自主神經。因此,我們推測糖尿病誘導的多神經病變也可能影響尿道的舒張功能。
尿道肌肉包括尿道平滑肌和尿道橫紋肌。正常儲尿和排尿過程需要膀胱和尿道平滑肌及尿道外括約肌中的橫紋肌之間精確協調,儲尿期尿道處于收縮狀態,抑制尿液排出,而排尿期尿道處于舒張狀態,促進尿液排出。尿道平滑肌是由交感、副交感神經支配,而尿道外括約肌由軀體神經支配,尿道橫紋肌主要是由軀體神經(陰部神經)支配。膀胱和尿道的神經、肌肉相互協調配合,完成正常的儲尿和排尿生理。若神經支配方面受到損害,勢必導致尿道收縮或舒張功能受損。在糖尿病的情況下,尿道的結構和功能發生病變,進而導致NVUDD的發生和發展。有研究證實,糖尿病大鼠尿道的全層厚度、肌層厚度及結締組織區域與肌肉區域的比值均顯著大于正常大鼠[9],說明糖尿病大鼠尿道可能發生了肌肉萎縮以及纖維化。雖然其具體機制尚不明確,但推測糖尿病尿道形態學改變與長期的慢性炎癥密切相關。Yang等[10]通過檢測糖尿病大鼠膀胱等容測壓、尿道灌注壓以及尿道外括約肌肌電圖,發現糖尿病大鼠膀胱逼尿肌與尿道括約肌協同障礙,且尿道括約肌舒張減弱、對NO反應減弱、對α受體激動劑反應增強,這些改變使尿道阻力增加,從而造成排尿障礙。本研究發現,糖尿病組UPP最低點及誘發尿道舒張的膀胱壓閾值均高于對照組,提示糖尿病大鼠膀胱收縮時尿道肌肉舒張功能發生異常。
NGF是一種多肽物質,其作用有以下幾方面:①維持交感神經和感覺神經的生長發育及功能;②誘導軸突發芽、決定軸突的伸長時間,并可穩定神經結構、調節微絲蛋白的合成;③促進細胞分化及創傷愈合;④對神經細胞的凋亡有抑制作用[11]。高血糖狀態下,NGF的表達降低,促進了糖尿病膀胱尿道病變進程[12]。研究發現,糖尿病同樣損傷尿道的去神經化,直接損傷尿道括約肌及平滑肌[13],提示在糖尿病尿道病變過程中同樣可能涉及到NGF作用障礙。p75NTR是NGF的低親和力受體,屬腫瘤壞死因子受體(TNFR)超家族成員,其通過不同的信號轉導通路誘導以神經細胞為主的細胞增殖、遷移、分化、生存、凋亡、突觸的建立和神經的形成,發揮多重生物學效應。p75NTR在神經細胞的早期發育過程中與NGF結合,介導了神經細胞的存活[14]。p75NTR主要在尿道的感覺神經纖維中表達,NGF和p75NTR的結合可誘導神經末梢向神經細胞傳到神經營養信號,對于神經細胞的存活至關重要[15]。如果NGF和p75NTR的表達下調,這種神經營養效應就會顯著的降低,進而引起神經細胞的生長抑制和凋亡。本研究發現,糖尿病組尿道組織NGF、p75NTR mRNA及蛋白表達均低于對照組,提示糖尿病大鼠尿道組織中NGF和p75NTR mRNA及蛋白表達顯著下降,表明高血糖導致了尿道神經細胞中NGF產生的減少和p75NTR表達的下降。
綜上所述,糖尿病引起的尿道舒張功能障礙是NVUDD的重要組成部分,在大鼠尿道組織中NGF和p75NTR的mRNA及蛋白表達顯著下調,從而導致神經營養效應的錯亂,神經細胞的凋亡。這種尿道去神經化是糖尿病尿道功能障礙的重要原因。
:
[1] Ong KL, Cheung BM, Wong LY, et al.Prevalence, treatment, and control of diagnosed diabetes in the US national health and nutrition examination survey 1999-2004[J]. Ann Epidemiol, 2008,18(3):222-229.
[2] Smith PG, Warn JD, Steinle JJ, et al. Modulation of parasympathetic neuron phenotype and function by sympa-thetic innervation[J]. Auton Neurosci, 2002,96(1):33-42.
[3] Tong YC, Cheng JT. Changes in bladder nerve-growth factor and p75NTR genetic expression in streptozotocin-induced diabetic rats[J]. BJU Int, 2005,96(9):1392-1396.
[4] Lee R, Kermani P, Teng KK, et al. Regulation of cell survival by secreted pro-neurotrophins[J]. Science, 2001,294(5548):1945-1948.
[5] Lebrun JF, Bertrand MJ, De Backer O, et al. ProNGF induces TNFalpha-depen-dent death of retinal ganglion cells througha p75NTR non-cell-autonomous signaling pathway[J]. Proc Natl Acad Sci USA, 2010, 107(8): 3817-3822.
[6] Delcroix JD, Tomlinson DR, Fernyhough P. Diabetes and axotomy-induced deficits in retrograde axonal transport of nerve growth factor correlate with decrease levels of p75NTR protein in lumbar dorsal root ganglia[J]. Brain Res Mol Brain Res, 1997, 51(1-2): 82-90.
[7] Chen S, Zhu Y, Feng X, et al.Changes in alpha1-adrenoceptor and NGF/proNGF pathway: a possible mechanism in diabetic urethral dysfunction[J]. Urol Int, 2014, 93(3):344-351.
[8] Ueda T, Yoshimura N, Yoshida O. Diabetic cystopathy: relationship to autonomic neuropathy detected by sympathetic skin response[J]. J Urol, 1997, 157(2): 580-584.
[9] Rodrigues AA Jr, Suaid HJ,Fazan VP, et al. Histologic study of urethral extracellular matrix and collagen from aging and long-term alloxan-induced diabetic male rats[J]. Urology, 2011,77(2): 6-11.
[10] Yang ZG,Dolber PC,Fraser MO.Diabetic urethropathy compounds the effects of diabetic cystopathy[J]. J Urol, 2007, 178 (11):2213-2219.
[11] Steers WD, Tuttle JB. Mechanisms of disease: the role of nerve growth factor in the pathophysilogy of bladder disorders[J]. Nat Clin Pract Urol, 2006, 3(2):101-110.
[12] Wehrman T, He X, Raab B, et al. Structural and mechanistic insights into nerve growth factor interactions with the TrkA and p75 receptors[J]. Neuron, 2007, 53(1):25-38.
[13] Torimoto K, Hirao Y, Matsuyoshi H, et al. Alpha1-adrenergic mechanism in diabetic urethral dysfunction in rats[J]. J Urol, 2005, 173(3):1027-1032.
[14] Dobrowsky RT, Werner MH, Castellino AM, et al. Activation of sphingomyelin cycle through the lowaffinity neurotrophin receptor[J]. Science, 1994,265(5178): 1596-1599.
[15] Bronfman FC, Tcherpakov M, Jovin TM, et al. Ligand-induced internalization of the p75 neurotrophin receptor: a slow route to the signaling endosome[J]. J Neurosci, 2003,23(8):3209-3220.

