西格列汀對高糖培養條件下系膜細胞增殖及細胞外基質產生的影響
趙晉晉,皮銀珍,歐陽俊,楊騰舜,劉羅坤(長沙市第一醫院,長沙410000)
作為糖尿病最重要的微血管并發癥之一,糖尿病腎病(DN)的發病率逐年升高,且因其致殘致死率高日益受到重視。但DN的發病機制復雜,目前尚未完全明確,缺乏有效的防治手段,是目前內分泌學領域研究的重點。腎小球系膜細胞的增殖及細胞外基質(ECM)的產生是糖尿病腎病發生、發展的中心環節[1]。二肽基肽酶-4(DPP-4)抑制劑西格列汀具有降低血糖、減輕胰島素抵抗、保護胰島功能的作用,自臨床應用以來,其對DN患者的腎臟保護作用備受重視,但機制尚不明確。本課題組前期研究發現,西格列汀可以減少早期DN患者腎臟組織ECM的產生[2]。2016年1月~2017年1月,我們觀察了西格列汀對高糖條件下腎小球系膜細胞增殖及ECM相關蛋白表達的影響,探討西格列汀腎臟保護作用的分子機制。
1 材料與方法
1.1 細胞與材料 人腎小球系膜細胞株(HMCs)(湘雅醫學院干細胞研究所饋贈,來源于ADCC細胞庫)。西格列汀原藥(Sigma公司);DMEM培養基(GIBCO公司);ECM相關蛋白纖維連接蛋白(FN)、Ⅳ型膠原(ColⅣ)多克隆抗體(Santa Cruz公司);FITC標記的熒光二抗(Santa Cruz公司); MTT細胞增殖及細胞毒性檢測試劑盒(Beytime公司);二氧化碳細胞培養箱(Binder公司);培養瓶、培養板(Corning公司);超凈工作臺(蘇州凈化集團泰安公司);凝膠成像系統、紫外分光光度劑(Beckman公司)。
1.2 細胞培養 復蘇系膜細胞HMCs細胞株,加入低糖DMEM培養液(D-葡萄糖5.5 mmol/L),在37 ℃、5% CO2培養箱中靜置培養,每2天更換1次培養液。將處于對數生長期的細胞接種于6孔培養板中,密度為 4×105/孔,達90%融合時更換無血清的DMEM培養液同步化12 h,用于后續分組處理。
1.3 系膜細胞FN、ColⅣ分泌最佳培養時間點及葡萄糖最佳干預濃度的確定 系膜細胞分別在正常濃度(D-葡萄糖5.5 mmol/L)、高糖濃度(D-葡萄糖終濃度分別為10、20、30 mmol/L)培養基中培養,并按照觀察時間長短分為6、12、24、48 h四個時間點。ELISA法檢測各濃度及各時間點細胞上清液中FN、ColⅣ蛋白含量,以FN、ColⅣ蛋白含量最高的時間點為最佳時間點,FN、ColⅣ蛋白含量最高的葡萄糖濃度為葡萄糖最佳干預濃度。最終確定最佳干預時間為24 h,葡萄糖最佳干預濃度為30 mmol/L。
1.4 系膜細胞分組與干預 將系膜細胞分為正常對照組、高糖組、高糖+西格列汀低劑量組、高糖+西格列汀中劑量組、高糖+西格列汀高劑量組。正常對照組在D-葡萄糖終濃度5.5 mmol/L的培養基中培養;高糖組在D-葡萄糖終濃度為30 mmol/L的培養基中培養;高糖+西格列汀低、中、高劑量組在D-葡萄糖終濃度為30 mmol/L,西格列汀終濃度分別為0.1、1、10 μmol/L的培養基中培養。各組均培養24 h。
1.5 系膜細胞增殖能力觀察 采用MTT法。取各組細胞,調整細胞密度至5×104/mL;每孔100 μL接種于96孔板中,放入細胞培養箱培養24 h貼壁后,加入干預藥物,培養24 h。每孔加50 μL 1×MTT,在37 ℃孵育4 h后吸出上清液;每孔加150 μL DMSO,用平板搖床搖勻,酶標儀在570 nm波長處檢測每孔的光密度。先將各測試孔的OD值減去本底OD值(完全培養基加MTT,無細胞),得出各受試孔OD值。
1.6 系膜細胞ECM相關蛋白ColⅣ、FN蛋白表達檢測 采用Western blotting法。收集各組細胞,細胞裂解提取總蛋白,將各樣本蛋白濃度調整至一致后點樣,SDS-PAGE電泳分離后4 ℃ 300 mA轉膜70 min;5%脫脂牛奶封閉37 ℃ 2 h。加入稀釋后的一抗(鼠抗人ColⅣ一抗1∶800,鼠抗人FN一抗1∶400)4 ℃孵育過夜,棄去一抗,用PBST在脫色搖床下洗膜10 min×4次,加HRP標記羊抗鼠IgG(稀釋度1∶80 000)室溫下孵育1 h后,棄去二抗,洗膜4次后,加入ECL化學發光顯示劑顯影曝光,Gel pro4.0凝膠光密度分析軟件分析蛋白條帶IOD值。
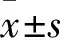
2 結果
2.1 各組系膜細胞增殖能力比較 與正常對照組比較,高糖組系膜細胞增殖能力增強(P<0.05)。高糖+西格列汀中、高劑量組系膜細胞增殖能力均低于高糖組(P均<0.05)。見表1。
2.2 各組系膜細胞Fn、ColⅣ蛋白表達比較 與正常對照組比較,高糖組系膜細胞 FN及ColⅣ蛋白表達增加(P均<0.05)。高糖+西格列汀中劑量組、高糖+西格列汀高劑量組系膜細胞 FN及ColⅣ蛋白表達均低于高糖組,且高糖+西格列汀高劑量組低于高糖+西格列汀中劑量組(P均<0.05)。見圖1、表1。
注:與正常對照組比較,*P<0.05;與高糖組比較,△P<0.05;與高糖+西格列汀中劑量組比較,#P<0.05。
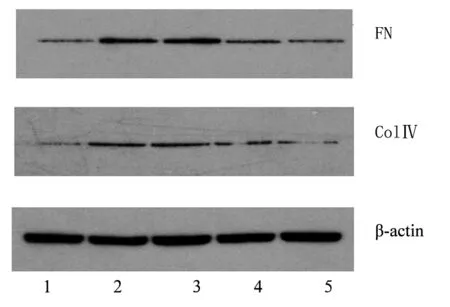
注:1為正常對照組;2為高糖組;3為高糖+西格列汀低劑量組;4為高糖+西格列汀中劑量組;5為高糖+西格列汀高劑量組。
圖1各組系膜細胞FN、ColⅣ蛋白表達情況(Westernblotting法)
3 討論
DN的發病過程伴隨著腎小球肥大、腎小球和腎小管基底膜增厚以及系膜區ECM堆積,最終導致腎小球硬化[3]。腎小球系膜細胞是腎小球中功能最活躍的細胞,是腎小球硬化發生發展的主要參與者[4,5]。正常情況下,腎小球系膜細胞的數量、形態和位置保持相對穩定。而在糖尿病代謝紊亂,如高糖的病理情況下,腎小球系膜細胞可以出現表型轉化——系膜細胞增殖、肥大、凋亡增加[6,7];表型轉化后的腎小球系膜細胞可使分泌ECM增加,導致腎小球硬化,參與DN的發生發展。
FN是一種血漿糖蛋白,在腎臟可以通過結合纖維蛋白、纖維蛋白原,使其他膠原沉積于腎小球和腎小管基底膜。研究發現,在腎臟疾病的早期即有FN的升高,隨著病程的延長,其增加更為明顯,是導致腎臟纖維化的重要因素[8]。ColⅣ是構成腎小球基底膜膠原蛋白的最主要成分,正常情況下含量極微,但在病理情況下,其合成增多及降解減少致ECM積聚,是許多腎臟疾病發生、終至腎小球硬化的主要原因或重要參與因素之一[9]。本研究發現,與正常對照組比較,高糖組系膜細胞增殖能力增強,系膜細胞 FN及ColⅣ蛋白表達增加。提示高糖培養條件下,系膜細胞增殖指數增高,細胞外基質重要成分FN、ColⅣ表達合成增加。表明高糖能誘導系膜細胞出現異常增殖,合成和分泌大量基質成分,最終導致腎小球硬化。
DPP-4抑制劑西格列汀自2006年獲得FDA批準上市以來,其安全性、有效性得到了臨床證實,其在臨床指南中的地位也逐漸提高。大量的臨床及基礎研究證實,西格列汀在2型糖尿病患者中應用可以有效地降低血糖,而且有不增加體質量、減輕胰島素抵抗、保護胰島功能的優點[10]。隨著西格列汀臨床的廣泛應用,臨床中發現西格列汀對糖尿病大血管及微血管病變也有一定保護作用[11]。Penno等[12]采用Meta分析發現,西格列汀可以降低2型糖尿病患者尿微量白蛋白水平,且此作用不依賴于患者糖化血紅蛋白水平的降低。Mori等[13]研究發現,西格列汀可以降低2型糖尿病患者尿微量白蛋白水平,且此作用不依賴于患者血糖水平的降低。國內的很多臨床及動物實驗也發現,西格列汀具有獨立于降糖作用之外的腎臟保護作用[14]。但其腎臟保護作用的具體機制尚不明確。動物實驗發現,西格列汀可以通過下調糖尿病大鼠腎臟組織中的8-羥基脫氧鳥苷(8-OHdG)的表達,上調超氧化物歧化酶(SOD)的表達,改善氧化應激水平,發揮對糖尿病大鼠腎臟的保護作用[15]。本研究發現,高糖+西格列汀中、高劑量組系膜細胞增殖能力均低于高糖組,高糖+西格列汀中劑量組、高糖+西格列汀高劑量組系膜細胞 FN及ColⅣ蛋白表達均低于高糖組,且高糖+西格列汀高劑量組低于高糖+西格列汀中劑量組。提示西格列汀干預能顯著抑制系膜細胞增殖,下調系膜細胞FN、ColⅣ蛋白表達,且西格列汀含量較高時的抑制作用越強。表明西格列汀能夠通過抑制系膜細胞增殖,下調FN和ColⅣ的表達,進而減少ECM在腎臟的進行性堆積,這可能是其保護腎臟的重要作用機制之一。
綜上所述,高糖能促進系膜細胞增殖、促進系膜細胞ECM的產生,西格列汀可抑制系膜細胞增殖,減少系膜細胞FN、ColⅣ的表達,這可能是其發揮腎臟保護作用的機制之一。目前本研究結果僅限于體外實驗,下一步將繼續開展動物實驗進一步證實相關研究發現。
:
[1] Brosius FC, Khoury CC, Buller CL, et al. Abnormalities in signaling pathways in diabetic nephropathy[J]. Expert Rev Endocrinol Metab, 2010, 5(1):51-64.
[2] 趙晉晉,皮銀珍,歐陽俊,等.西格列汀對早期糖尿病腎病患者纖維蛋白的影響[J].航空軍醫,2017,45(4):160-161.
[3] 袁靜,沈燕,謝瑩,等.胸腺素β4對腎小管間質纖維化大鼠轉化生長因子β/結締組織生長因子的影響[J].中華腎臟病雜志,2016,32(3):206-211.
[4] Kolset SO, Reinholt FP, Jenssen T. Diabetic nephropathy and extracellular matrix[J]. J Histochem Cytochem, 2012,60(12):976-986.
[5] 于小函,邸波.腎小球系膜細胞與糖尿病腎病[J].醫學研究雜志,2015,44(9):7-9.
[6] Tervaert TW, Mooyaart AL, Amann K, et al. Pathologic classification of diabetic nephropathy[J]. J Am Soc Nephrol, 2010, 21(4):556-563.
[7] Ni WJ, Tang LQ, Wei W. Research progress in singnalling pathway in diabetic nephropathy[J]. Diabetes Metab Res Rev, 2015,31(3):221-233.
[8] Hu C, Sun L, Xiao L, et al. Insights into the mechanisms involved in the expression and regulation of extracellular matrix proteins in diabetic nephropathy[J].Curr Med Chem, 2015, 22(24):2858-2870.
[9] Marchant V, Droguett A, Valderrama G, et al. Tubular overexpression of Gremlin in transgenic mice aggravates renal damage in diabetic nephropathy[J]. Am J Physiol Renal Physiol, 2015, 309(6):559-568.
[10] Dobs AS, Goldstein BJ, Aschner P, et al. Efficacy and safety of sitagliptin added to ongoing metformin and rosiglitazone combination therapy in a randomized placebo-controlled 54-week trial in patients with type 2 diabetes[J]. J Diabetes, 2013, 5(1): 68-79.
[11] Park SH, Nam JY, Han E, et al. Efficacy of different dipeptidyl peptidase-4 (DPP-4) inhibitors on metabolic parameters in patients with type 2 diabetes undergoing dialysis[J]. Medicine, 2016, 95(32):e4543.
[12] Penno G, Garofolo M, Prato SD. Dipeptidyl peptidase-4 inhibition in chronic kidney disease and potential for protection against diabetes-related renal injury[J]. Nutr Metab Cardiovasc Dis, 2016, 26(5):361-373.
[13] Mori H, Okada Y, Arao T, et al. Sitagliptin improves albuminuria in patients with type 2 diabetes mellitus[J]. J Diabetes Inves, 2014,5(3):313-319.
[14] Hocher B, Reichetzeder C, Alter ML. Renal and cardiac effects of DPP4 inhibitors from preclinical development to clinical research.[J]. Kidney Blood Press Res, 2012,36(1):65-84.
[15] 陳洋,王建平,付婷,等.糖尿病大鼠腎臟8-羥基脫氧鳥苷和超氧化物歧化酶表達的變化及西格列汀對其影響的研究[J].中國糖尿病雜志,2015,23(1):75-78.

