程序降溫處理過程中Nutlin-3對含水生菜種子抗冷性的影響
周 強,韓穎穎,沈夢琪,李維杰,劉寶林
(上海理工大學醫療器械與食品學院,生物系統熱科學研究所,上海 200082)
非生物脅迫對植物的影響一直是植物研究的熱點,常見的非生物脅迫包括干旱、鹽堿、低溫、輻射等。其中低溫脅迫是植物生長過程中無法避免的影響因子,每年各種植物以及農作物因為這些因素產生的經濟損失重大。據國家統計局數據顯示,2014年低溫冷凍和雪災受災面積達到0.21萬hm2,絕收面積達到16.82萬hm2。減少植物應對低溫冷害而引起的經濟損失已經是研究的熱點。
研究表明植物自身在應對低溫脅迫時會有應對機制,如調整代謝、調節基因表達等[1]。對于植物來說,低溫的傷害不僅僅是對于植株,對于種子也會有影響。根據種子脫水行為等特點將種子分為正常型、中間型和頑拗型[2]。正常型種子含水量低,不易受到低溫的傷害。而頑拗型種子因為含水量較高,低溫下不容易保存。中間型種子可以脫水干燥,但是對低溫保存敏感。本試驗中用到的‘羅莎綠’生菜種子屬于正常型種子,在經過吸水處理后進行程序降溫處理。通過轉錄組測序技術對以不同降溫速率程序降溫后種子的差異基因表達進行檢測,發現經過處理之后,泛素連接酶介導的蛋白降解功能有差異,許多泛素連接酶都參與其中[3],說明泛素連接酶參與種子對程序降溫速率的感應。
在動物細胞中,泛素抑制劑Nutlin-3可以有效與E3泛素連接酶MDM2結合,從而阻斷MDM2-P53環路[4-6]。但是其在植物中是否也調節泛素連接酶功能還未有研究,本試驗利用Nutlin-3對含水生菜種子進行處理,研究Nutlin-3對程序降溫過程中種子的耐凍性和泛素連接酶E3的影響,從而找到Nutline-3在植物中的靶基因,同時為頑拗型種子的保護提供借鑒。
1 材料與方法
1.1 材料
‘羅莎綠’生菜(Lactuca sativa‘Rosa Green’)種子,購自鳳鳴雅世種子公司(北京)。
1.2 吸脹試驗
將生菜種子隨機置于兩種培養基中(表1),使其充分吸水,11 h后取出。因為Nutlin-3溶液的配制是在100 nmol/L有機溶劑DMSO里進行的,所以將等體積的DMSO處理設置為對照組。

表1 吸脹培養基組分Table 1 Components of imbibition medium
1.3 程序降溫處理
將經吸水處理后的種子置于程序降溫儀中,從初始溫度21℃開始以60℃/h的降溫速率進行程序降溫至-20℃后取出,然后進行發芽率、基因表達、生理指標的檢測和相關數據的顯著性分析。
1.4 發芽率測量
將程序降溫處理后取出的種子在室溫下恢復30 min,分別取25粒播種于1%的瓊脂糖培養基,并置于光照培養箱中進行萌發,每處理3次重復,統計種子萌發情況并進行顯著性檢驗。光照培養箱的參數為23℃,光照16 h/d。
1.5 基因表達檢測
將程序降溫取出后的種子立即置于液氮中并進行總RNA提取(RNAiso,TaKaRa),然后通過去除基因組DNA反應和逆轉錄反應獲得cDNA。根據Beacon designer設計相關基因的引物,由上海生工生物工程有限公司合成。以ABI 9500進行實時定量熒光PCR。表2為熒光定量PCR的程序設置。

表2 熒光定量PCR程序設置Table 2 Settings of real-time PCR
1.6 脯氨酸含量的測定
將程序降溫處理后的種子每份稱取0.16 g,采用茚三酮法測定脯氨酸含量[7]。
1.7 超氧化物歧化酶活性的測定
將程序降溫處理后的種子每份稱取0.26 g,置于預冷的研缽中,加入預冷、pH 7.8的磷酸緩沖液10 mL,充分研磨。分別吸取1.5—2.0 mL漿液至離心管,于4℃、1 000 r/min離心20 min,取上清。采用氮藍四唑(NBT)法測定 SOD活性[8]。
2 結果與分析
2.1 程序降溫對含水生菜種子發芽率的影響
研究表明,種子的發芽率是可以體現出種子的萌發能力的[9]。由表3可見,Nutlin-3處理組與對照吸脹組在溫度降至-5℃和-10℃時,發芽率無顯著差異,說明在此溫度范圍內種子并沒有受到傷害。在溫度降至-15℃時,發芽率開始出現降低,但大部分種子仍然能夠正常發芽。說明無論是程序降溫處理還是抑制劑Nutlin-3處理都沒有對種子造成明顯傷害,也說明生菜種子對低溫有一定的抗冷性。當溫度降低至-20℃時,對照組發芽率出現明顯下降,而Nutlin-3處理組幾乎沒有變化。由此可見,低溫處理會對種子造成一定的傷害,當溫度降低至-20℃時傷害程度最高。與對照吸脹組相比,Nutlin-3處理組雖然未能提高發芽率,但卻沒有出現明顯的下降。說明Nutlin-3可調控種子內部某種生物學機制,從而保護種子胚,提高種子的抗凍性。

表3 抑制劑對生菜種子發芽率的影響Table 3 Effects ofinhibitors on the germ ination rate of seeds
2.2 泛素連接酶通路相關基因的實時熒光定量PCR檢測
泛素化對于細胞內的很多蛋白以及生物學功能中都有著重要的作用,比如細胞表面的受體、轉錄因子、調控細胞凋亡等[10-12]。泛素化過程就是泛素分子在經過E1泛素激活酶、E2結合酶、E3連接酶的作用之后對底物蛋白進行特異性修飾的過程[13]。泛素化過程最重要的酶就是E3泛素連接酶,它可以對底物進行特異性識別并且修飾[14]。在真核生物當中根據與E2泛素結合酶結合區域同源性的分析,可以將E3連接酶大致分為兩類:HECT型和RING型,其中RING型E3連接酶又可以分為Multiple-RING型和Single-RING型[15-16]。通過實時熒光定量PCR檢測,鑒定Nutline-3對各類E3連接酶的影響,從而確定Nutline-3在植物細胞中的靶標,并且探索泛素化途徑與植物抗冷性的關系,確定參與低溫條件下泛素化修飾關鍵基因。
TRIP12作為HECT型E3連接酶的典型代表,對其進行熒光定量PCR(Real-time PCR)檢測顯示,對照吸脹組對TRIP12表達沒有明顯的影響。Nutline-3吸脹組在程序降溫處理時提高了TRIP12的表達(圖1A)。
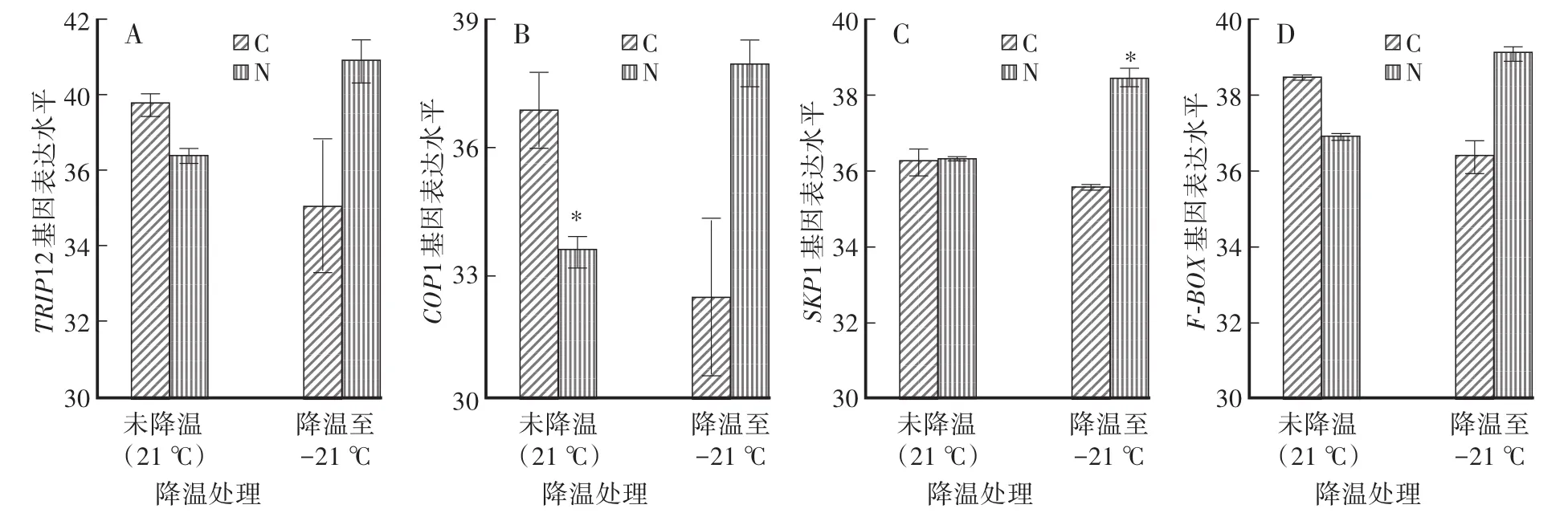
圖1 Nutlin-3對程序降溫處理后TRIP12、COP1、SKP1、F-BOX的m RNA表達水平的影響Fig.1 The effects of Nutlin-3 on m RNA level of TRIP12,COP1,SKP1,F-BOX after programmed cooling
COP1屬于Single-RING型E3連接酶,SKP1和F-BOX是多亞基RING型E3連接酶。對于COP1基因來說,對照吸脹組基因表達量經過程序降溫處理之后明顯降低。Nutlin-3吸脹組在未程序降溫時顯著抑制了COP1的表達。而程序降溫后,Nutlin-3吸脹組提高了COP1的表達,說明低溫下Nutlin-3的處理能夠誘導COP1的表達(圖1B)。
對于多亞基RING型E3連接酶SKP1來說,對照吸脹組經過程序降溫處理無明顯差異。Nutlin-3吸脹組在未程序降溫條件下對SKP1基因表達無影響,在程序降溫處理后對基因表達有顯著促進作用(圖1C)。而對于F-BOX基因,對照吸脹組經過程序降溫抑制了F-BOX的表達。Nutlin-3吸脹組在未程序降溫條件下抑制了F-BOX的表達,程序降溫條件下促進了F-BOX的表達(圖1D)。
對于與冷相關的E3連接酶HOS1來說,屬于Single-RING型E3連接酶[17]。HOS1可以泛素化降解抗冷轉錄因子ICE1,調節ICE1的蛋白水平。檢測結果表明,對照吸脹組中程序降溫對于HOS1基因的表達沒有影響,而Nutlin-3吸脹組在程序降溫條件下顯著降低HOS1的表達(圖2A)。
ICE1是重要的抗冷因子,室溫下處于非激活狀態,而低溫應激情況下被激活并且可以促進CBF的轉錄[18]。對照吸脹組ICE1表達無明顯增加,而Nutlin-3吸脹組在程序降溫條件下顯著增強了ICE1的表達(圖2B)。
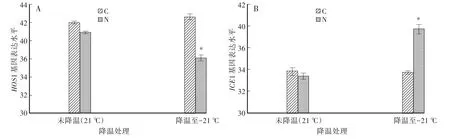
圖2 Nutlin-3對程序降溫處理后HOS1和ICE1的mRNA表達水平的影響Fig.2 The effects of Nutlin-3 on m RNA level of HOS1 and ICE1 after programmed cooling
2.3 種子內脯氨酸含量的變化
脯氨酸作為一種滲透保護性物質,是氨基酸中水溶性最大的一種。當植物受到低溫脅迫的影響時,會產生大量的脯氨酸來抵抗冷應激,以此提高植物的抗寒性,因此可以作為抗寒育種的生理指標[19]。本研究對不同濃度標準品測定和數據分析后,得到脯氨酸標準曲線為Y=0.1653X-0.2090。
可以看出,低溫處理后對照組和處理組的脯氨酸含量都有所提高,與現有結論相符。但降溫前后兩組的脯氨酸含量差異不明顯,說明Nutlin-3對提高程序降溫中種子的抗冷性沒有通過脯氨酸途徑完成(圖3A)。
2.4 種子內SOD酶活性的變化
植物在低溫脅迫下產生的氧自由基會對核酸,蛋白質等生物大分子造成傷害[20]。而植物體內存在自由基氧去除相關的酶,如超氧化物歧化酶(SOD)、過氧化物歧化酶(POD)等[21]。其中SOD可以作為植物所受傷害程度的指標,也可以間接的反應耐寒性的強弱[21]。可以看出,對照組低溫處理之后SOD酶活性出現上升,說明植物受到了傷害。Nutlin-3處理組低溫處理后的種子內SOD酶活性與對照吸脹組相比出現明顯降低,說明Nutlin-3處理組種子在-20℃下受到的傷害低于對照吸脹組,Nutlin-3處理增強了植物的抗凍性,這Nutlin-3組發芽率要高于對照組相一致(圖3B)。
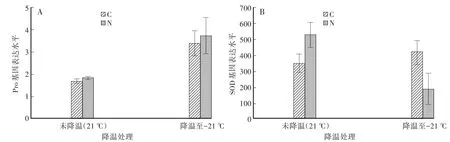
圖3 Nutlin-3對程序降溫處理后脯氨酸含量和SOD活性的影響Fig.3 The effects of Nutlin-3 on the content of Pro and the activity of SOD after programmed cooling
2.5 程序降溫過程中Single-RING型E3泛素連接酶基因的表達水平變化
2.5.1 ICE1的表達變化
對照組在程序降溫的過程中,ICE1的表達量先升后降,在-10℃時達到峰值,且普遍高于21℃時的表達量值,證明ICE1確實是一個冷響應因子。而在Nutlin-3處理組中,在-5℃至-15℃的溫度范圍內,Nutlin-3對ICE1作用不明顯,在-20℃條件下,Nutlin-3顯著促進了ICE1的表達。這與表型結果相一致,即Nutline-3在-20℃顯著促進種子的抗凍性(圖4A)。
2.5.2 HOS1的表達變化
對照組中,HOS1在-5℃至-15℃的溫度范圍內表達量增加;HOS1在-20℃條件下與未程序降溫對照組相比無明顯變化。Nutlin-3處理組在-5℃至-15℃的溫度范圍之內無明顯變化,在-20℃條件下Nutlin-3顯著抑制HOS1的表達(圖4B)。Nutlin-3處理對ICE1和HOS1兩者相反的作用趨勢顯示出HOS1和ICE1之間的關系,即HOS1是ICE1的上游抑制調控因子。
2.5.3 COP1的表達變化
對照組中,隨著溫度的降低,在-5℃至-15℃范圍內COP1的表達有上升的趨勢;COP1在-20℃條件下與未程序降溫對照組無明顯變化。Nutlin-3處理組中,-5℃至-15℃范圍內COP1的表達無明顯變化,但是-20℃條件下相比于對照組,Nutlin-3顯著提高了COP1的表達(圖4C)。

圖4 Nutlin-3對程序降溫處理后ICE1、HOS1、COP1的mRNA表達水平的影響Fig.4 The effects of Nutlin-3 on mRNA level of ICE1、HOS1、COP1 after programmed cooling
HOS1、ICE1、COP1在降溫至-15℃前都有升高的趨勢,說明三者與種子程序降溫過程中耐凍性形成有關。-20℃條件下Nutline-3對ICE1和COP1表現出相同的調控趨勢。COP1作為單環指泛素E3連接酶,與HOS1一樣是否也調控ICE1的泛素化,是將來需要進一步研究的課題。
3 討論
Nutlin-3作為動物細胞內E3連接酶MDM2的抑制劑,可以阻斷MDM2與抑癌基因P53的連接,但是到目前為止還沒有關于Nutlin-3應用于植物泛素化連接酶的研究。
生菜種子作為一種正常型種子,其不僅含水量低而且耐凍性好,是種子低溫保存的模式生物。將其進行吸脹處理并經過程序降溫之后可以用來研究其抗凍性,可為頑拗型種子的保存提供參考。
對種子的發芽率進行統計發現在程序降溫至-10℃之前發芽率幾乎沒有變化,而在降溫至-15℃時,發芽率開始出現下降趨勢。當溫度降低至-20℃時,對照組發芽率顯著下降,說明此溫度會對種子造成冷凍傷害。但是Nutlin-3處理的種子在此溫度沒有出現下降,推測Nutlin-3處理影響了細胞內泛素化調控從而增強了種子的抗凍性。
從結果可以看出,雖然Nutlin-3對不同的E3連接酶基因都有不同程度的影響,但是對于HOS1的影響更加明顯。所以,可以推測在此降溫速度下,Nutlin-3的靶基因可能為HOS1。同時從結果中可以看出,冷相關重要轉錄因子ICE1受到了Nutlin-3的促進。由此可以得出,Nutlin-3可能是通過影響了ICE1蛋白的泛素化調控過程,從而增強種子的抗凍性。但是Nutlin-3如何抑制HOS1基因的還需要進一步研究。另外COP1作為泛素連接酶基因與ICE1表現出相同的表達趨勢,都受到Nutlin-3促進。COP1與ICE1之間的相互調控關系也有待進一步研究。
植物細胞和組織在低溫條件下會受到低溫損傷,SOD可以作為一個傷害指標[21]。Nutlin-3吸脹處理的生菜含水種子在程序降溫過程中SOD的活性明顯降低,表明種子受低溫傷害較小,程序降溫至-20℃時種子的發芽率高于對照吸脹處理也體現了這一點,說明Nutlin-3在一定程度上保護了程序降溫對種子造成的傷害。但是這種作用是否是通過ICE1和HOS1兩種因子來完成的還無法得出結論。
脯氨酸是植物體內廣泛存在的有機溶劑,植物在干旱、低溫和高鹽等情況下游離的脯氨酸含量會增加用于保護機體免受傷害[22]。在本試驗中,低溫下脯氨酸含量的增加符合已有的研究結果,但是經過Nutlin-3處理之后相比于對照組幾乎沒有促進的作用,說明Nutlin-3對種子的保護不是通過增加脯氨酸合成實現的。
經過相關基因表達的檢測和SOD、脯氨酸這些生理指標的測量后,可得出結論:Nutlin-3處理提高了種子的耐凍性,Nutlin-3可能通過抑制HOS1從而阻止抗凍蛋白ICE1的泛素化降解。
[1]師秋菊,李群.植物耐受低溫脅迫研究進展[J].北方園藝,2013(5):191-194.
[2]ELLISR H,HONG T D,ROBERTSE H.An intermediate category of seed storage behavior I.COFFEE[J].Journal of Experimental Botany,1990,41(9):1167-1174.
[3]沈夢琪,韓穎穎,周強,等.小白菊內酯及降溫速率對含水生菜種子抗冷性的影響[J].亞熱帶植物科學,2016,45(4):308-314.
[4]NAG S,QIN J,SRIVENUGOPAL K S,et al.The MDM2-p53 pathway revisited[J].Journal of Biomedical Research,2013,27(4):254-271.
[5]LEVAV-COHEN Y,GOLDBERG Z,TAN KH,et al.The p53-Mdm2 loop:a critical juncture of stress response[J].Subcellular Biochemistry,2014(85):161-186.
[6]JIANG P,LIW,ZENG X,et al.The Role of TP53 and MDM2 Polymorphisms in the Risk of Cervical Cancer[J].Journal of Computational and Theoretical Nanoscience,2012,10(1):349-352.
[7]王征宏,趙威,戴凌峰.關于植物脯氨酸含量測定中萃取乳化現象的探討[J].科教文匯(上旬刊),2013(11):71-80.
[8]曲敏,秦麗楠,劉羽佳,等.兩種檢測SOD酶活性方法的比較[J].食品安全質量檢測學報,2014,5(10):3318-3323.
[9]WANG S,WAN C,WANG Y,et al.The characteristics of Na+,K+and free proline distribution in several drought-resistant plants of the Alxa Desert,China[J].Journal of Arid Environments,2004,56(3):525-539.
[10]KUREPA J,WANG S,LIY,etal.Proteasome regulation,plantgrowth and stress tolerance[J].Plant Signaling and Behavior,2009,4(10):924-927.
[11]ZHANG Y,ZHAO Z,XUE Y.Roles of Proteolysis in Plant Self-Incompatibility[J].Annual Review of Plant Biology,2009,60(1):21-42.
[12]SHAID S,BRANDTSCH,SERVE H,et al.Ubiquitination and selective autophagy[J].Cell Death and Differentiation,2013,20(1):21-30.
[13]HAGLUND K,DIKIC I.The role of ubiquitylation in receptor endocytosis and endosomal sorting[J].Journal of Cell Science,2012,125(2):265-75.
[14]LYZENGAW J,STONE SL.Abiotic stress tolerancemediated by protein ubiquitination[J].Journal of Experimental Botany,2012,63(2):599-616.
[15]VIERSTRA R D.The ubiquitin-26S proteasome system at the nexus of plant biology[J].Nature ReviewsMolecular Cell Biology,2009,10(6):385-397.
[16]STONE S L,CALLIS J.Ubiquitin ligasesmediate growth and development by promoting protein death[J].Current Opinion in Plant Biology,2007,10(6):624-632.
[17]DONG C H,AGARWAL M,ZHANG Y,et al.The negative regulator of plant cold responses,HOS1,is a RING E3 ligase thatmediates the ubiquitination and degradation of ICE1[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(21):8281-8286.
[18]NAKAMURA J,YUASA T,HUONG T T,et al.Rice homologs of inducer of CBF expression(OsICE)are involved in cold acclimation[J].Plant Biotechnology,2011,28(3):303-309.
[19]HONG Z,LAKKINENI K,ZHANG Z,et al.Removal of Feedback Inhibition of delta(1)-Pyrro line-5-Carboxylate Synthetase Results in Increased Proline Accumulation and Protection of Plants from Osmotic Stress[J].Plant Physiology,2000,122(4):1129-1136.
[20]高福元,張吉立,劉振平.冬季低溫對4種彩葉植物SOD、POD活性影響的研究[J].中國農學通報,2010,26(5):169-173.
[21]MCCORD J M,FRIDOVICH I.Superoxide dismutase:an enzymic function for erythrocuprein(hemocuprein)[J].Journal of Biological Chemistry,1969,224(22):6049-6055.
[22]TURCHETTO-ZOLET A C,MARGIS-PINHEIRO M,MARGISR.The evolution of pyrroline-5-carboxylate synthase in plants:a key enzyme in proline synthesis[J].Molecular Genetics and Genomics Mgg,2009,281(1):87-97.

