EMS-ARTP復合誘變選育高產DHA裂殖壺菌
趙 犇
王 武1
李昌靈2
楊海麟1
(1.江南大學生物工程學院教育部工業微生物技術重點實驗室,江蘇 無錫 214122;2.懷化學院生物與食品工程學院,湖南 懷化 418000)
隨著世界范圍內能源和資源的日益緊張,可再生能源與資源的研究與開發已成為關注熱點。近幾年,各國紛紛開始在微藻生物燃料和營養化學品領域謀求突破與發展:美國能源部宣布將投資1 800萬美元用于藻類生物燃料與生物基產品研究;歐盟也積極投資藻類研究,旨在示范從藻種選育、培養條件優化、油脂提取、生物燃料生產等過程[1]。微藻在食品資源方面的利用涉及到裂殖壺菌,又稱裂壺藻,是屬于破囊壺菌科的單細胞海洋微藻,在一定的培養條件下,裂殖壺菌胞內油脂中二十二碳六烯酸(DHA,C22:6)含量較高,是值得研究和深度開發的生物合成DHA的優質種源[2]。
DHA為ω-3多不飽和脂肪酸,是一種重要的食品添加劑。它是大腦和視網膜的重要組成成分,還具有抗癌、消炎、預防心血管疾病等諸多功能[3-4],其保健和醫療功效越來越受到重視。與傳統的深海魚油生產DHA的方式相比,裂殖壺菌發酵生產DHA具有培養簡單、無季節波動、目的產物含量比高、無污染、無魚腥味、成本低、不影響海洋生態等優點[5],裂殖壺菌發酵生產DHA開始進入了工業化階段[6]。
近些年,不斷見到優化裂殖壺菌發酵,提高DHA產量的研究報道,如發酵培養基優化[7-9]、pH調控[10-11]、溶氧調控[12-14]、補料策略優化[15]等,靠傳統發酵策略提高DHA的發酵生產強度的余地越來越小。而借助遺傳育種手段,培育高產DHA的裂殖壺菌變異株仍有一定的發展空間,這也是發酵法提高DHA生產強度的上游基礎。
裂殖壺菌基因組約39 Mb[16],且裂殖壺菌代謝體系中脂肪酸合成途徑復雜,既存在短鏈飽和脂肪酸的脂肪酸合酶(fatty acid synthase, FAS)合成途徑,又存在長鏈不飽和脂肪酸的聚酮合酶(polyketide synthase, PKS)的合成通路[17]。盡管基因工程已普遍應用于微生物育種,并且在裂殖壺菌上也有所研究[18-19],但考慮到裂殖壺菌復雜的遺傳背景和尚不十分明晰的DHA合成途徑,物理和化學誘變仍舊是可以考慮的選擇。
甲基磺酸乙酯(EMS)誘變為化學誘變,其作用機制是對DNA上高密度的堿基進行烷化作用,形成轉換型或置換型突變[20]。目前EMS誘變在微生物育種以及農作物的優良品種選育上廣泛應用,并獲得了不錯的效果[21-22]。常壓室溫等離子體(ARTP)是一種新型的誘變技術,它利用大氣壓輝光放電,產生多種活性粒子,作用于DNA上,引發基因突變[23],它具有操作簡單、可控性強、誘變效果好的特點,已逐步開始在科研與工業領域發揮重要作用[24]。由于單種誘變方法往往會使菌種產生抗性,或得到的誘變菌株性能不夠穩定,在實際應用中往往采用2種或多種誘變方式相結合的方法進行誘變,即復合誘變[25]。
裂殖壺菌具有多層的細胞壁結構保護著胞內物質[26],DHA的合成途徑與代謝機制又十分復雜。以往針對裂殖壺菌的育種手段往往采用單一的誘變方法,這會產生誘變效果差、誘變效率低或誘變株性能不穩定、易退化等問題,如呂曉義等[27]僅僅利用60Co-γ射線輻照誘變裂殖壺菌,獲得的誘變菌產量只有5.65 g/L;梁園梅等[28]采用單一UV誘變育種,獲得的誘變株性能也沒有突出的提升。欲獲得性狀良好、遺傳穩定的裂殖壺菌高產DHA變異株,本研究將EMS-ARTP復合誘變方法應用于裂殖壺菌誘變育種,以期獲得裂殖壺菌高產DHA誘變菌。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
菌株:裂殖壺菌(Schizochytriumsp.S31,ATCC 20888),美國菌種保藏中心;
脂肪酸:標準品,美國Sigma公司;
正己烷:HPLC級,美國Fisher公司;
其他試劑:分析純,國藥集團化學試劑有限公司。
1.1.2 主要儀器設備
離心機:3K15型,德國Sigma公司;
分光光度計:T6新世紀型,北京普禧通用儀器有限公司;
ARTP誘變儀:ARTP-III型,北京思清源生物科技有限公司;
氣相色譜儀:GC-2010型,日本島津公司。
1.1.3 培養基
790 By+固體培養基:葡萄糖5 g/L、胰蛋白胨1 g/L、酵母粉1 g/L、瓊脂20 g/L、海水晶17.5 g/L,121 ℃ 滅菌20 min;
種子培養基:葡萄糖30 g/L、胰蛋白胨10 g/L、酵母粉5 g/L、海水晶15 g/L、VB10.05 g/L、VB60.05 g/L、VB120.000 5 g/L,115 ℃滅菌20 min;
發酵培養基:葡萄糖100 g/L、胰蛋白胨5.6 g/L、谷氨酸鈉20 g/L、磷酸二氫鉀2.5 g/L、硫酸鎂7.2 g/L、硫酸鈉 12.8g/L、氯化鈣 0.4 g/L、海水晶17.5 g/L、VB10.1 g/L、VB60.1 g/L、VB120.001 g/L,115 ℃滅菌20 min;
0.2 mol/L PBS緩沖液(pH 7.2):用雙蒸水分別溶解24.00 g 磷酸二氫鈉和28.39 g磷酸氫二鈉至1 000 mL,然后混合280 mL磷酸二氫鈉溶液和720 mL磷酸氫二鈉溶液,121 ℃滅菌20 min,備用;
EMS溶液:取5 mL EMS原液,加入到15 mL預冷的乙醇溶液中,加蓋并輕輕轉動試管混合均勻。
1.2 方法
1.2.1 裂殖壺菌誘變菌株制備
(1) 菌懸液制備:將裂殖壺菌接種于裝有50 mL種子培養基的250 mL搖瓶中,28 ℃、200 r/min培養2 d。取1 mL培養液3 000 r/min離心5 min收集菌體,用PBS緩沖液洗滌2次后稀釋至OD540為0.6~0.7(以PBS緩沖液為參比管)。
(2) EMS誘變株制備:在10 mL菌懸液中加入400 μL EMS溶液,輕輕搖勻后置于搖床,28 ℃、200 r/min條件下分別處理0,10,20,30,40,50,60 min(0 min為對照組),取出后用5%硫代硫酸鈉溶液洗滌2~3次終止反應,細胞用PBS緩沖液懸浮后吸取100 μL均勻涂布于固體培養基平皿上,置于30 ℃避光培養4 d。
(3) ARTP誘變株制備:吸取20 μL菌懸液,均勻涂抹在滅過菌的載物鐵片上,將鐵片置于ARTP誘變儀載物臺上,用高純氦氣等離子體誘變分別處理0(對照組),5,10,15,20,25 s,誘變參數為:電源功率100 W,氦氣流量10 L/min,照射距離2 mm。ARTP誘變處理后,將鐵片轉移至裝有1 mL PBS緩沖液的EP管中,震蕩洗脫菌體。吸取100 μL菌體懸浮液均勻涂布于固體培養基平皿上,置于30 ℃避光培養4 d。
(4) EMS-ARTP復合誘變菌制備:將EMS誘變處理40 min 后制備的誘變菌懸液吸取100 μL均勻涂布于固體培養基平皿上,置于30 ℃避光培養4 d。混合平皿上長出的單菌落,并挑取一環,接種于裝有50 mL種子培養基的250 mL搖瓶中,按1.2.1(1)制備菌懸液,然后按1.2.1(3)經ARTP照射誘變15 s,獲得EMS-ARTP復合誘變菌。其中對照組EMS處理時間0 min,ARTP照射時間0 s。
1.2.2 致死率、突變率計算
(1) 致死率計算:各誘變試驗中,對對照組和誘變組固體培養基平皿上長出的菌落進行計數。按式(1)計算致死率。
(1)
式中:
rL——致死率,%;
N0——對照組菌落數;
Nm——誘變組菌落數。
(2) 突變率計算:各誘變試驗中,選取致死率為80%~90%的處理時間作為最終誘變時間。在該誘變時間下對裂殖壺菌進行誘變處理,平板培養4 d后各組隨機挑選50株菌,搖瓶培養120 h后測DHA產量,記產量高于原始菌株10%的誘變株為正突變株,產量低于原始菌株10%的誘變株為負突變株,并按式(2)計算突變率。
(2)
式中:
rm——突變率,%;
rP——正突變率,%;
rN——負突變率,%;
NP——正突變株菌株數;
NN——負突變株菌株數。
1.2.3 分析方法
(1) 生物量測定:各誘變株搖瓶培養120 h后,取5 mL發酵液于離心管中,8 000 r/min離心15 min,用雙蒸水洗滌離心2次,冷凍干燥后稱重計算生物量。
(2) 含油量測定:采用磷酸香草醛法[29]。
(3) 脂肪酸含量測定:采用氣相色譜法[11]。
各誘變組選取5株DHA產量最高的菌株,其發酵平均水平作為該誘變方法下得到的高產菌的發酵水平。
2 結果與分析
2.1 誘變劑量的確定
2種誘變方法對裂殖壺菌的致死效應見圖1。裂殖壺菌菌體的致死率與EMS處理時間存在明顯的正相關效應,當EMS處理時間為40 min時,致死率達到87%。因此,選取40 min作為EMS處理的誘變劑量。
裂殖壺菌菌體的致死率隨著ARTP照射時間的延長而顯著增加。當照射時間在15 s以上時,致死率曲線趨于平緩,可能是細胞SOS修復機制的激活,突變率開始增加[30]。此時,裂殖壺菌的致死率達到80%以上。因此,選取15 s作為ARTP照射的誘變劑量。
從圖1可以看出,對裂殖壺菌誘變的化學處理中,致死率對應于處理時間,形成較為平緩的上升曲線,而物理誘變中,致死率對應于照射時間則顯得陡峭,說明準確掌控照射時間點非常重要。
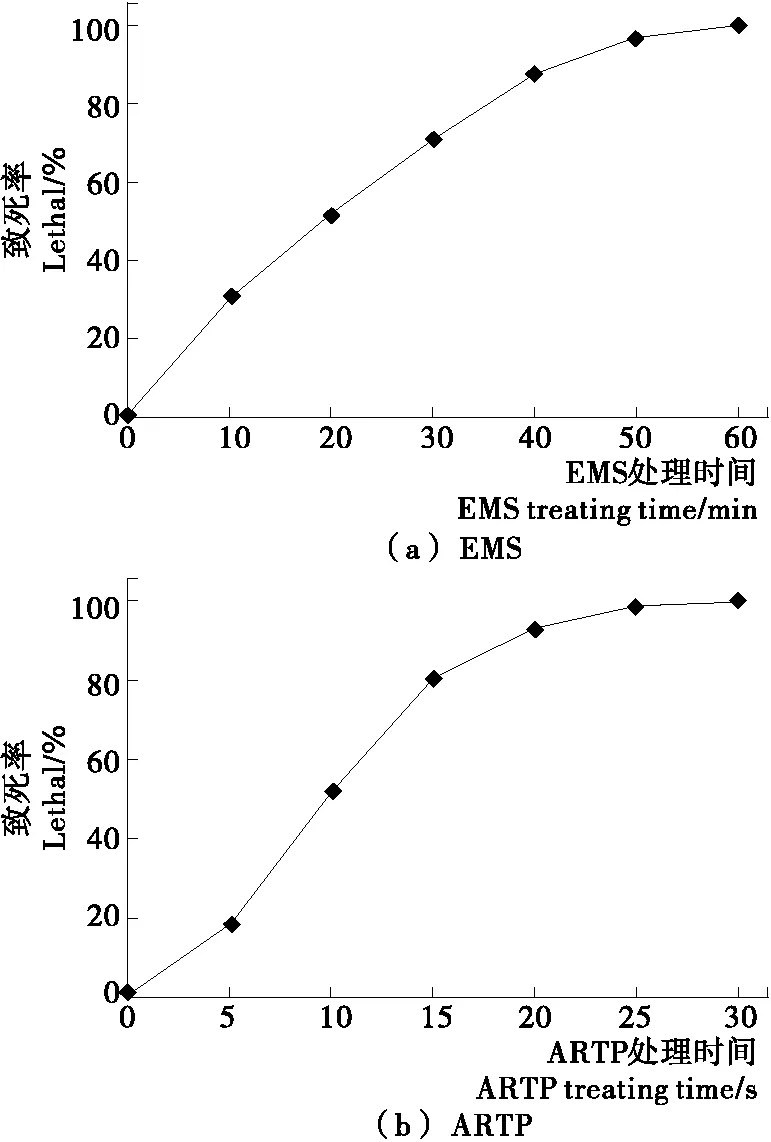
圖1 2種誘變方法對裂殖壺菌的致死效應Figure 1 Lethal effects of 2 mutagenesis factors to Schizochytrium sp.31 (n=3)
2.2 EMS、ARTP和EMS-ARTP處理突變率的對比
分別使用EMS、ARTP和EMS-ARTP復合誘變3種誘變方法對裂殖壺菌進行誘變處理,并對誘變株進行搖瓶培養后測DHA產量,統計正、負突變率,結果見圖2。3種誘變方法對裂殖壺菌的誘變效果呈現出一定的差異性。比較2種單因子誘變方法,裂殖壺菌突變率相差不大,介于40%與45%之間,但是在ARTP突變株中,正突變株的數量占到約60%,遠高于負突變株;而在EMS突變株中,正、負突變株數量相當。EMS-ARTP復合誘變后,突變率達到55.7%,明顯高于2種單因子誘變。其中正突變率達到32.2%,遠遠高于負突變率。
對裂殖壺菌而言,3種突變方法形成的突變率截然不同。表觀上分析,推測EMS-ARTP復合誘變造成了更豐富的突變位點,因此回復突變的頻率遠遠低于單因子誘變。
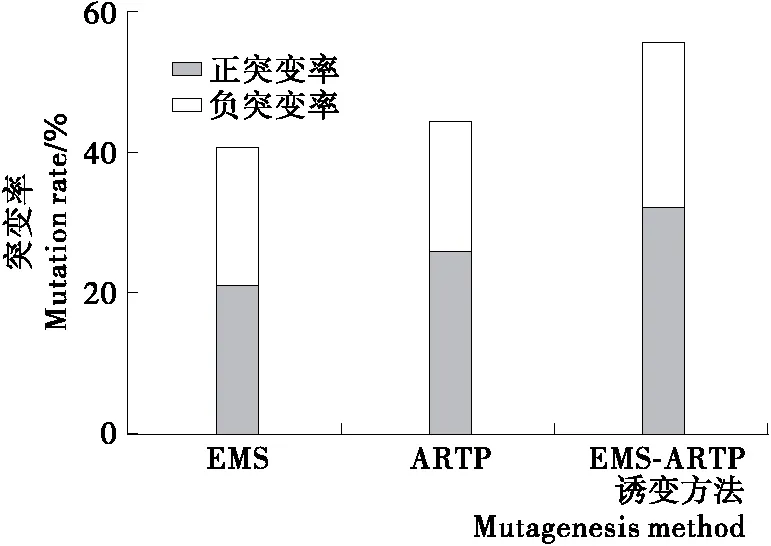
圖2 3種誘變方法對裂殖壺菌誘變處理的突變率Figure 2 Mutation rate of 3 mutagenesis factors to Schizochytrium sp.31 (n=3)
2.3 高產誘變株的關鍵發酵指標類比
從3種誘變方法獲得的誘變株當中各挑選5株DHA產量最高的菌株,其發酵平均水平作為該誘變方法下得到的DHA高產菌株的發酵水平,結果見表1、2。從表1可知,與出發菌株相比,3種DHA高產菌株的生物量無明顯的變化,而在含油量上,均有不同程度的提高,其中EMS誘變高產株含油量提升略高于ARTP誘變的,而復合誘變高產株含油量最高,達到51%。如表2所示,EMS誘變高產株的DHA較出發菌株無明顯變化,而ARTP誘變高產株和復合誘變高產株DHA含量均得到了提升,分別約為40%和43%。基于上述變化,最終3種誘變菌的DHA產量均得到了一定程度的提升,其中EMS-ARTP復合誘變高產株的產量達到了7.2 g/L,提升了近36%,效果最明顯。
3種DHA高產菌株的脂肪酸組成與出發菌株具有明顯的差異,見表2。EMS誘變高產株的主要FAS產物,如C14∶0和C16∶0略有增加,主要PKS產物二十二碳五烯酸(DPA)出現下降現象;而ARTP和復合誘變高產株的FAS產物和PKS產物變化與EMS誘變高產株正好相反,如復合誘變高產株的FAS產物由原始菌株的42.3%下降到38.6%,而PKS產物由原始菌株的44.9%上升到55.2%。
表1不同高產DHA裂殖壺菌誘變株發酵性能分析?
Table 1 Analysis of fermentation performances on different high DHA yieldSchizochytriummutants (n=3)
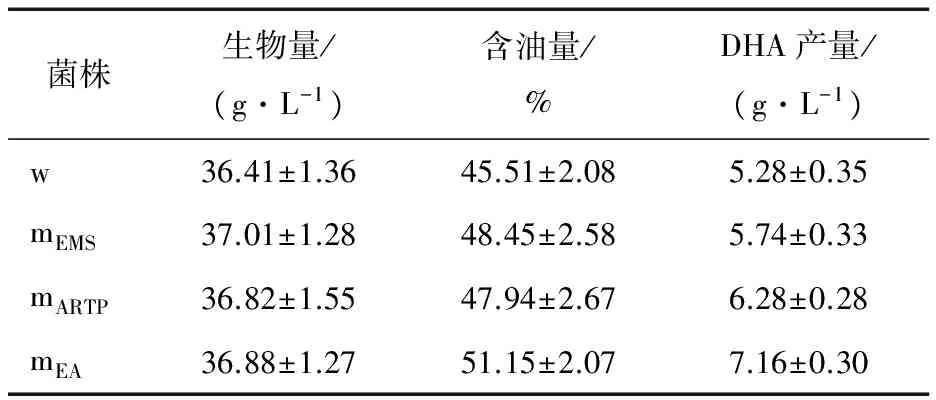
菌株生物量/(g·L-1)含油量/%DHA產量/(g·L-1)w36.41±1.3645.51±2.085.28±0.35mEMS37.01±1.2848.45±2.585.74±0.33mARTP36.82±1.5547.94±2.676.28±0.28mEA36.88±1.2751.15±2.077.16±0.30
? w:原始菌株;mEMS:EMS誘變菌株;mARTP:ARTP誘變菌株;mEA:EMS-ARTP復合誘變菌株。
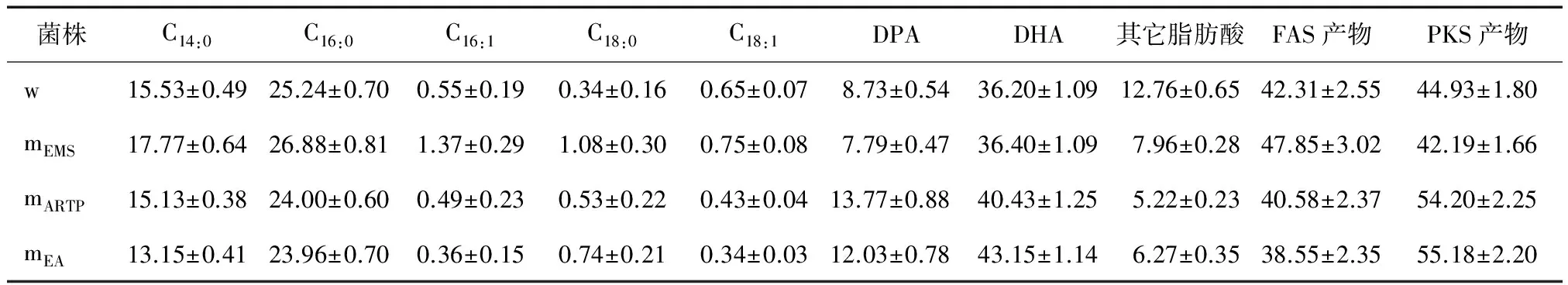
表2 不同高產DHA裂殖壺菌誘變株脂肪酸組成?Table 2 Fatty acids composition of different high DHA yield Schizochytrium mutants (n=3) %
? w:原始菌株;mEMS:EMS誘變菌株;mARTP:ARTP誘變菌株;mEA:EMS-ARTP復合誘變菌株。
2.4 高產誘變株遺傳穩定性
將3種誘變方法獲得的高產DHA誘變株進行連續傳代培養,考察其遺傳的穩定性,結果見圖3。經過5代的傳代培養,EMS誘變高產株和ARTP誘變高產株的發酵指標都出現了一定程度的退化,而復合誘變高產株的發酵指標保持相對穩定,其DHA含量為42.2%~43.3%,DHA產量為7.0~7.2 g/L,與一代菌無明顯差異,遺傳穩定性良好。
2.5 誘變方法對裂殖壺菌誘變機理
由3種誘變方法對裂殖壺菌的誘變結果分析可知,EMS產生的誘變效果弱于ARTP,而復合誘變的效果最好。EMS具有烷化DNA堿基的機理,可引發嘌呤和嘧啶轉換[22]。在本試驗中,EMS誘變高產株的含油量高于出發菌株,但DHA占總脂肪酸的相對含量與出發菌相比相差不大,說明其脂肪酸合成能力得到了提升,但DHA合成的特定代謝途徑并未增強。
ARTP誘變為新型的誘變育種方法,它集合了質量、能量和電荷等損傷因素,產生不同的DNA損傷機制,遺傳多樣性更豐富[31]。Umu-test顯示ARTP對基因的損傷能力遠高于UV和常規化學誘變方法[32]。ARTP輻射的高活性粒子溫度接近室溫,不會對菌體產生熱致死效應。在本試驗中,將ARTP誘變技術應用于裂殖壺菌選育高產DHA菌株,取得了良好的效果,正突變率遠遠高于負突變率。通過發酵數據和脂肪酸組成的分析可以發現,ARTP高產株的含油量和DHA產量明顯提升,而且脂肪酸組成中PKS產物也有了相應的提升,說明誘變株在合成脂肪酸前體物質的相關合成基因和PKS途徑的特定基因都有可能發生了變異。
考慮到裂殖壺菌復雜的脂肪酸合成途徑,單點或少數幾個點的誘變往往不能對DHA的產量產生顯著、穩定的改變。將化學誘變和物理誘變相結合,對裂殖壺菌進行EMS-ARTP復合誘變,誘變機制更多樣,突變位點更豐富,獲得DHA高產菌的概率也更大。通過EMS-ARTP復合誘變得到的高產菌株,DHA產量達到7.2 g/L。李慧玲等[33]采用DES-UV復合誘變結合丙二酸、碘乙酸聯合篩選,得到誘變菌株XN001,其DHA產量為5.5 g/L;許永等[34]采用紫外誘變和喹禾靈篩選的方法,篩得的菌株OUC007,其DHA產量為1.2 g/L;袁軍等[35]通過ARTP誘變與強氧化劑施壓篩選得到的菌種D32,其DHA產量達到7.3 g/L。通過本試驗的誘變方法篩選得到的高產誘變菌株,在未使用任何篩選試劑的情況下,已獲得較高DHA產量。該產量與近期報道的相同菌種、相同發酵規模的數據相比,已十分具有競爭力(表3)。后期經過合適的篩選方法和發酵培養優化后,有望進一步提高DHA生產能力。

表3 不同破囊壺菌DHA產量和DHA含量比較Table 3 Comparative results of DHA production and percentage among different studies by thraustochytrids
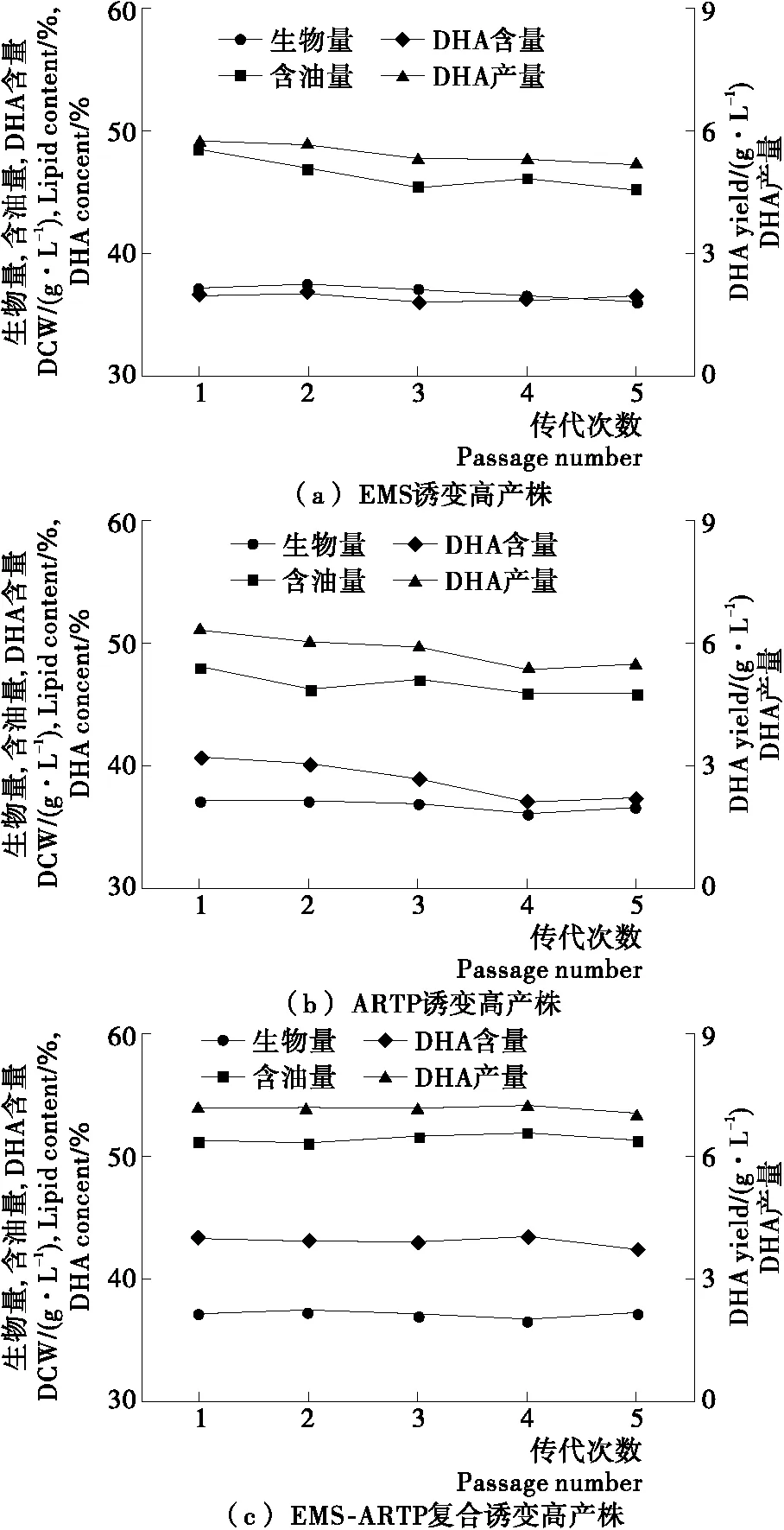
圖3 高產誘變株傳代次數對發酵指標的影響Figure 3 Effects ofculture passages on fermentation performance of high DHA yield Schizochytrium mutants
3 結論
將EMS-ARTP復合誘變的方法應用于裂殖壺菌誘變選育高產DHA菌株,并對復合誘變獲得的DHA高產菌株與單因子誘變高產菌株進行比較分析得出,EMS-ARTP復合誘變高產菌株無論在DHA產量還是在遺傳穩定性上,都優于單因子誘變。再加上后期的理性篩選技術及定向施壓培養的應用,有望進一步提高裂殖壺菌合成DHA的產率,繼而提高工業化生產DHA的效能。
[1] 中國科學院.能源科技領域發展觀察[M].北京: 科學出版社, 2016: 303-315.
[2] REN Lu-jing, SUN Xiao-man, JI Xiao-jun, et al.Enhancement of docosahexaenoic acid synthesis by manipulation of antioxidant capacity and prevention of oxidative damage inSchizochytriumsp[J].Bioresource Technology, 2017, 223: 141-148.
[3] D'ELISEO D, VELOTTI F.Omega-3 fatty acids and cancer cell cytotoxicity: implications for multi-targeted cancer therapy[J].J Clin Med, 2016, 5(2): 15-43.
[4] HADLEY K B, BAUER J, MILGRAM N W.The oil-rich algaSchizochytriumsp.as a dietary source of docosahexaenoic acid improves shape discrimination learning associated with visual processing in a canine model of senescence[J].Prostaglandins, Leukotrienes, and Essential Fatty Acids, 2017, 118: 10-18.
[5] JIANG Yue, FAN King-wai, WONG Rsz-yeung, et al.Fatty acid composition and squalene content of the marine microalgaSchizochytriummangrovei[J].Journal of Agricultural and Food Chemistry, 2004, 52(5): 1 196-1 200.
[6] HAUVERMALE A, KUNER J, ROSENZWEIG B, et al.Fatty acid production inSchizochytriumsp.: Involvement of a polyunsaturated fatty acid synthase and a type I fatty acid synthase[J].Lipids, 2006, 41(8): 739-747.
[7] GAUNT L F, BEGGS C B, GEORGHIOU G E.Bactericidal action of the reactive species produced by gas-discharge nonthermal plasma at atmospheric pressure: A review[J].Ieee Transactions on Plasma Science, 2006, 34(4): 1 257-1 269.
[8] REN Lu-jing, SUN Li-na, ZHUANG Xiao-yan, et al.Regula-tion of docosahexaenoic acid production bySchizochytriumsp.: effect of nitrogen addition[J].Bioprocess and Biosystems Engineering, 2014, 37(5): 865-872.
[9] SINGH D, BARROW C J, PURI M, et al.Combination of calcium and magnesium ions prevents substrate inhibition and promotes biomass and lipid production in thraustochytrids under higher glycerol concentration[J].Algal Research-Biomass Biofuels and Bioproducts, 2016, 15: 202-209.
[10] GANUZA E, ANDERSON A J, RATLEDGE C.High-cell-density cultivation ofSchizochytriumsp.in an ammonium/pH-auxostat fed-batch system[J].Biotechnology Letters, 2008, 30(9): 1 559-1 564.
[11] ZHAO Ben, LI Ya-fei, MBIFILE M D, et al.Improvement of docosahexaenoic acid fermentation fromSchizochytriumsp.AB-610 by staged pH control based on cell morphological changes[J].Engineering in Life Sciences, 2017, 17(9): 981-988.
[12] CHANG Gui-fang, WU Juan, JIANG Cui-hong, et al.The relationship of oxygen uptake rate and k(L)a with rheological properties in high cell density cultivation of docosahexaenoic acid bySchizochytriumsp.S31[J].Bioresource Technology, 2014, 152: 234-240.
[13] LEWIS K D, HUANG Wei-feng, ZHENG Xiao-hui, et al.Toxicological evaluation of arachidonic acid (ARA)-rich oil and dcosahexaenoic acid (DHA)-rich oil[J].Food and Chemical Toxicology, 2016, 96: 133-144.
[14] QU Liang, JI Xiao-jun, REN Lu-jing, et al.Enhancement of docosahexaenoic acid production bySchizochytriumsp.using a two-stage oxygen supply control strategy based on oxygen transfer coefficient[J].Letters in Applied Microbiology, 2011, 52(1): 22-27.
[15] HUANG Ting-yen, LU Wen-chang, CHU I-ming.A fermentation strategy for producing docosahexaenoic acid in AurantiochytriumlimacinumSR21 and increasing C22:6 proportions in total fatty acid[J].Bioresource Technology, 2012, 123: 8-14.
[16] JI Xiao-jun, MO Kai-qiang, REN Lu-jing, et al.Genome sequence ofSchizochytriumsp.CCTCC M209059, an effective producer of docosahexaenoic acid-rich lipids[J].Genome Announc, DOI: 10.1128/genomeA.00819-15.
[17] METZ J G, ROESSLER P, FACCIOTTI D, et al.Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes[J].Science, 2001, 293(5 528): 290-293.
[18] REN Lu-jing, ZHUANG Xiao-yan, CHEN Sheng-lan, et al.Introduction of omega-3 desaturase obviously changed the fatty acid profile and sterol content ofSchizochytriumsp[J].Journal of Agricultural and Food Chemistry, 2015, 63(44): 9 770-9 776.
[19] YAN Jin-fei, CHENG Ru-bin, LIN Xiang-zhi, et al.Overexpression of acetyl-CoA synthetase increased the biomass and fatty acid proportion in microalgaSchizochytrium[J].Applied Microbiology and Biotechnology, 2013, 97(5): 1 933-1 939.
[20] 崔清志, 劉曉虹, 陳惠明.EMS誘變技術研究進展[J].湖南農業科學, 2013(5): 7-9, 13.
[21] 敬樊, 王亮明, 武軍, 等.利用甲基磺酸乙酯(EMS)誘導小麥-華山新麥草染色體易位的研究[J].農業生物技術學報, 2015(5): 561-570.
[22] 降云峰, 劉永忠, 李萬星, 等.甲基磺酸乙酯誘變技術在大豆育種上的應用[J].園藝與種苗, 2012(6): 12-15.
[23] ZHANG Xue, ZHANG Xiao-fei, LI He-ping, et al.Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool[J].Applied Microbiology and Biotechnology, 2014, 98(12): 5 387-5 396.
[24] 張雪, 張曉菲, 王立言, 等.常壓室溫等離子體生物誘變育種及其應用研究進展[J].化工學報, 2014(7): 2 676-2 684.
[25] 任少雄, 王丹.植物理化復合誘變育種技術研究進展[J].安徽農業科學, 2009(20): 9 345-9 349.
[26] DARLEY W M, PORTER D, FULLER M S.Cell wall composition and synthesis via Golgi-directed scale formation in the marine eucaryote,Schizochytriumaggregatum, with a note on Thraustochytrium sp[J].Archiv Für Mikrobiologie, 1973, 90(2): 89-106.
[27] 呂小義, 付杰, 尹佳, 等.高產DHA裂壺藻突變株的選育[J].中國釀造, 2015(4): 106-109.
[28] 梁園梅, 劉瑛, 李晶晶, 等.高產DHA破囊壺菌Aurantiochytriumsp.PKU#SW7誘變株的篩選[J].微生物學通報, 2016(2): 457-464.
[29] 羅瑋, 顧秋亞, 鐘湘南, 等.1種快速檢測微藻油脂的新方法[J].食品與發酵工業, 2014(12): 165-168.
[30] FU Jie, CHEN Tao, LU Hao, et al.Enhancement of docosahexaenoic acid production by low-energy ion implantation coupled with screening method based on Sudan black B staining inSchizochytriumsp[J].Bioresource Technology, 2016, 221: 405-411.
[31] LI He-ping, WANG Zhi-bin, GE Nan, et al.Studies on the physical characteristics of the radio-frequency atmospheric-pressure glow discharge plasmas for the genome mutation of methylosinustrichosporium[J].Ieee Transactions on Plasma Science, 2012, 40(11): 2 853-2 860.
[32] ODA Y, NAKAMURA S, OKI I, et al.Evaluation of the new system (umu-test) for the detection of environmental mutagens and carcinogens[J].Mutation Research, 1985, 147(5): 219-229.
[33] 李慧玲, 劉永梅.誘變選育高產DHA裂殖壺菌突變株[J].食品科技, 2015(9): 12-16.
[34] 許永, 臧曉南, 徐滌, 等.裂殖壺菌誘變篩選的研究[J].中國海洋大學學報:自然科學版, 2012(12): 54-58.
[35] 袁軍, 趙犇, 孫夢玉, 等.常壓室溫等離子體(ARTP)誘變快速選育高產DHA的裂殖壺菌突變株[J].生物技術通報, 2015(10): 199-204.
[36] CHEN Wei, ZHOU Peng-peng, ZHU Yuan-min, et al.Improvement in the docosahexaenoic acid production ofSchiz-ochytriumsp.S056 by replacement of sea salt[J].Bioprocess and Biosystems Engineering, 2016, 39(2): 315-321.
[37] CHANG Gui-fang, GAO Ni-si, TIAN Gui-wei, et al.Improvement of docosahexaenoic acid production on glycerol bySchizochytriumsp S31 with constantly high oxygen transfer coefficient[J].Bioresource Technology, 2013, 142: 400-406.

