小凹蛋白-1調控表皮生長因子受體活化對惡性黑色素瘤細胞生物學行為的影響
張玫瑩,朱鐵年,趙瑞景,崔玉潔,范 婧
惡性黑色素瘤是起源于胚胎期神經嵴的惡性腫瘤,惡性程度高,預后較差,發病率為全部惡性腫瘤的1%~3%,且呈上升趨勢。手術、放療、化療一直是惡性黑色素瘤治療的主要方法,但其對于放療和化療并不敏感。近年來,隨著黑色素瘤相關突變基因的發現與深入研究,分子靶向藥物為其治療帶來了新的希望。因此,探索更多的有效靶點成為治療的關鍵。表皮生長因子(epidermal growth factor, EGF)和表皮生長因子受體(epidermal growth factor receptor, EGFR)可參與正常細胞和異常細胞的增殖、遷移和存活。目前有研究證明,在人類多種腫瘤中均可發現EGFR過表達現象,且EGFR的表達水平與治療效果差、疾病惡化快及存活率低有關[1-4]。小凹蛋白-1(caveolin-1, Cav-1)是分子量為21~24 KDa的膜內在蛋白,是膜內陷囊泡的重要標志性結構蛋白。Cav-1由178個氨基酸殘基組成,位于肽鏈中的疏水殘基(102-134)在膜結構上形成特殊的發卡樣結構,將Cav-1蛋白分成N端及C端兩個區域,其中N端為主要的功能區域,該區域通過與EGFR相連接,從而調控EGFR酪氨酸激酶的活性。研究顯示Cav-1可在膀胱癌等細胞系中發揮抗腫瘤作用[5],而其通過調控EGFR在惡性黑色素瘤細胞中發揮作用的研究尚未見報道。本研究以惡性黑色素瘤M2細胞為研究對象,旨在探討過表達Cav-1后對M2細胞生物學行為的影響,并進一步探討其可能的作用機制及影響的信號通路,為惡性黑色素瘤的治療提供理論基礎。現報告如下。
1 材料與方法
1.1材料
1.1.1細胞來源:惡性黑色素瘤M2細胞系由美國國立衛生研究院老年病研究所Michel Bernier教授惠贈。
1.1.2試劑:Cav-1質粒、pcDNA3.1陰性對照質粒(本實驗室保存);G418(美國Amresco公司);MEM培養基(美國Gibco公司);胎牛血清(以色列BI公司);Human EGF(美國Sigma公司);MTS(美國Promega公司);p-EGFR、Akt、p-Akt單克隆抗體(美國Cell Signaling technology公司)、EGFR、Cav-1、β-actin單克隆抗體(美國Santa Cruz公司);辣根過氧化物酶標記羊抗兔IgG、辣根過氧化物酶標記羊抗鼠IgG(美國Proteintech Group公司);ECL超敏發光液(碧云天生物技術公司)。
1.1.3儀器:CO2培養箱(美國Thermo公司);倒置顯微鏡(日本Olympus公司);低溫高速離心機(美國Thermo公司);酶標儀(美國Thermo公司);超低溫冰箱(美國Thermo公司);24孔Transwell小室、96、24、6孔細胞培養板(美國Corning公司)。
1.2方法
1.2.1細胞培養:惡性黑色素瘤M2細胞用含10% FBS的MEM培養基培養,置于37℃、5% CO2、飽和濕度無菌培養箱中常規培養,選取對數生長期的細胞進行進一步實驗。
1.2.2質粒轉染:培養低表達Cav-1的M2細胞至60%~80%融合,分別轉染pcDNA3.1陰性對照質粒和Cav-1質粒。48 h后加入G418進行抗性篩選。蛋白免疫印跡(Western blot)法驗證Cav-1表達情況。
1.2.3MTS檢測細胞增殖情況:培養M2(pcDNA3.1)和M2(Cav-1)細胞,無胎牛血清培養基饑餓4 h,分別加入濃度為0、4、20和100 nmol/L的EGF溶液,培養44 h,棄去舊培養基,按MTS 20 μl/孔與MEM培養液100 μl/孔混勻,每孔加入120 μl,避光操作。酶標儀上檢測490 nm波長處各孔的吸光度(OD值)。記錄并分析數據。此實驗重復3次。
1.2.4細胞劃痕實驗檢測細胞劃痕治愈率:培養M2(pcDNA3.1)和M2(Cav-1)細胞,無胎牛血清培基饑餓4 h,以20 nmol/L EGF刺激。每5小時用倒置顯微鏡觀察劃痕愈合情況,并拍照,直至其愈合。使用測量軟件分別測量各組細胞各個時間點劃痕愈合的寬度,并以起始寬度為1,計算其他各時間點劃痕相對寬度值,統計分析結果。此實驗重復3次。
1.2.5Transwell小室遷移實驗檢測細胞遷移能力:制備基質膠工作液,均勻鋪于Transwell小室濾膜上層底部,將處于對數生長期的M2(pcDNA3.1)和M2(Cav-1)細胞接種于Transwell小室上室,置于37℃、5% CO2培養箱中培養24 h。取出Transwell小室,擦除濾膜上層基質膠,95%乙醇固定30 min,常規HE染色。光鏡拍照,統計穿膜細胞數,以M2(pcDNA3.1)細胞的穿膜細胞數為1,計算各組細胞的穿膜細胞相對值,統計分析結果。此實驗重復3次。
1.2.6Western blot檢測蛋白表達水平:培養M2(pcDNA3.1)和M2(Cav-1)細胞,終濃度為20 nmol/L EGF無血清培養基分別培養0、5、10、30 min。提取各組總蛋白,煮沸變性。將蛋白樣品等體積上樣,在8%分離膠及5%濃縮膠中進行電泳,在轉膜緩沖液中將膠上的蛋白轉印到PVDF膜上。孵育抗體,分別檢測M2(pcDNA3.1)和M2(Cav-1)細胞中EGFR、p-EGFR、ERK、p-ERK、Cav-1和β-actin的蛋白表達水平,測量灰度值,分別計算各組細胞p-EGFR、p-Akt和p-ERK占總EGFR、Akt和ERK的相對值,統計結果并分析。此實驗重復3次。
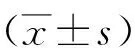
2 結果
2.1穩定轉染細胞株中Cav-1蛋白的表達水平 M2、M2(pcDNA3.1)和M2(Cav-1)細胞中Cav-1表達量的相對灰度值分別是1.00、0.83±0.08和2.01±0.21。與M2和M2(pcDNA3.1)相比,M2(Cav-1)質粒轉染組細胞Cav-1蛋白表達明顯增高(P<0.01)。見圖1。

圖1 過表達Cav-1 M2細胞系的構建
2.2過表達Cav-1對M2細胞增殖的影響 在終濃度分別為0、4、20、100 nmol/L EGF刺激下,M2(pcDNA3.1)細胞增殖能力分別為0.92±0.03、1.03±0.11、1.10±0.10、1.22±0.09,M2(Cav-1)細胞增殖能力分別為0.63±0.05、0.73±0.06、0.80±0.02、0.89±0.03。M2(Cav-1)細胞增殖能力低于M2(pcDNA3.1)細胞(P<0.01)。
2.3過表達Cav-1對M2細胞遷移的影響 在無EGF刺激條件下,5、10、15 h均可見M2(Cav-1)細胞劃痕愈合速度較慢,其劃痕愈合的相對寬度值分別為0.92±0.03、0.81±0.05、0.65±0.01,M2(pcDNA3.1)細胞劃痕愈合的相對寬度值分別為0.72±0.02、0.57±0.03、0.34±0.04。M2(Cav-1)細胞劃痕愈合的相對寬度值大于M2(pcDNA3.1)細胞(P<0.01)。當存在EGF刺激條件下,M2(Cav-1)細胞在5、10、15 h劃痕愈合速度同樣慢于M2(pcDNA3.1)細胞,M2(Cav-1)細胞劃痕相對寬度分別為0.82±0.03、0.73±0.02、0.46±0.03,M2(pcDNA3.1)細胞分別為0.63±0.03、0.42±0.02、0。M2(Cav-1)細胞劃痕相對寬度大于M2(pcDNA3.1)細胞(P<0.01)。見圖2。
2.4過表達Cav-1對M2細胞侵襲的影響 M2(pcDNA3.1)細胞穿過Transwell小室濾膜的細胞相對值為1.00,M2(Cav-1)細胞為0.59±0.08。與M2(pcDNA3.1)細胞相比,M2(Cav-1)細胞侵襲能力減弱(P<0.01)。見圖3。

圖2 不同時點Cav-1對M2細胞遷移能力的影響(×100)
2.5過表達Cav-1 在M2細胞中對配體誘導的EGFR信號通路的影響 選取M2(pcDNA3.1)細胞和M2(Cav-1)細胞,采用Western blot檢測EGF刺激5、10、30 min后p-EGFR、p-Akt以及p-ERK水平。分別提取M2(pcDNA3.1)和M2(Cav-1)細胞總蛋白,用Cav-1抗體檢測證實M2(Cav-1)細胞中Cav-1表達量明顯升高,為進一步分析Cav-1在EGFR信號通路中的作用提供依據。分別用抗磷酸化EGFR、Akt及ERK抗體檢測M2(pcDNA3.1)和M2(Cav-1)細胞總蛋白。見圖4。在有EGF刺激的條件下,M2(Cav-1)細胞5、10、30 min磷酸化EGFR、Akt和ERK相對值均明顯低于M2(pcDNA3.1)細胞(P<0.01)。見表1。

圖3Cav-1對M2細胞侵襲能力的影響(HE×200)
3 討論
Cav-1作為一種多功能跨膜支架蛋白,存在于多種細胞類型中,參與細胞吞飲、膽固醇轉運、細胞膜組裝、信號跨膜轉導等細胞生命活動[6-7]。其中,Cav-1涉及細胞惡性轉化等方面的生物學行為,一直備受關注[8-10]。目前已有研究表明,腫瘤的增殖與遷移可由細胞內Cav-1表達量的下降引起。同時,Cav-1的缺失有可能影響其作為抑癌因子發揮作用時調控的信號通路[11]。在多種腫瘤中,如乳腺癌[12]、子宮頸癌[13]、胃癌[14-15]等均可發現,Cav-1表達量較正常組織明顯下調,被認為有抑制腫瘤發展和轉移的作用,是一種潛在抑癌基因。但在有關前列腺癌的研究中卻發現,Cav-1可以促進細胞的增殖、侵襲與轉移[16-17]。由此可見,Cav-1在不同組織腫瘤中的表達存在較大的差異,既可促進腫瘤的生長,又可抑制其發生、發展。然而,有關Cav-1在惡性黑色素瘤中的具體作用尚未得到明確闡述。
Cav-1基因位于D7S522和D7S2460的中間,定位于7q31.1。在許多人類惡性腫瘤中,Cav-1基因經常在7號染色體的這個位點發生突變或缺失。國內大量研究認為CSD介導了Cav-1的腫瘤抑制作用,而Cav-1的促進腫瘤發生作用可能與生長因子誘導Cav-1的酪氨酸和絲氨酸磷酸化以及膽固醇結合到Cav-1基因啟動子上引起的Cav-1表達上調有關。本實驗通過質粒轉染技術建立了過表達Cav-1的惡性黑色素瘤M2細胞株,并進行了MTS、劃痕愈合、Transwell等試驗,結果顯示過表達Cav-1可使細胞增殖、遷移、侵襲能力下降。

圖4惡性黑色素瘤細胞中過表達Cav-1對磷酸化EGFR、Akt、ERK活化水平的影響
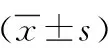
表1 惡性黑色素瘤細胞中過表達Cav-1對磷酸化EGFR、Akt、ERK表達水平的影響
注:與對照組比較,bP<0.01
有研究證明,腫瘤細胞侵襲轉移的各個階段均與腫瘤細胞的跨膜機制密切相關,特別是通過影響EGFR及其下游的信號傳遞發揮調控作用。EGFR是細胞膜表面的糖蛋白受體,屬于ErbB受體家族,是酪氨酸受體家族的成員之一,有配體結合區、跨膜區和胞內區3個部分。胞內區的受體酪氨酸激酶(receptor tyrosinekinase, RTK)系統是其發揮作用的主要部位[18]。EGFR在未激活時是以單體形式存在的,而當其與配體結合后,即可形成同源、異源二聚體,從而激活RTK,提高了受體胞內區酪氨酸殘基的自身磷酸化水平,進一步激活下游信號通路。其下游信號主要包括MAPK/ERK、PI3K/AKT、STAT3等通路。其中,MAPK/ERK、PI3K/Akt信號轉導通路是細胞內兩條重要的存活及抗凋亡信號通路。Zhang等[19]研究認為,EGFR的表達與惡性黑色素瘤的發生、發展密切相關。本研究發現過表達Cav-1可使惡性黑色素瘤M2細胞中的p-EGFR、p-ERK以及p-Akt蛋白水平明顯下降。提示Cav-1可能通過抑制MAPK/ERK、PI3K/Akt信號通路發揮作用。
綜上所述,本實驗通過分析Cav-1與EGFR及其信號通路分子之間的關系,進一步闡明了Cav-1在惡性黑色素瘤中的作用機制。實驗結果顯示Cav-1可能通過抑制MAPK/ERK、PI3K/Akt信號通路影響惡性黑色素瘤細胞M2的生物學行為。說明Cav-1可能成為惡性黑色素瘤治療的潛在靶點,而其具體機制有待于進一步研究。
[參考文獻]
[1] Oliveira-Cunha M, Hadfield K D, Siriwardena A K,etal. EGFR and KRAS mutational analysis and their correlation to survival in pancreatic and periampullary cancer[J].Pancreas, 2012,41(3):428-434.
[2] Hwangbo W ,Lee J H, Ahn S,etal. EGFR gene amplification and protein expression in invasive ductal carcinoma of the breast[J].Korean J Pathol, 2013,47(2):107-115.
[3] Kalman B, Szep E, Garzuly F,etal. Epidermal growth factor receptor as a therapeutic target in glioblastoma[J].Neuromolecular Med, 2013,15(2):420-434.
[4] Shan Z Z, Chen P N, Wang F,etal. Expression of p-EGFR and p-Akt protein in esophageal squamous cell carcinoma and its prognosis[J].Oncol Lett, 2017,14(3):2859-2863.
[5] 袁淵,羅婷婷,姚啟盛,等.沉默Caveolin-1基因對膀胱癌細胞增殖和凋亡的影響[J].醫學臨床研究,2014,31(12):2358-2360.
[6] Yang H, Guan L, Li S,etal. Mechanosensitive caveolin-1 activation-induced PI3K/Akt/mTOR signaling pathway promotes breast cancer motility, invadopodia formation and metastasis in vivo[J].Oncotarget, 2016,7(13):16227-16247.
[7] Sowa G. Caveolae, Caveolins, Cavins, and Endothelial Cell Function: New Insights[J].Front Physiol, 2012,6(2):120.
[8] Wang S, Wang N, Zheng Y,etal. Caveolin-1: An Oxidative Stress-Related Target for Cancer Prevention[J].Oxid Med Cell Longev, 2017,2017:7454031.
[9] Nwosu Z C, Ebert M P, Dooley S,etal. Caveolin-1 in the regulation of cell metabolism: a cancer perspective[J].Mol Cancer, 2016,15(1):71.
[10] Mahmood J, Zaveri S R, Murti S C,etal. Caveolin-1: a novel prognostic biomarker of radioresistance in cancer[J].Int J Radiat Biol, 2016,92(12):747-753.
[11] Quest A F, Lobos-González L, Nuez S,etal. The Caveolin-1 connection to cell death and survival[J].Curr Mol Med, 2013,13(2):266-281.
[12] 王善偉,徐侃倫,趙莉莉,等.Caveolin-1在乳腺浸潤性導管癌間質內癌相關成纖維細胞中的表達水平與乳腺癌分子亞型的相關性[J].臨床腫瘤學雜志,2012,17(6):511-515.
[13] Sun J, Gao J, Hu J B,etal. Expression of Cav-1 in tumour cells, rather than in stromal tissue, may promote cervicalsquamous cell carcinoma proliferation, and correlates with high-risk HPV infection[J].Oncol Rep, 2012,27(6):1733-1740.
[14] Zhang Y, Hu X J, Zhang L L,etal. Interaction among Caveolin-1 genotypes (rs3807987/rs7804372), H. pylori infection, and risk of gastric cancer in a Chinese population[J].Tumour Biol, 2014,35(2):1511-1516.
[15] Zhao X, He Y, Gao J,etal. Caveolin-1 expression level in cancer associated fibroblasts predicts outcome in gastric cancer[J].PLoS One, 2013,8(3):e59102.
[16] Ayala G, Morello M, Frolov A,etal. Loss of caveolin-1 in prostate cancer stroma correlates with reduced relapse-free survival and is functionally relevant to tumour progression[J].J Pathol, 2013,231(1):77-87.
[17] Kuo S R, Tahir S A, Park S,etal. Anti-caveolin-1 antibodies as anti-prostate cancer therapeutics[J].Hybridoma (Larchmt), 2012,31(2):77-86.
[18] 唐夏莉,焦德敏,陳君,等.miRNA-126對肺癌A549細胞的增殖、遷移、侵襲及EGFR/AKT/mTOR信號通路的影響[J].中國病理生理雜志,2016,32(3):458-463.
[19] Zhang K, Zhu T, Gao D,etal. Filamin A expression correlates with proliferation and invasive properties of human metastaticmelanoma tumors: implications for survival in patients[J].J Cancer Res Clin Oncol, 2014,140(11):1913-1926.

