川芎嗪對大鼠肝星狀細胞系HSC-T6自噬的影響
謝 鵬,薛 改,劉建芳
肝硬化是多種慢性肝病發展的晚期階段,病理方面以肝臟彌漫性纖維化、再生結節和假小葉形成為特征[1]。在全球范圍的年發病率為100/10萬,發病高峰年齡在35~50歲,合并并發癥時病死率高,嚴重威脅患者的生命健康[2]。肝纖維化具有一定的可逆性,可以施加部分手段進行干預,阻止其發展成肝硬化,同時防止肝纖維化也是防止肝癌的重要突破點。有研究發現細胞自噬在肝纖維化中出現增多,細胞自噬可以增強肝細胞活化和肝纖維化發生程度,且自噬可以通過降解脂滴為肝細胞活化提供能量[3]。有實驗研究表明,抑制自噬可抑制肝細胞前膠原mRNA的表達及肝細胞株的增殖[4]。因此通過調節自噬水平可能成為防止肝纖維化的新靶點。最新研究發現,川芎嗪可降低血清Ⅲ型前膠原、透明質酸、層粘連蛋白水平,延緩肝纖維化形成,且能夠抑制肝纖維化大鼠干細胞凋亡,進而抑制肝細胞激活,減少轉化生長因子-β1(RGF-β1)的分泌[5]。有報道川芎嗪對抑制、減輕肝纖維化有一定療效,但是川芎嗪對活化肝細胞株自噬作用是否有影響未見報道,因此本實驗使用不同濃度的川芎嗪對活化肝細胞株HSC-T6進行干預,利用MDC染色法結合熒光顯微鏡觀察肝細胞株HSC-T6中自噬溶酶體的形態改變,檢測肝細胞株HSC-T6中自噬信號蛋白的表達,研究其對肝細胞株HL7702自噬的影響,為將來篩選肝纖維化的中藥研究積累資料。
1 材料與方法
1.1細胞株與主要試劑 正常大鼠肝星狀細胞系HSC-T6購自武漢大學細胞中心。細胞培養條件:含10%胎牛血清的RPMI 1640,37℃,5% CO2條件下培養。胎牛血清,RPMI 1640培養基均購自HyClone公司。MDC試劑盒購于碧云天生物有限公司。ATG5、beclin1、LC3Ⅱ兔單克隆抗體均購自Abcam(ab108327、ab207612、ab51520)。
1.2平板克隆實驗 使用常規培養的肝星狀細胞系HSC-T6經胰酶消化后,1200 r/min,3 min,棄去上清液。加入5 ml的無菌PBS溶液,輕輕吹散洗滌細胞沉淀并再次離心。反復洗滌3次后加入培養基,制備成單細胞懸液。測定細胞濃度并調整為1000個/ml,將單細胞懸液均勻的種植在無菌6孔板內,進行平板克隆實驗。2周后觀察平板克隆細胞形成情況。
1.3MDC染色 使用去離子水稀釋Wash buffer,1000 r/min離心5 min收集細胞,使用Wash buffer洗滌細胞,介入適量的Wash buffer重懸細胞,計數并調節細胞濃度到1×106個/ml。取適量細胞懸液到新EP管中,加入MDC染色,輕輕混勻。室溫避光染色,離心收集細胞,清洗細胞2次,棄上清。滴加于載玻片,加蓋玻片,熒光顯微鏡下觀察并拍照。
1.4蛋白免疫印跡法(Western blotting)檢測自噬相關蛋白 在培養瓶中加入適量細胞裂解液,提取細胞蛋白,低溫保存待用。配制15% SDS-PAGE,樣品孔上樣25 μl,于80 V恒壓40 min,120 V恒壓60 min,使用濕轉法電轉至PVDF膜,使用5%脫脂奶粉封閉2 h于搖床上,一抗(ATG5,beclin1,LC3Ⅱ,濃度1∶2000)孵化,4℃過夜;二抗室溫孵育2 h;ECL發光。實驗重復3次。
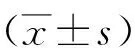
2 結果
2.1不同濃度川芎嗪對肝星狀細胞系HSC-T6影響 不同濃度川芎嗪對肝星狀細胞系HSC-T6中ATG5蛋白影響水平不同,25 ng/ml是川芎嗪作用于肝星狀細胞系HSC-T6最佳濃度(圖1)。結合以上結果,后續實驗我們采取25 ng/ml濃度進行。
2.2川芎嗪對大鼠肝星狀細胞系HSC-T6增殖作用的影響 對照組平板克隆實驗形成的細胞球數目為179.2±7.4,川芎嗪組為42.6±2.9。川芎嗪組平板克隆實驗形成的細胞球數目少于對照組,差異有統計學意義(P<0.05)。
2.3大鼠肝星狀細胞系HSC-T6中自噬溶酶體的形態改變 相對對照組,川芎嗪組大鼠肝星狀細胞系HSC-T6出現明顯的點狀聚集,亮度增加,自噬體降解數量明顯增加。見圖2。

圖1不同濃度川芎嗪對大鼠肝星狀細胞系HSC-T6自噬功能的影響

圖2川芎嗪對大鼠肝星狀細胞系HSC-T6自噬溶酶體的影響
2.4川芎嗪對自噬信號分子蛋白ATG5、beclin1、LC3Ⅱ表達的影響 加入25 ng/ml的川芎嗪后,大鼠肝星狀細胞系HSC-T6 ATG5、beclin1及LC3Ⅱ表達水平為(18.16±1.36) %、(82.94±5.93)%及(76.54±9.19)%,對照組表達水平分別為(86.12±3.42)%、(22.72±2.86)%和(16.43±3.8)%。川芎嗪組大鼠肝星狀細胞系HSC-T6 ATG5表達水平低于對照組,beclin1及LC3Ⅱ表達水平高于對照組(P<0.05)。見圖3。

圖32組大鼠肝星狀細胞系HSC-T6中自噬蛋白的變化水平
3 討論
肝纖維化是慢性肝臟疾病導致的過度損傷修復的過程[6]。在這個過程中,肝細胞外基質成分過多的沉積在肝內引起肝纖維化[7]。肝臟損傷后導致位于肝竇狀隙內的肝細胞活化并分化為肌成纖維細胞,其細胞形態發生改變,細胞明顯增殖并分泌大量細胞活化因子及細胞外基質,導致肝纖維化[8]。
自噬是通過自我清除體內無用的累積蛋白質聚集物和有缺陷的細胞器等,維持細胞內環境穩態[9]。在受到外界環境刺激,細胞通過提高自噬水平,將胞漿內組分分解為游離氨基酸、脂肪酸和核苷酸,維持細胞能量代謝[10]。劉曼等[11]報道自噬和肝星狀細胞系HSC-T6活化有關。Salemi等[12]也發現在肝星狀細胞系HSC-T6活化過程中,代表自噬溶酶體的紅色斑點增加,說明自噬流量增加。乙型或丙型肝炎病毒利用自噬促進病毒復制[13]。在酒精性肝損害中,抑制自噬水平有助于清除沉積的無功能大分子蛋白[14]。根據不同疾病自噬作用,通過調節自噬水平有助于疾病轉歸及預防肝纖維化形成。
川芎嗪具有抗血小板、使血小板解聚的作用,對心腦血管供血不足引起的各種癥狀有很好的緩解作用[15]。孫偉大等[16]發現川芎嗪能抑制肝纖維化大鼠細胞凋亡,進而抑制肝細胞株激活,從而改善肝纖維化。本實驗通過檢測不同濃度川芎嗪對活化肝星狀細胞系HSC-T6的作用,篩選出活化肝星狀細胞系HSC-T6最佳濃度為25 ng/ml,然后通過MDC染色顯示肝星狀細胞系HSC-T6內自噬溶酶體呈現膨脹狀態,有較多偽足,質膜相對不完整,表明該濃度川芎嗪可促進肝細胞自溶進程,加速自噬溶酶體破解。本研究結果顯示,川芎嗪組平板克隆實驗形成細胞球數目少于對照組,自噬體降解數量明顯增加,ATG5表達水平低于對照組,beclin1及LC3Ⅱ表達水平高于對照組。提示川芎嗪可抑制肝星狀細胞系HSC-T6增殖能力,加速自噬溶酶體降解過程,下調自噬蛋白表達水平。
綜上所述,川芎嗪可以抑制肝細胞的增殖,還可影響其自噬溶酶體的形態變化,其可以干擾肝纖維化發展至肝硬化的進程,有可能對肝纖維化的治療提供理論依據。
[參考文獻]
[1] 吳志勇,陳煒.肝硬化門靜脈高壓癥圍術期處理策略[J].中華消化外科雜志,2016,15(1):661-664.
[2] 漆德芳,孟申.肝硬化[M].北京:北京科學技術出版社,2000:530.
[3] Chen Y, Henson E S, Xiao W,etal. Tyrosine kinase receptor EGFR regulates the switch in cancer cells between cell survival and cell death induced by autophagy in hypoxia[J].Autophagy, 2016,12(6):1029-1046.
[4] Joffre C, Codogno P, Fanto M,etal. STK38 at the crossroad between autophagy and apoptosis[J].Autophagy, 2016,12(3):594-595.
[5] 賈建國.丹參川穹嗪對冠心病心絞痛的治療效果及對血漿內皮素與一氧化碳水平的影響[J].現代醫藥衛生,2016,32(10):1529-1530.
[6] Singh S, Venkatesh S K, Loomba R,etal. Magnetic resonance elastography for staging liver fibrosis in non- alcoholic fatty liver disease: a diagnostic accuracy systematic review and individual participant data pooled analysis[J].European radiology, 2016,26(5):1431-1440.
[7] 王美玲,陸倫根.肝纖維化治療研究進展[J].實用肝臟病雜志,2013,16(4):369-371.
[8] 陳永鵬,汪艷,侯金林.肝纖維化/肝硬化的動態變化及其診斷進展[J].中華肝臟病雜志,2015,23(4):244-246.
[9] Mowers E E, Sharifi M N, Macleod K F. Novel insights into how autophagy regulates tumor cell motility[J].Autophagy, 2016,12(9):1679-1680.
[10] Levine B, Klionsky D J. Autophagy wins the 2016 Nobel Prize in Physiology or Medicine: Breakthroughs in baker's yeast fuel advances in biomedical research[J].Proc Natl Acad Sci U S A, 2017,114(2):201-205.
[11] 劉曼,何月,張吉翔.自噬抑制劑3-甲基腺嘌呤對肝星狀細胞增殖活化的影響[J].細胞與分子免疫學雜志,2013,29(8):809-812,817.
[12] Salemi S, Yousefi S, Constantinescu M A,etal. Autophagy is required for self-renewal and differentiation of adult human stem cells[J].Cell Res, 2012,22(2):432-435.
[13] Rubinsztein D C, DiFiglia M, Heintz N,etal. Autophagy and its possible roles in nervous system diseases, damage and repair[J].Autophagy, 2005,1(1):11-22.
[14] Furuya N, Yu J, Byfield M,etal. The evolutionarily conserved domain of beclin 1 is required for VPS34 binding, autophagy and tumor suppressor function[J].Autophagy, 2005,1(1):46-52.
[15] 唐澤耀,王世龍,林原.川穹嗪在神經系統的藥代動力學及臨床藥效學應用研究進展[J].中國臨床藥理學雜志,2010,26(7):535-539.
[16] 孫偉大,張亮,張施工,等.鹽酸川穹嗪聯合復方甘草酸苷注射液與多烯磷脂酰膽堿注射液治療酒精性肝炎的療效觀察[J].臨床合理用藥,2012,5(24):67-68.

