康萊特注射液對人NK細胞功能作用研究
★ 黃挺 李小英(1.杭州市中醫(yī)院 杭州 310007;.浙江中醫(yī)藥大學 杭州 310053)
中醫(yī)學認為,薏苡仁味甘淡,性涼,主入脾、胃、肺經(jīng),具有健脾補肺、利水消腫、舒筋除痹、清熱排膿之功效。現(xiàn)代藥理研究表明,薏苡仁中含有脂肪酸及脂、多糖類化合物、氨基酸等,具有抗腫瘤,增強機體免疫,降血糖,抗炎鎮(zhèn)痛等藥理活性[1]。康萊特注射液(Kanglaite Injection,KLT)是從薏苡仁中提取、研制而成的供靜、動脈直接輸注的脂肪乳劑,主要成份為薏苡仁油,具有益氣養(yǎng)陰、消癥散結(jié)的作用,臨床上常聯(lián)合放化療或分子靶向藥物用于治療肺癌[2]、肝癌[3]、乳腺癌[4]、結(jié)直腸癌[5]等惡性腫瘤,具有增敏減毒,改善患者生活質(zhì)量,延長生存期,提高機體免疫力的功效。
自然殺傷細胞(Nature killer cell,NK細胞)是機體固有免疫系統(tǒng)的效應(yīng)細胞,形成了人體抗腫瘤和抗病毒感染的第一道防線[6],其殺傷靶細胞不需要預先致敏,且不受MHC限制,是一種安全有效的廣譜抗腫瘤細胞[7]。活化的NK細胞能夠直接溶解主要組織相容性復合體I(MHC-I)分子缺陷的腫瘤細胞,通過釋放穿孔素和顆粒酶B或抗體依賴性的細胞介導的細胞毒性作用(ADCC)直接殺傷腫瘤細胞等靶細胞,還可分泌腫瘤壞死因子α(TNF-α)、γ-干擾素(IFN-γ)等一系列促炎細胞因子,調(diào)節(jié)免疫反應(yīng)而殺傷腫瘤細胞[8-9]。康萊特注射液對人NK細胞的作用,國內(nèi)未見文獻報道。因此本實驗利用中藥制劑康萊特注射液體外誘導培養(yǎng)人NK細胞,旨在探討康萊特注射液對人NK細胞增殖活力、免疫表型及殺傷活性的影響,現(xiàn)將實驗結(jié)果報告如下。
1 材料和方法
1.1 試劑與儀器 肺癌A549細胞株由本實驗室RPMI1640培養(yǎng)液(內(nèi)含10%FBS)培養(yǎng);康萊特注射液購自浙江康萊特藥業(yè)有限公司;改良型RPMI-1640培養(yǎng)基購自賽默飛世爾生物化學制品(北京)有限公司;胎牛血清(FBS)購自浙江天杭生物科技有限公司;rhIL-2購自北京四環(huán)生物制藥有限公司;人源化CD3單抗購自妙通(上海)生物科技有限公司;CCK-8溶液購自上海碧云天生物技術(shù)有限公司;0.25%胰蛋白酶購自加拿大invitrogen公司;熒光標記抗體PE-CD3、PE-Cy7-CD56均購自美國eBioscince公司;人外周血淋巴細胞分離液(Ficoll)購自天津市灝洋生物制品科技有限公司;ELISA試劑盒(IFN-γ,TNF-α)購自上海華雅思創(chuàng)生物科技有限公司;Countstar自動細胞計數(shù)儀購自上海睿鈺生物科技有限公司;流式細胞儀購自美國Beckman Coulter公司;酶標儀Multiskan FC購自美國Thermo Scientific公司。
1.2 NK細胞的培養(yǎng)和擴增
1.2.1 外周抗凝血采集 選取健康志愿者及2016年3月—8月期間杭州市中醫(yī)院腫瘤科晚期肺癌(腺癌)患者各5例,分別采集肘靜脈血30mL,收集于含10mL肝素的抗凝瓶內(nèi)。
1.2.2 外周血單個核細胞(PBMC)的分離 預先將人淋巴細胞分離液Ficoll-Hypaque(密度1.077),加入兩支50mL無菌離心管,10mL每管。用生理鹽水將吸取血漿后的標本還原至40mL并充分混勻,緩慢加入在Ficoll-Hypaque上,分離液和血液樣本的體積比為1∶2,2000rpm離心20min,離心完畢,小心吸取白膜層的單個核細胞,加生理鹽水補足40mL,2000rpm離心10min,共洗滌3次。
1.2.3 NK細胞的培養(yǎng)及擴增 將PBMC懸浮于NK細胞培養(yǎng)基(RPMI1640培養(yǎng)液+1000IU/mL rhIL-2+100IU/mL青-鏈霉素溶液),調(diào)整細胞密度為1×106/mL,接種至w/2mm細胞培養(yǎng)皿中,加5%自體血漿、10ng/mL CD3單抗,混勻后放置在37℃、5%CO2飽和濕度培養(yǎng)箱中培養(yǎng),此后每隔24h補加CD3單抗10ng/mL,連續(xù)添加4天。細胞培養(yǎng)至第6天,離心收集細胞,棄上清,用生理鹽水洗滌1次,加入新鮮NK細胞培養(yǎng)基重懸細胞,調(diào)整細胞密度為1×106/mL,接種于6孔板中,根據(jù)添加不同濃度的康萊特注射液分為A-E 5組:A組(不加康萊特),B-E組(分別加康萊特0.25、0.5、1、2μL/mL),加入相應(yīng)濃度的康萊特注射液后混勻,于37℃、5%CO2培養(yǎng)箱中培養(yǎng)。此后每隔2~3天,根據(jù)細胞生長情況半量換液,并補加新鮮NK細胞培養(yǎng)基、5%自體血漿和相應(yīng)濃度的康萊特注射液。若NK細胞擴增狀況良好,可將細胞轉(zhuǎn)移至T25培養(yǎng)瓶繼續(xù)培養(yǎng)。
1.3 NK細胞形態(tài)及增殖能力的分析 誘導細胞培養(yǎng)的第7、10、15天,在倒置顯微鏡下觀察NK細胞的形態(tài),并用0.4%臺盼藍進行染色,通過全自動血細胞計數(shù)儀檢測各組NK細胞濃度,計算細胞總數(shù)(細胞總數(shù)=培養(yǎng)液總體積×細胞濃度)。
1.4 流式細胞術(shù)檢測各組NK細胞免疫表型
1.4.1 流式細胞儀檢測體外擴增產(chǎn)物的制備 于NK細胞體外擴增的第15天,將各組培養(yǎng)瓶中的細胞吹勻后分別取2×105個細胞,1000rpm離心5min,棄上清,用生理鹽水洗滌3次,吸取上清液,沉淀的細胞加入1mL生理鹽水重懸。
1.4.2 流式抗體的標記 空白對照管中不加任何熒光抗體,向CD3單標記管中加入5μl PE-CD3熒光抗體,CD56單標記管中加入5μl PE-Cy7-CD56熒光抗體,向雙標記管中同時加入5μl PE-CD3熒光抗體和5μl PE-Cy7-CD56熒光抗體,混合均勻,4℃避光靜置30min,1000rpm離心5min,棄上清,用生理鹽水洗滌細胞2遍,棄上清,沉淀的細胞加入500μL生理鹽水重懸并轉(zhuǎn)移至對應(yīng)的BD管中,即可使用流式細胞儀進行檢測,分析CD3-CD56+細胞的百分比。
1.5 ELISA法檢測各組NK細胞上清液中IFN-γ、TNF-α的分泌量 收集各組體外培養(yǎng)至15天的NK細胞,棄上清,調(diào)整細胞密度為2×105/mL,接種于96孔板,每組設(shè)置3個平行復孔,放置在37℃、5%CO2飽和濕度培養(yǎng)箱中孵育48h后取出,1500rpm離心5min,每孔吸取100μL細胞上清液,用ELISA法檢測各組NK細胞上清液中IFN-γ、TNF-α的分泌量。
1.6 CCK-8法檢測NK細胞的殺傷活性
1.6.1 肺癌A549細胞的培養(yǎng) 將凍存的肺癌A549細胞復蘇后,接種于含10%胎牛血清、1%雙抗(100IU/mL青-鏈霉素溶液)的RPMI1640培養(yǎng)液中,置于37℃、5%CO2培養(yǎng)箱中孵育,定期更換培養(yǎng)液,大概有80%~90%鋪滿培養(yǎng)瓶底則可進行傳代。
1.6.2 靶細胞的制備 取對數(shù)生長期的肺癌A549細胞,吸走培養(yǎng)液,用生理鹽水清洗細胞2次,加入37℃預熱的胰蛋白酶消化貼壁的A549細胞,待細胞完全脫落后,加入含10%FBS RPMI1640培養(yǎng)液終止消化,充分吹打細胞液,將其混勻,計數(shù)。收集細胞,1000rpm離心5min,棄上清,用無血清RPMI1640培養(yǎng)液洗滌3次,調(diào)整細胞密度為1×105個/mL作為靶細胞。
1.6.3 效應(yīng)細胞的制備 在各組NK細胞誘導培養(yǎng)的第15天,將每組培養(yǎng)瓶中的細胞吹勻后,計數(shù)。收集各組NK細胞,1000rpm離心5min,棄上清,用無血清RPMI1640培養(yǎng)液洗滌2次,將NK細胞密度調(diào)整為1×106個/mL作為效應(yīng)細胞。
1.6.4 CCK-8法檢測各組NK細胞殺傷靶細胞的能力 取平底96孔培養(yǎng)板,每個樣本設(shè)3個復孔,分為靶細胞組、效應(yīng)細胞組和實驗組,按效靶比10∶1種入效應(yīng)細胞及靶細胞。其中靶細胞組、實驗組提前種入靶細胞,每孔50μL,96孔板最外周一圈每孔分別加入100μL生理鹽水,放置在37℃、5%CO2培養(yǎng)箱中孵育24h后取出,在倒置顯微鏡下觀察每孔中靶細胞均已貼壁。吸走培養(yǎng)液,靶細胞組每孔加入新鮮RPMI1640培養(yǎng)液100μL。效應(yīng)細胞組每孔加入效應(yīng)細胞、RPMI1640培養(yǎng)液各50μL,實驗組每孔加入效應(yīng)細胞、RPMI1640培養(yǎng)液各50μL,置37℃、5%CO2培養(yǎng)箱中培養(yǎng)16-18h。每孔加入10μLCCK-8溶液,37℃孵育1-2h,終止培養(yǎng),全自動酶標儀檢測各孔在450nm波長處的光密度(D)值,并計算殺傷率。NK細胞殺傷活性(%)=[1-(實驗孔OD值-效應(yīng)細胞孔OD值)/靶細胞孔0D值]×100%
1.7 統(tǒng)計學方法 應(yīng)用SPSS17.0統(tǒng)計軟件進行數(shù)據(jù)分析,數(shù)據(jù)采用均數(shù)加減標準差()表示,組間比較采用單因素方差分析(One-way ANOVA),以P<0.05或P<0.01表示差異具有統(tǒng)計學意義。
2 結(jié)果
2.1 NK細胞形態(tài)觀察 倒置顯微鏡下觀察NK細胞體積較小,圓形透亮,在培養(yǎng)基中呈懸浮生長。各組NK細胞在培養(yǎng)第7天開始分裂增殖,細胞生長快,數(shù)量逐漸增多,各組間差異不明顯。細胞培養(yǎng)至第10天,A、B、C、D、E組均有細胞集落形成,但A組和B組細胞集落體積較小,集落數(shù)較少,而C、D、E組細胞集落體積較大,集落數(shù)較多,尤以D組最明顯(見圖1)。
2.2 培養(yǎng)第10天、第15天各組NK細胞增殖情況 患者樣本組中各組NK細胞增殖情況顯示(見表1),培養(yǎng)至第15天時,0.5~2μL/mL KLT組NK細胞數(shù)與不加KLT對照組比較均明顯增加(P<0.05或P<0.01),1μL/mL KLT組NK細胞數(shù)增加最明顯[(33.97±1.97)×106]。
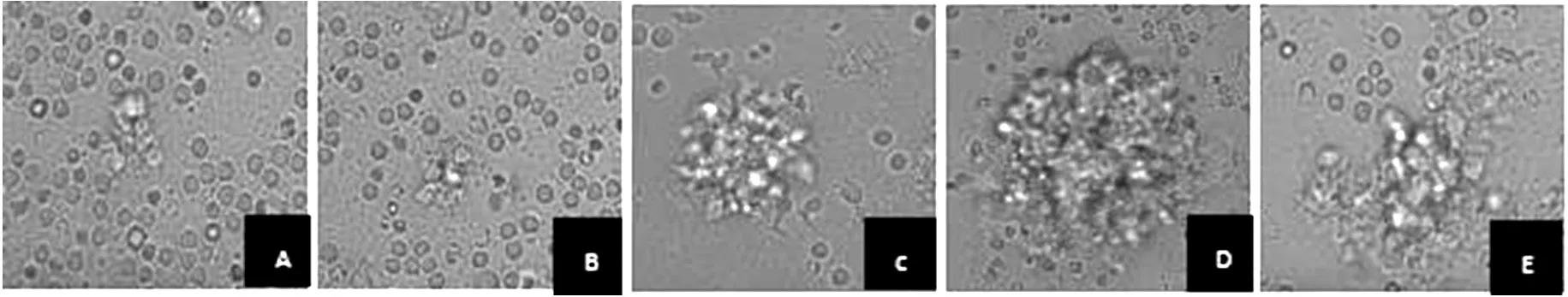
圖1 培養(yǎng)第10天各組NK細胞鏡下形態(tài)(×400)
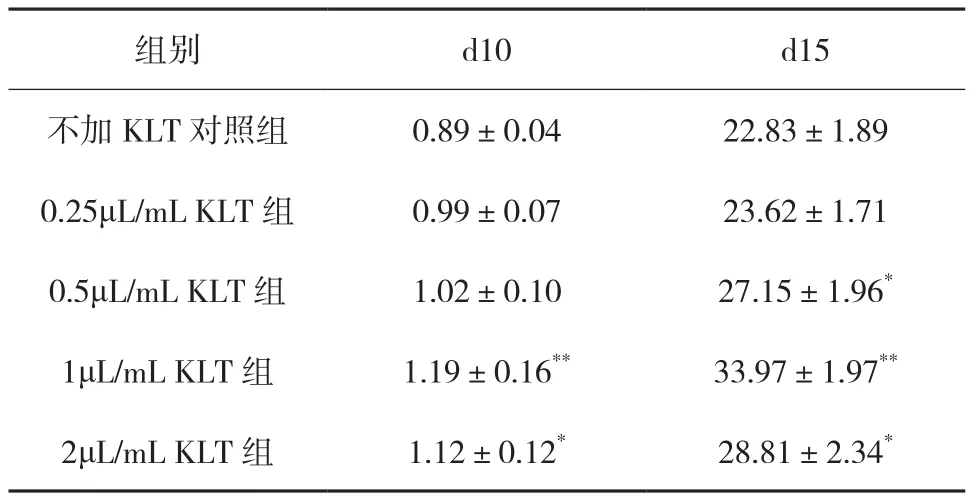
表1 患者樣本組各組NK細胞在培養(yǎng)第10天和第15天的增殖情況(n=5,×106)
健康人樣本組中各組NK細胞培養(yǎng)至第15天時,0.5~2μL/mL KLT組NK細胞數(shù)均比不加KLT對照組顯著增加[(36.13±2.35)×106、(44.29±2.08)×106、(38.17±2.14)×106vs (30.32±1.76)×106,P<0.05 或P<0.01]。其中也以 1μL/mL KLT 組 NK細胞數(shù)增加最明顯。(見表2)。
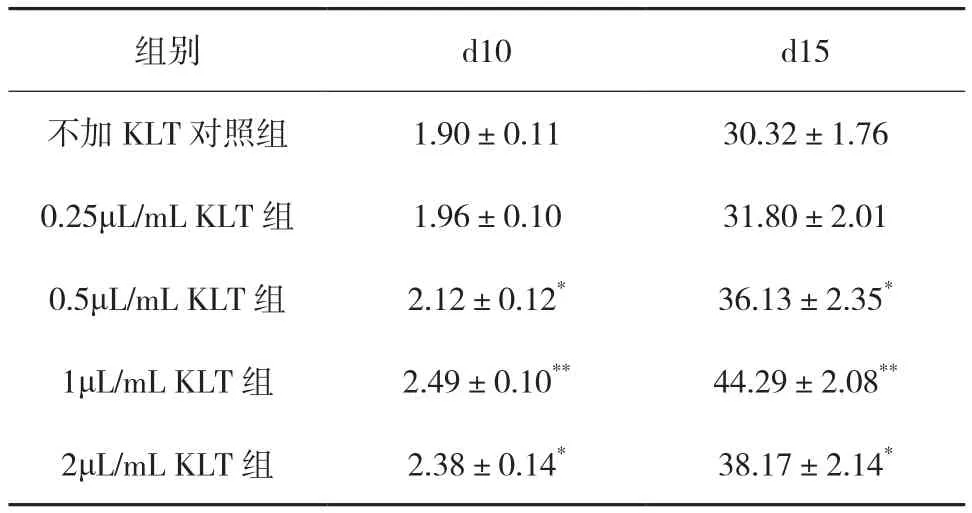
表2 健康人樣本組各組NK細胞在培養(yǎng)第10天和第15天的增殖情況(n=5,×106)
2.3 KLT對NK細胞免疫表型的影響 患者樣本組流式細胞術(shù)檢測結(jié)果示,1、2μL/mL KLT組NK細胞中CD3-CD56+細胞比例較不加KLT對照組明顯升高[(44.74±11.36)%、(36.95±8.37)%vs (21.71±7.64)%,P<0.01、P<0.05]。(見表3)。
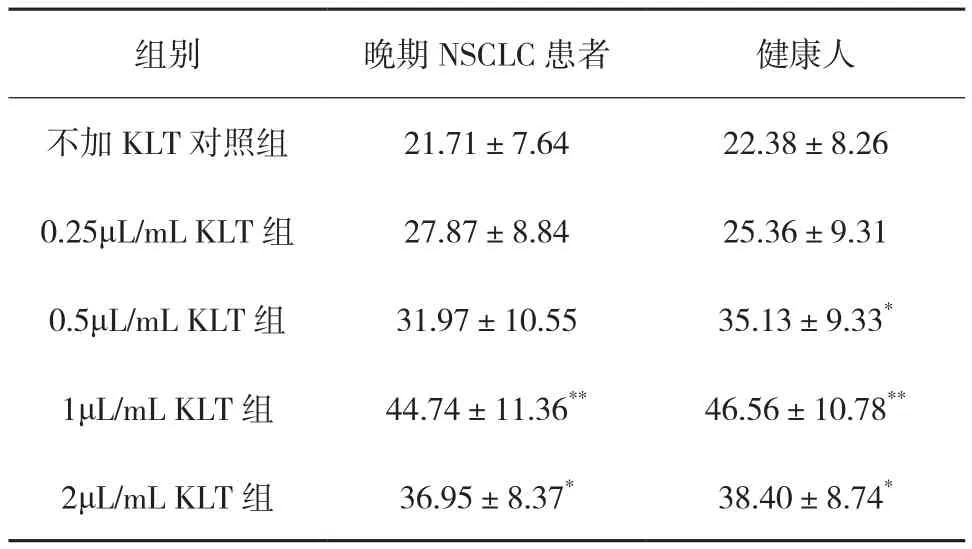
表3 培養(yǎng)第15天各組NK細胞CD3-CD56+細胞比例(%)
健康人樣本組流式細胞術(shù)檢測結(jié)果示,0.5~2μL/mL KLT組NK 細胞中 CD3-CD56+細胞比例顯著高于不加KLT對照組[(35.13±9.33)%、(46.56±10.78)%、(38.40±8.74)% vs(22.38±8.26)%,P<0.05或P<0.01]。(見表 3)。
2.4 各組 NK細胞IFN-γ、TNF-α分泌水平變化 患者樣本組與健康人樣本組ELISA法檢測結(jié)果均顯示,0.5~2μL/mL KLT組NK細胞分泌的IFN-γ和TNF-α均高于不加KLT對照組(P<0.05或P<0.01),以 1μL/mL KLT組 NK 細胞分泌的IFN-γ和TNF-α最高,且與其他組間比較差異有統(tǒng)計學意義(P<0.05)。見圖2。
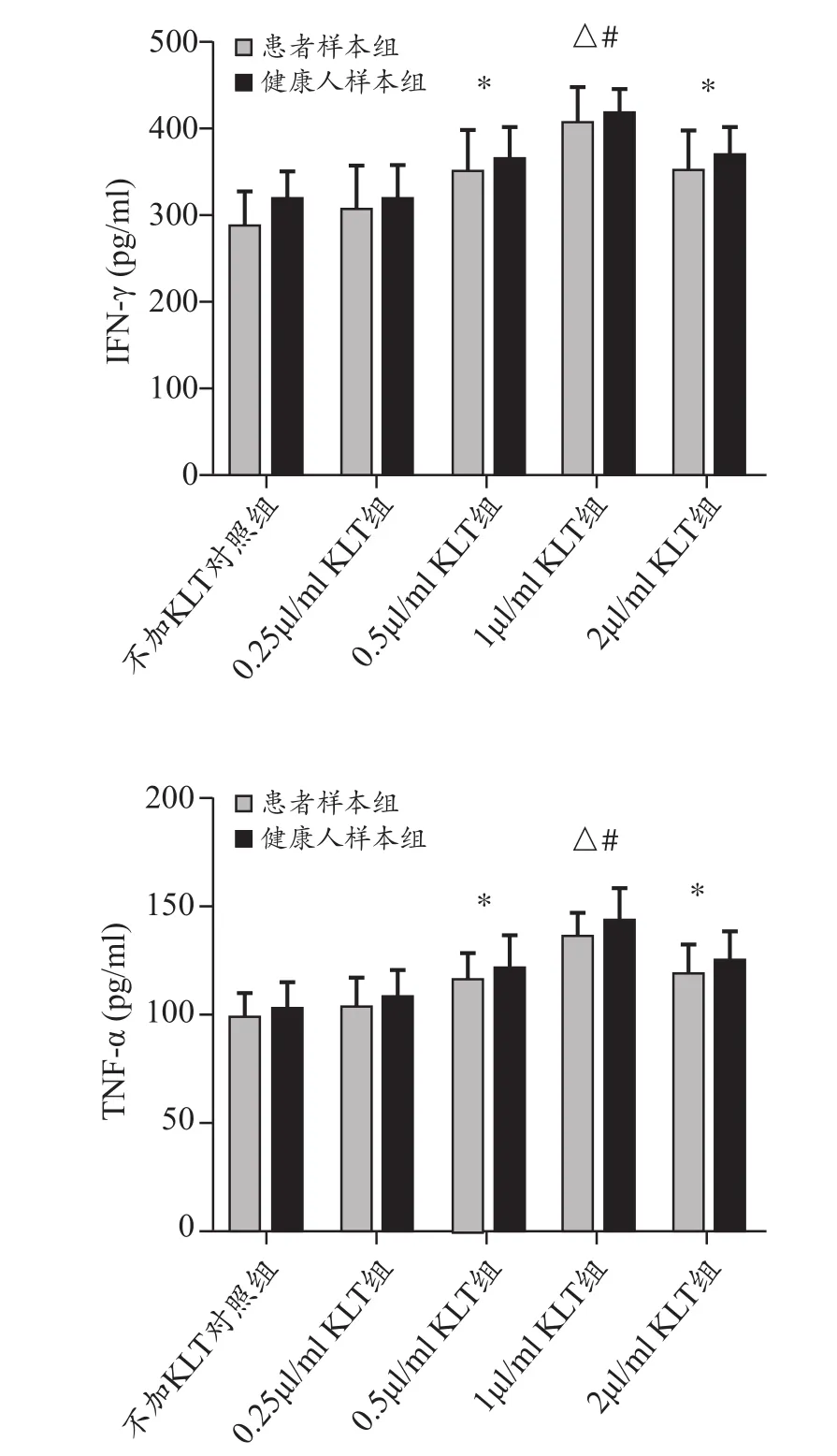
圖2 培養(yǎng)第15天各組NK細胞上清液中IFN-γ、TNF-α的分泌水平(pg/mL)
2.5 CCK-8法檢測各組NK細胞殺傷活性結(jié)果 患者 樣 本 組 在 10∶1效 靶 比 時,0.5~2μL/mL KLT組NK細胞對肺癌A549細胞的殺傷活性分別為(53.34±5.42)%、(63.54±5.50)%、(56.55±4.32)%,均明顯高于不加KLT對照組[(41.81±5.66)%](P<0.01)。 可 見 1μL/mL KLT 組 NK 細 胞 殺 傷活性最強,與其他組間比較差異有統(tǒng)計學意義(P<0.05)。見表 4。

表4 培養(yǎng)第15天10∶1效靶比時各組NK細胞對A549細胞的殺傷率(%)
健康人樣本組在10∶1效靶比時,0.5~2μL/mL KLT組NK細胞對肺癌A549細胞的殺傷活性比不加KLT對照組明顯升高[(54.15±5.86)%、(64.11±3.82)%、(56.91±5.21)% vs(42.39±5.91)%](P<0.01),并以1μL/mL KLT組NK細胞殺傷活性最強,與其他組間比較差異有統(tǒng)計學意義(P<0.05)。見表4。
3 討論
NK細胞是天然殺傷細胞,其在發(fā)揮抗腫瘤活性,參與免疫應(yīng)答的過程中,會在免疫應(yīng)答的早期,通過分泌IFN-γ和TNF-α來實現(xiàn)其在固有免疫應(yīng)答和獲得性免疫應(yīng)答之間的橋梁作用。體外擴增的NK細胞在殺傷靶細胞時,同樣也會分泌IFN-γ、TNF-α等細胞因子來調(diào)節(jié)其活化和殺傷作用。本研究發(fā)現(xiàn),患者樣本組和健康人樣本組中,0.5~2μL/mL KLT組NK細胞分泌的IFN-γ和TNF-α均明顯高于不加KLT對照組,并且這三組NK細胞對肺癌A549細胞的殺傷活性也顯著高于對照組。其中1μL/mL KLT組NK細胞分泌的IFN-γ和TNF-α的量最多,對肺癌A549細胞的殺傷活性也最強,兩者結(jié)果相一致。表明康萊特注射液可以通過上調(diào)NK細胞IFN-γ和TNF-α的分泌水平進一步提高NK細胞對肺癌A549細胞的殺傷活性。
PI3K/AKT通路廣泛存在于細胞中,能夠調(diào)節(jié)細胞生存、增殖和分化等多種功能,是最主要的抑制細胞凋亡的信號途徑。許琳等[10]在觀察漢黃芩素對NK細胞的作用研究中發(fā)現(xiàn),漢黃芩素能夠促進NK細胞的增殖,上調(diào)NK細胞p-Akt蛋白表達,由此認為漢黃芩素促進NK細胞的增殖可能與PI3K/AKT信號通路有關(guān)。本實驗選用具有免疫調(diào)節(jié)功能的康萊特注射液加入到傳統(tǒng)NK細胞的培養(yǎng)體系中進行誘導培養(yǎng)。結(jié)果顯示:隨著培養(yǎng)時間的延長,患者樣本組和健康人樣本組中,各組NK細胞增殖均升高。細胞培養(yǎng)第15天,與對照組比較,0.5~2μL/mL KLT組NK細胞的增殖均明顯升高,1μL/mL KLT組NK細胞數(shù)增加最明顯。表明康萊特注射液對NK細胞的增殖具有一定的促進作用,這可能與PI3K/AKT信號通路有關(guān),其具體作用機制有待進一步研究。
研究表明,康萊特注射液可提高患者的細胞免疫功能,改善患者生存質(zhì)量。曹向明等[11]研究中發(fā)現(xiàn)康萊特注射液能激活NK細胞活性,使CD4+、CD4+/CD8+比例上升,促進IL-2分泌,激活巨噬細胞的吞噬能力,從而提高機體免疫力。本實驗中,各組NK細胞培養(yǎng)第15天,患者樣本組檢測結(jié)果示,與對照組比較,1~2μL/mL KLT組NK細胞中CD3-CD56+細胞比例明顯升高。健康人樣本組結(jié)果顯示,0.5~2μL/mL KLT組NK細胞中CD3-CD56+細胞比例明顯高于對照組。表明康萊特注射液能夠提高NK細胞中CD3-CD56+細胞比例。
綜上,康萊特注射液在體外實驗中能夠促進NK細胞的增殖,增加NK細胞CD3-CD56+細胞比例,并通過分泌更多的IFN-γ、TNF-α來提高對肺癌A549細胞的殺傷活性,以上結(jié)論可為康萊特注射液聯(lián)合NK細胞治療惡性腫瘤提供一定的實驗依據(jù)。
[1]肖開, 苗明三.薏苡仁現(xiàn)代研究分析[J].中醫(yī)學報, 2014, 29(9):1 348-1 350.
[2]王紅艷,湯 虹,吳育鋒,等.康萊特在培美曲塞聯(lián)合順鉑治療晚期肺腺癌中的協(xié)同作用[J].中國醫(yī)藥導報, 2016, 13(2):138-141.
[3]Li Y, Zhao XM, Xu HL, et al. Clinical efficacy and Influence of Kanglaite Combined with Chemotherapy on the Activity of Immune Cells in Patients with Liver Cancer [J]. Progress in Modern Biomedicine, 2014,14(11): 2 103-2 106.
[4]Tang CP, Wu Y, Zhou HJ, et al. The chemosensitization effect of Kanglaite injection combined with Paclitaxel in human breast cancer cells [J]. Chongqing Medicine, 2016, 45(24):3 336-3 339.
[5]王艷,陳新,高旭靈.康萊特聯(lián)合替吉奧治療老年中晚期結(jié)直腸癌的臨床研究[J].現(xiàn)代藥物與臨床, 2015, 30(1):65-69.
[6]Becker PS, Suck G, Nowakowska P, et al. Selection and expansion of natural killer cells for NK cell based immunotherapy [J]. Cancer Immunol Immunother, 2016, 65(4):477-484.
[7]Robertson MJ, Ritz J. Biology and clinical relevance of human natural killer cells [J]. Blood, 1990, 76(12):2 421-2 438.
[8]Vivier E, Ugolini S, Blaise D, et al. Targeting natural killer cells and natural killer T cells in cancer [J]. Nat Rev Immunol, 2012, 12(4):239-252.
[9]Baggio L, Laureano áM, Silla LM, et al. Natural killer cell adoptive immunotherapy:Coming of age [J]. Clinical Immunology, 2016, 2(3):1 521-1 530.
[10]許琳,王營,陳復興,等.漢黃芩素對人 NK 細胞殺傷胃癌 MKN45細胞的影響及其機制研究[J].免疫學雜志, 2014, 30(9):804-808.
[11]曹向明,沈偉生,舒中琴,等.薏苡仁甘油三酯在吉西他濱三維適形同步放化療治療局部晚期胰腺癌中免疫調(diào)節(jié)功能觀察[J].南京醫(yī)科大學學報(自然科學版), 2012, 32(10):1 414-1 416.

