兼具解磷解鉀功能生防菌分離鑒定及效果評價
代 志,高俊明
(山西農業大學農學院,山西太谷 030801)
農藥化肥的大量投入和使用曾對確保我國糧食生產和菜籃子工程大力發展發揮了積極重要的作用。但多年來,我國農藥、化肥使用效率偏低、過量和不合理施用現象極為普遍,由此帶來的副作用也越來越突出,如土壤出現板結、酸化、肥力下降,土壤微生態失衡,有害生物抗藥性產生,病蟲草害頻發,環境污染、農產品有害物質殘留超標等已嚴重影響到了我國農業的可持續發展[1-2]。為此,國家提出了減肥控藥確保農藥化肥零增長行動方案,為我國今后農業可持續發展奠定了方向。而在新形勢下,如何確保糧食、蔬菜等主要農產品供給,實現農藥、化肥減量提效、控害[3],就成為農業科技領域面臨的重要問題。
已有研究表明,土壤中不僅存在能夠降解礦物質、促進土壤中難溶性磷鉀釋放的有益微生物群,也存在著能夠抑制和殺死有害生物的有益微生物[4-6]。充分開發利用這些有益微生物資源是實現農藥、化肥減量提效的一條重要途徑。但目前對這類有益微生物資源的開發利用還遠遠不夠,菌肥工作者只注重了能夠改善土壤結構、提高土壤肥力的微生物篩選;生防工作者則只注重有生防活性微生物的篩選[7],這極大地影響了有益微生物資源在生產中的廣泛應用。
本研究以山西省普遍嚴重發生的根結線蟲為靶標生物,在篩選根結線蟲生防菌的過程中增加了解磷釋鉀活性測定環節,以期能夠篩選到兼具菌肥功能的根結線蟲生防菌,為今后多功能微生物生防菌和復合微生物菌肥研發及廣泛應用奠定理論基礎。
1 材料和方法
1.1 試驗材料
本研究中分離篩選根結線蟲生防菌的土樣采自山西太谷縣侯城鄉根結線蟲病連年嚴重發生的溫室內土壤。
1.2 試驗方法
1.2.1 多功能生防細菌的分離和篩選
1.2.1.1 土樣采集 土樣采集時首先選擇根結線蟲病嚴重發生且近期又未使用任何農藥的黃瓜或番茄大棚,進入溫室后隨機選擇10個根結線蟲病發生相對較輕的采樣點,每點0.25 m2,除去表層干土,采集5~20 cm根際土壤,裝入塑料袋編號后帶回實驗室,低溫(4℃)冷藏以備分離。
1.2.1.2 土壤細菌的分離 取土壤樣品1.0 g,放入100 mL無菌水中,用玻璃棒攪拌均勻,靜置30 min,將土樣溶液分別稀釋 10-1,10-2,10-3,10-4,10-5涂布于牛肉膏蛋白胨瓊脂培養基平板上,倒置放入37℃培養箱中培養,待平板中長出菌落,用接菌環將不同形態和顏色的單個菌落轉接到新的空白NA培養平板中純化培養,培養后接種到試管中,于4℃冰箱保存。
1.2.1.3 解鉀菌株篩選 將1.2.1.2中分離到的細菌菌株,分別先在NA培養平板活化培養48 h,然后將活化后的新鮮菌株用接菌環十字劃線法接種到不含游離鉀元素解鉀平板中培養,若正常生長,表明該菌可利用含鉀礦石。
解鉀平板培養基:蔗糖 2.0 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,Na2HPO41.5 g,鉀長石粉 5.0 g,瓊脂20.0 g,蒸餾水1 000 mL。
1.2.1.4 解磷菌株的篩選 將1.2.1.3中篩選得到的能在解鉀培養平板中生長的菌株再轉接到解無機磷和解有機磷培養平板中,倒置放入37℃培養箱中培養3~7 d,從中挑選菌落周圍有溶解圈產生的菌株,然后轉到試管中,4℃冰箱保存。
解無機磷平板培養基:(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.2 g,CaCO32.5 g,葡萄糖 2.0 g,MnSO40.02 g,FeSO40.02 g,瓊脂 20.0 g,蒸餾水1 000 mL。
解有機磷平板培養基:(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.2 g,CaCO32.5 g,葡萄糖 2.0 g,MnSO40.02 g,FeSO40.02 g,卵磷脂 0.2 g,瓊脂 20.0 g,蒸餾水1 000 mL。
1.2.2 解磷釋鉀菌株殺線蟲能力測試
1.2.2.1 根結線蟲分離 采用淺盤法分離根結線蟲。稱取土樣200 g左右平鋪在墊有雙層面巾紙的篩盆中,然后將篩盆放入不銹鋼托盤中,沿邊緣倒入清水至沒過土壤,靜置48 h,移去篩盆,然后將托盤中的水緩緩倒入到0.020 mm網篩中過濾,過濾至50 mL左右倒入離心管中待用。
1.2.2.2 解磷釋鉀菌株殺線蟲能力測試 將分離得到的解磷釋鉀菌株接入到NB培養基中,放入搖床中,在180 r/min,37℃條件下培養48 h。將細菌發酵液經8 000 r/min離心5 min,吸取上清液2 mL加入到貝式培養皿中,挑入經消毒過的根結線蟲(0.3%次氯酸鈉溶液處理3 min,無菌水沖洗3次過濾)30只,以加入未接菌的NB培養基的根結線蟲平板為對照,試驗重復3次,在24,48 h分別記錄死亡線蟲數量,并計算死亡率及校正死亡率[8]。校正死亡率=(處理某時刻線蟲死亡率-對照某時刻死亡率)/(1-對照某時刻死亡率)×100%。
1.2.3 液體培養解磷解鉀效果測定 采用無機磷液體培養基、有機磷液體培養基、鉀細菌液體培養基分別對分離出的菌株進行液體培養,對分解磷鉀活性進行進一步測定。
無機磷液體培養基:(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.2 g,Ca3(PO4)210.0 g,CaCO30.5 g,葡萄糖 2.0 g,MnSO40.02 g,FeSO40.02 g,蒸餾水1 000 mL。
有機磷液體培養基:(NH4)2SO40.5 g,MgSO4·7H2O0.5 g,NaCl 0.2 g,卵磷脂 0.2 g,CaCO30.5 g,葡萄糖 2.0g,MnSO40.02g,FeSO40.02g,蒸餾水 1000mL。
鉀細菌液體培養基:(NH4)2SO41.0 g,MgSO4·7H2O 0.5 g,NaCl 0.1 g,Na2HPO42.0 g,蔗糖 10 g,酵母粉0.5 g,鉀長石粉10.0 g,蒸餾水1 000 mL。
接種菌株后,搖床程序設置為37℃,180 r/min培養6 d,用過氧化氫法測定菌液中可溶性鉀的含量[9],采用鉬銻抗比色法測定菌液中可溶性磷的含量[10-12]。
1.2.4 菌株的鑒定
1.2.4.1 形態學鑒定 對分離到的菌株進行革蘭氏染色、芽孢染色(參照葉生梅等[13]的細菌芽胞染色方法改進研究)、鞭毛染色(參照顧冠彬等[14]細菌的5種鞭毛染色方法比較研究),對其不同的形態特征進行鑒別。
1.2.4.2 生理生化鑒定 參照《常見細菌系統鑒定手冊》對其進行以下生理生化鑒定:糖發酵、甲基紅、接觸酶、V-P測定、水解淀粉、利用檸檬酸鹽、利用丙酸鹽、苯丙氨酸脫氨酶、卵磷脂酶、硝酸鹽還原、形成吲哚、耐鹽試驗、氧化酶、膿青素、明膠液化、酯酶、生長溫度測定、精氨酸雙水解酶、葡萄糖利用[15]。
1.2.4.3 分子鑒定 將不同菌株液體發酵培養后,取1 mL加入到1.5 mLEP管中,使用細菌抽提試劑盒將分離得到的菌株全基因組抽提出后,再利用細菌促旋酶gyrB基因[16-18]將其進行PCR擴增,得到擴增產物后送公司測序,并將序列結果輸入到NCBI數據庫進行比對分析。
2 結果與分析
2.1 菌株的分離篩選
2.1.1 解磷釋鉀菌株的初篩與純化 利用稀釋涂布法從采集到的10份土壤樣品中共分離得到83株細菌菌株,根據分別可生長于難溶無機磷、有機磷和解鉀培養基上的菌株菌落形態及產生的溶解圈,從83株菌株中共分離純化得到5株解有機磷解鉀菌株(編號 TD-02-9,TD-04-4,TD-05-4,TD-05-7,TD-10-3)和4株解無機磷解鉀菌株(編號 TD-02-7,TD-05-8,TD-09-3,TD-10-6)。
2.1.2 菌株殺線蟲測定結果 篩選結果列于表1。

表1 3種菌株殺線蟲結果 %
試驗共測試了上述分離篩選得到的9株解磷釋鉀菌株的抑殺線蟲死亡率及校正死亡率,其中在作用48 h后有3株菌株對線蟲抑殺校正死亡率在50%以上,分別為 TD-02-9,TD-05-7,TD-10-6。以此3株菌株為供試菌株,測定其液體發酵解磷解鉀效果及菌株鑒定。
2.1.3 液體發酵培養解磷解鉀效果測定 利用過氧化氫法和鉬銻抗比色法分別測定3種供試菌株發酵液中可溶性磷和可溶性鉀的含量,結果如表2所示。從表2可以看出,菌株TD-10-6解有機磷和無機磷能力分別達到3.66,61.80 mg/L,明顯高于菌株TD-02-9和菌株TD-05-7;在解鉀效果方面,菌株TD-05-7和菌株TD-02-9解鉀能力分別達到8.74,8.17 mg/L,均高于菌株TD-10-6的6.72 mg/L。

表2 液體培養解磷解鉀效果測定 mg/L
2.2 3種解磷菌株的鑒定
2.2.1 菌株形態學特征
2.2.1.1 菌落形態 菌株TD-10-6在NA培養基上生長出的菌落形態為白色不透明膿狀,邊緣整齊,表面光滑(圖1);菌株TD-05-7菌落形態為白色不透明薄膜狀,邊緣粗糙(圖2);菌株TD-02-9菌落形態為淡黃色乳狀物,表面光滑有黏性(圖3)。
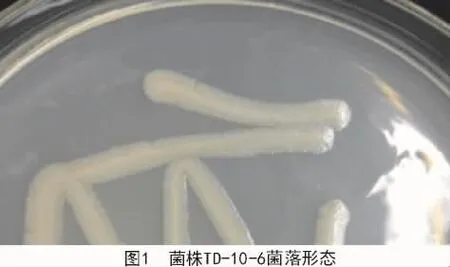
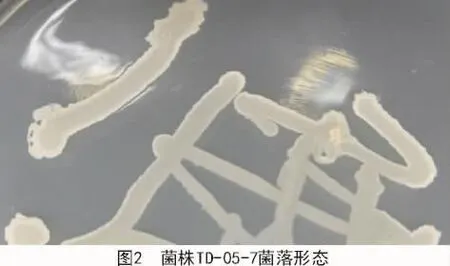
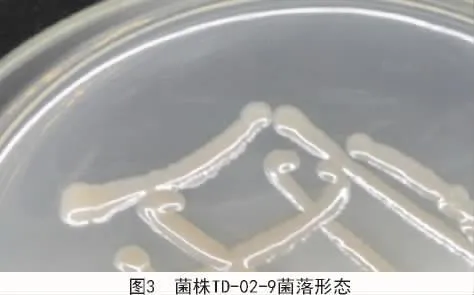
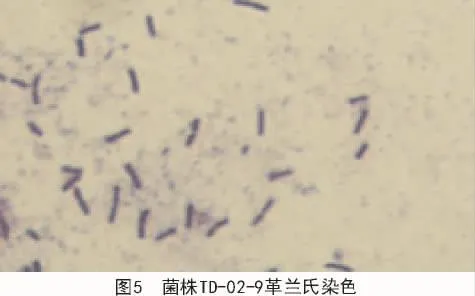
2.2.1.2 革蘭氏染色 經過革蘭氏染色試驗表明,菌株 TD-05-7(圖 4)和菌株 TD-02-9(圖 5)染色結果顯示藍紫色,屬革蘭氏陽性菌;菌株TD-10-6(圖6)染色結果為紅色,屬革蘭氏陰性菌。

2.2.1.3 芽孢染色 從染色結果可以看出,菌株TD-05-7(圖 7)和菌株 TD-02-9(圖 8)芽孢端生,單菌形態為長棒狀。
2.2.1.4 鞭毛染色 對3種菌株鞭毛染色試驗結果顯示,菌株TD-05-7(圖9)為單鞭鞭毛,菌株TD-10-6(圖 10)為周生鞭毛,菌株 TD-02-9(圖11)周圍有2根鞭毛。

2.2.2 菌株生理生化特征 菌株TD-02-9,TD-05-7,TD-10-6生理生化試驗鑒定結果列于表3。參照《常見細菌系統鑒定手冊》得出,菌株TD-02-9和菌株TD-05-7分別與芽孢桿菌屬中解淀粉芽孢桿菌和地衣芽孢桿菌生理生化特征基本一致,菌株TD-10-6與假單胞菌中惡臭假單胞菌生理生化特征一致,因此,鑒定菌株TD-02-9為解淀粉芽孢桿菌,菌株TD-05-7為地衣芽孢桿菌,菌株TD-10-6為惡臭假單胞菌。
2.2.3 菌株分子鑒定結果 基于促旋酶gyrB基因擴增序列的比對分析,結果顯示,菌株TD-02-9和菌株TD-05-7與Bacillus屬的其他序列有較高的相似性,菌株TD-10-6與Pseudomonas屬的序列有較高相似性。構建系統發育樹可以看出,菌株TD-05-7親緣關系與CP021677.1 Bacillus licheniformis最近(圖12),菌株TD-02-9親緣關系與DQ309309.1 Bacillus amyloliquefaciens最近(圖13),菌株TD-10-6親緣關系與 D86010.1 Pseudomonas putida親緣關系最近(圖14)。因此,鑒定菌株TD-05-7為地衣芽孢桿菌,菌株TD-02-9為解淀粉芽孢桿菌,菌株TD-10-6為惡臭假單胞菌。
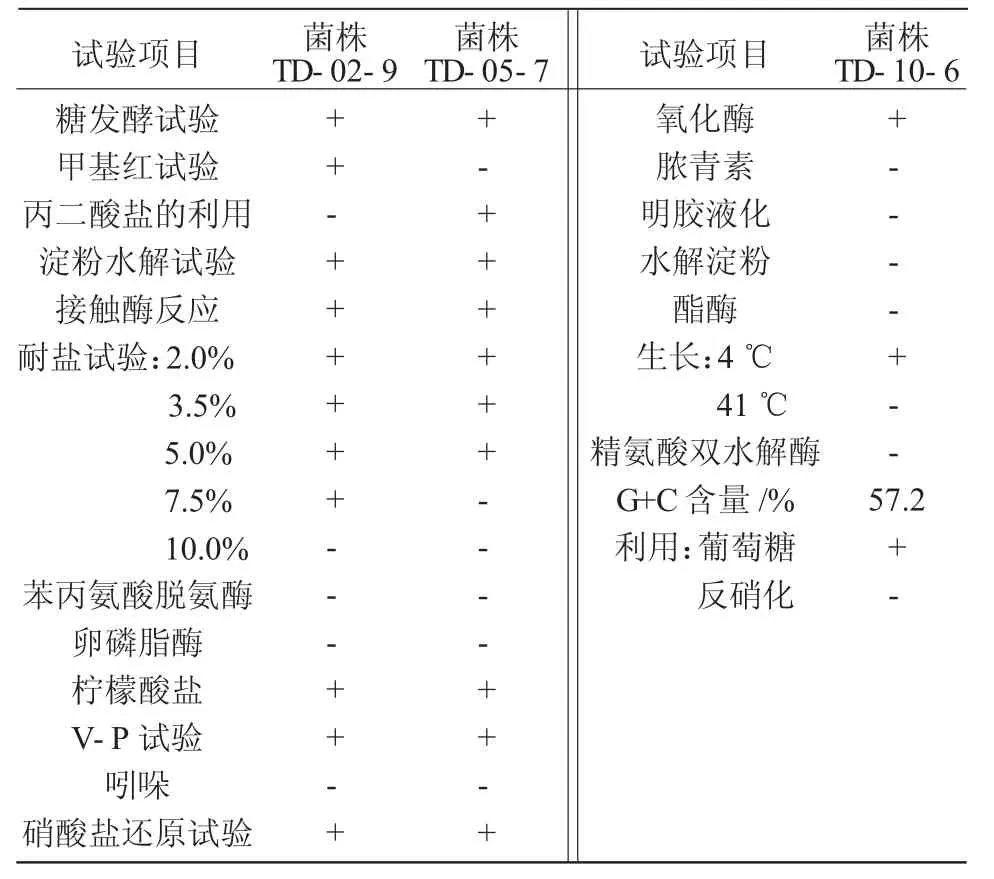
表3 3種供試生理生化試驗結果


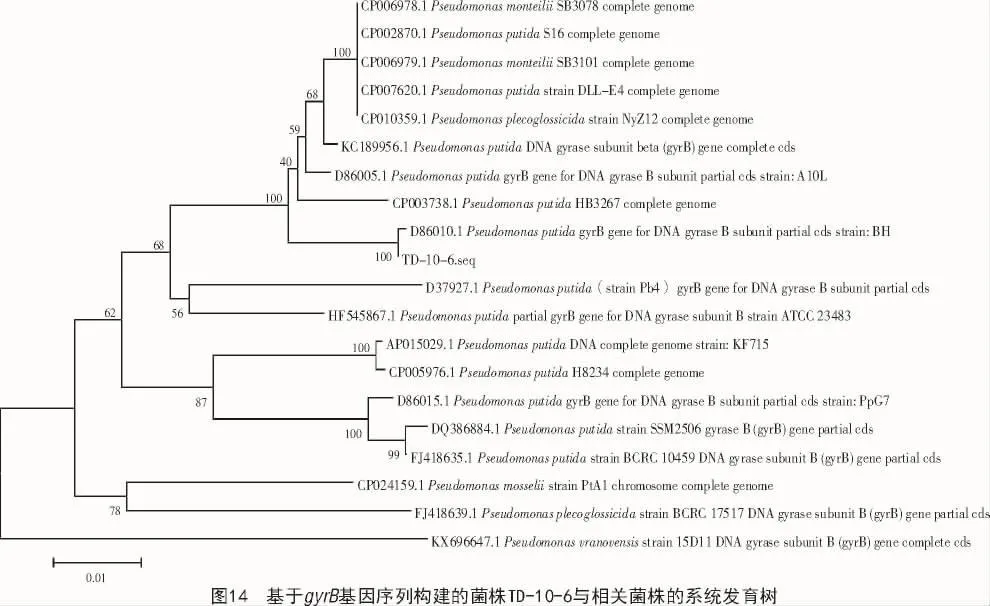
3 討論
本研究通過從溫室土壤中篩選得到3種兼具解磷釋鉀多功能生防菌株,通過鑒定,其中2株為芽孢桿菌,1株為假單胞菌。經液體發酵培養后進行解磷解鉀效果測定,結果顯示,3種菌株的解有機磷結果為0.82~3.66 mg/L,解無機磷結果為40.90~61.80 mg/L。利用火焰分光光度計測得3種菌株分解無機鉀的結果為6.72~8.74 mg/L。假單胞菌解無機磷和有機磷能力明顯高于2株芽孢桿菌;而在解鉀能力上,2株芽孢桿菌大于假單胞菌。在進行平板篩選的過程中,只觀察到菌株TD-02-9和菌株TD-05-7在有機磷平板中出現溶解圈,未在無機磷平板培養中出現溶解圈;而菌株TD-10-6恰恰相反,在無機磷平板中出現溶解圈,在有機磷平板中未出現溶解圈。但是液體發酵培養后進行解磷效果測定發現,菌株TD-10-6同樣具有解有機磷的作用,而且解有機磷能力明顯大于2株芽孢桿菌的能力,分析原因可能是由于菌株TD-10-6在液體培養中更容易繁殖,因而,解有機磷能力大大提高。
本研究提供了3株細菌的解磷解鉀屬性及對根結線蟲的抑殺效果,后續試驗還會對分離篩選得到的菌株進行田間作物促生及防病效果的研究。同時,本試驗存在一些不足,植物生長不僅受土壤中磷鉀離子的影響,微生物代謝產物中含有的生長素、生物降解酶等有機化合物同樣會影響植物的生長和體內代謝平衡[19-20]。因此,還需要進一步測定菌株分泌物當中含有哪些具有植物促生作用的活性物質及含量,為今后多功能微生物生防菌肥的研發和應用奠定理論基礎。
參考文獻:
[1]劉貴鋒,白文斌,趙建武,等.綠色有機肥料的開發與研制[J].現代農業科技,2013(1):224-225.
[2]梁紹芬,姜瑞波.解磷微生物肥料的作用和應用[J].中國土壤與肥料,1994(2):46-48.
[3]逄煥成,李玉義,嚴慧峻,等.微生物菌劑對鹽堿土理化和生物性狀影響的研究[J].農業環境科學學報,2009,28(5):951-955.
[4]林啟美,王華,趙小蓉,等.一些細菌和真菌的解磷能力及其機理初探[J].微生物學通報,2001,28(2):26-30.
[5]林先貴,胡君利.土壤微生物多樣性的科學內涵及其生態服務功能[J].土壤學報,2008,45(5):125-133.
[6]楊永華,姚健,華曉梅.農藥污染對土壤微生物群落功能多樣性的影響[J].微生物學雜志,2000(2):23-25.
[7]喬俊卿.Bacillus amyloliquefaciens B3生防促生相關基因和內生質粒pBSG3的研究及高效生防工程菌的構建[D].南京:南京農業大學,2010.
[8]路平.生防細菌X-20對根結線蟲的生防機制及應用研究[D].太谷:山西農業大學,2016.
[9]王珣玨,黃巧云,蔡鵬,等.解鉀菌解鉀效率檢測方法的比較[J].華中農業大學學報,2016(1):81-85.
[10]麻瑞陽,張愛民,惠小雙,等.高效解磷解鉀菌NX-11菌株的分離篩選、鑒定及最佳培養條件的確定 [J].華北農學報,2013,28(2):202-208.
[11]李必龍.磷標準曲線的繪制 [J].合成潤滑材料,2006,33(2):17-19.
[12]程樂明,陳良,劉建雷,等.碳酸氫鈉浸提-鉬銻抗比色法測定土壤有效磷的注意事項[J].現代農業科技,2009(3):205.
[13]葉生梅,高威.細菌芽胞染色方法改進研究[J].微生物學雜志,2011,31(1):106-109.
[14]顧冠彬,房紅瑩,徐培君.細菌的五種鞭毛染色方法比較研究[J].中國血液流變學雜志,2005,5(3):483-485.
[15]蔡妙英,東秀珠.常見細菌系統鑒定手冊[M].北京:科學出版社,2001.
[16]喻國輝,牛春艷,陳遠鳳,等.利用16SrDNA結合gyrA和gyrB基因對生防芽孢桿菌R31的快速鑒定[J].中國生物防治學報,2010,26(2):160-166.
[17]林玲,伍輝軍,梁文伯,等.馬來西亞植物根際土壤芽孢桿菌的鑒定及其對水稻白葉枯病防治效果 [J].南京農業大學學報,2016,39(3):394-401.
[18]侯曉麗,陳智.分類及鑒別細菌的新靶標——gyrB基因[J].國際流行病學傳染病學雜志,2005,32(1):38-41.
[19]王賀祥.農業微生物學[M].北京:中國農業大學出版社,2003.
[20]杜春梅.芽孢桿菌在農業中的研究與應用[M].哈爾濱:黑龍江大學出版社,2013.

