槲皮素對肝癌細胞Huh7的殺傷活性研究
張紅萍,袁梅
(嘉興市中醫醫院,浙江 嘉興314001)
γδ T細胞是T細胞的一個功能性亞群,其表面的T細胞受體(TCR)由γδ肽鏈組成。盡管γδ T細胞在T細胞族群中占比很小,但其卻能直接殺傷腫瘤細胞而不需要依賴MHC分子。盡管如此,腫瘤細胞對γδ T細胞單獨治療的敏感性卻仍較低[1],因此需輔以其它藥物提高γδ T細胞對腫瘤細胞的細胞毒性。本研究目的在于探討γδ T細胞對肝癌細胞系Huh7的細胞毒性,并研究槲皮素對γδ T細胞的協同效應。
1 材料與方法
1.1 實驗材料
1.1.1 試劑 槲皮素購于美國Sigma-Aldrich。JC-1線粒體膜電位染料、乳酸脫氫酶細胞毒性檢測試劑盒和線粒體分離試劑盒購于江蘇碧云天生物技術有限公司,DMEM培養基購于美國Gibco公司,MCL-1、cleaved caspase-9、cleaved caspase-3、細胞色素C和GAPDH抗體購于美國Cell Signaling公司。ECL試劑盒購于美國Pierce公司,pcDNA3.1質粒和脂質體2000(Lipofectamine 2000)購于美國Invitrogen公司,溴代醇磷酸 (bromohydrin pyrophosphate,BrHPP)購于法國 Innate Pharma 公司,IL-2購于美國R&D system公司,γδ TCR-PE流式細胞抗體和CD3-FITC流式細胞抗體購于美國BD Bioscience公司。
1.1.2 細胞培養 人肝癌細胞系Huh7購于中國科學院典型培養物保藏委員會細胞庫。細胞培養在含10%胎牛血清的DMEM培養基中,培養環境為37°C恒溫培養箱中培養并通入5%CO2。γδ T細胞的培養按文獻[2]所示,取12例健康志愿者的全血采用密度梯度離心法獲取單個核細胞,并培養在含10%胎牛血清的DMEM培養基中,加入3μmol/L γδ T細胞特異性擴增劑BrHPP和400U/mL IL-2培養14天。
1.2 實驗方法
1.2.1 γδ T細胞的鑒別 培養γδ T細胞用帶PE熒光標記的γδ TCR流式細胞抗體和帶FITC熒光標記的CD3流式細胞抗體孵育20分鐘,用生理鹽水將細胞清洗3次后用流式細胞儀進行檢測。
1.2.2 MCL-1過表達質粒的構建和轉染 將MCL-1基因的開放閱讀框架序列經PCR擴增后以分子克隆的方法與pcDNA3.1連接后構建成MCL-1重組過表達質粒。MCL-1過表達質粒用Lipofectamine 2000按試劑操作說明書步驟進行轉染,將2μg/mL MCL-1表達質粒轉染入Huh7細胞中。
1.2.3 γδ T細胞的殺傷活性 采用乳酸脫氫酶釋放實驗。按不同的效靶比(效應γδ T細胞個數:目標Huh7靶細胞個數,E:T),將Huh7細胞和γδ T細胞進行共培養,12小時后用乳酸脫氫酶細胞毒性檢測試劑盒,按說明書步驟檢測Huh7細胞乳酸脫氫酶的釋放率。
1.2.4 槲皮素對γδ T細胞殺傷活性的影響 采用乳酸脫氫酶釋放實驗。實驗分為對照組、槲皮素組、γδ T細胞組、槲皮素+γδ T細胞組、槲皮素+γδ T細胞+MCL-1質粒組。各組實驗處理方法詳見表1。細胞處理完畢后用乳酸脫氫酶細胞毒性檢測試劑盒,按說明書步驟檢測Huh7細胞乳酸脫氫酶(LDH)的釋放率。

表1 各組實驗處理方法
1.2.5 線粒體膜電位測定 將Huh7細胞按上述進行分組。藥物處理完畢后按試劑操作說明書步驟將細胞用JC-1染料進行孵育,孵育完畢后用流式細胞儀檢測JC-1發出的紅色熒光,紅色熒光強度越強,線粒體膜電位越高[3]。
1.2.6 線粒體分離 將Huh7細胞按上述進行分組。用線粒體分離試劑盒按試劑說明書步驟將處理后的Huh7細胞線粒體從細胞質中分離出來,取無線粒體的細胞質進行后續的western blot實驗。
1.2.7 Western blot實驗 將Huh7細胞按上述進行分組。細胞處理完畢后用蛋白提取液提取Huh7細胞中的總蛋白質,將等量的總蛋白質用12.5%SDS-PAGE進行電泳分離。分離完畢后通過電轉方法將蛋白質從分離膠上轉到PVDF膜上,用MCL-1、cleaved caspase-9、cleaved caspase-3、 細胞色素 C和GAPDH抗體孵育過夜,之后再用帶辣根過氧化物酶的二抗孵育2小時,蛋白條帶用ECL試劑盒顯色發光。
2 結果
2.1 γδ T細胞對肝癌細胞的殺傷活性 人全血單個核細胞經體外γδ T細胞擴增培養后用流式細胞術進行鑒定,發現γδ T細胞可在體外擴增培養,且培養產物高表達CD3和γδ TCR(圖1),將γδ T細胞與Huh7細胞按不同(E:T)混合培養。LDH釋放實驗結果顯示,E:T越高,Huh7細胞的LDH釋放率越高,表明γδ T細胞對肝癌細胞有殺傷活性 (表2),且呈γδ T細胞的劑量依賴。
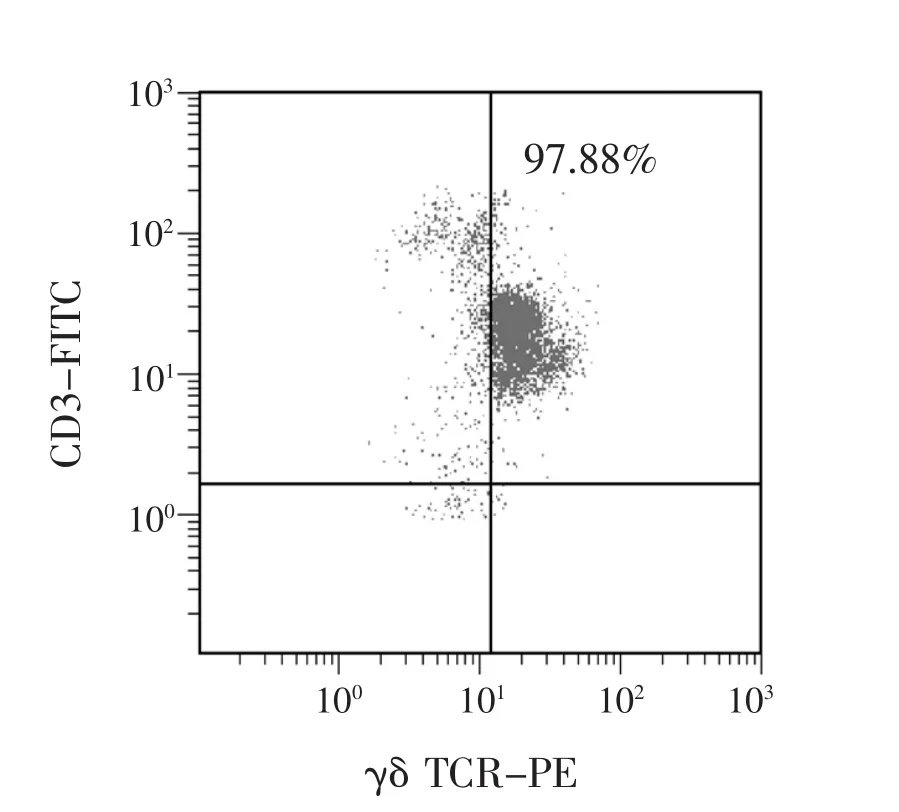
圖1 體外培養后γδ T細胞的流式細胞圖
2.2 槲皮素提高γδ T細胞對肝癌的細胞毒性LDH釋放實驗結果顯示,γδ T細胞+槲皮素組Huh7的LDH釋放率顯著高于γδ T細胞組和槲皮素組(表3),表明槲皮素處理能顯著提高γδ T細胞對Huh7的細胞毒性。
表2 γδ T細胞對肝癌細胞的殺傷活性 (±s,%)
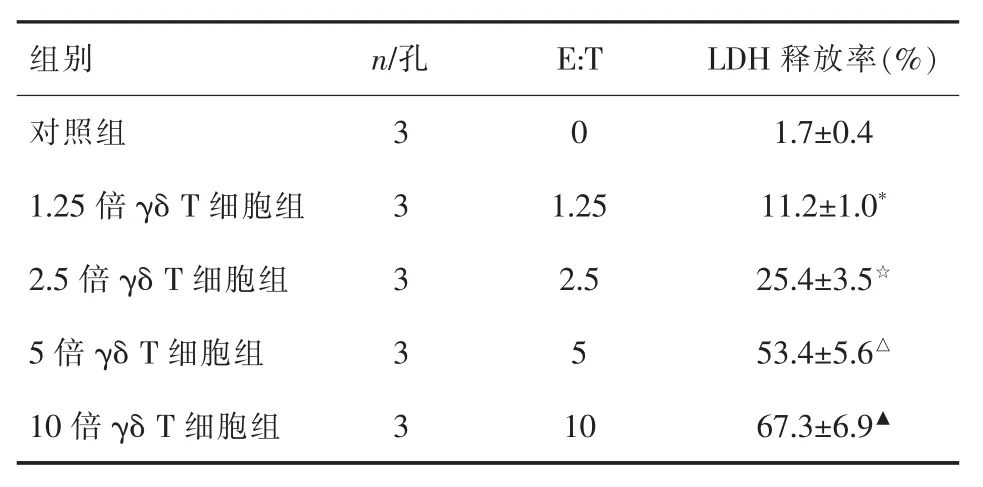
表2 γδ T細胞對肝癌細胞的殺傷活性 (±s,%)
與對照組比較*P<0.05,與1.25倍γδ T細胞組比較☆P<0.05,與 2.5倍 γδ T 細胞組比較△P<0.05,與 5倍 γδ T 細胞組比較▲P<0.05
?
2.3 槲皮素通過下調MCL-1的表達促進γδ T細胞對Huh7凋亡的誘導活性 Western blot實驗結果顯示,槲皮素體外處理能顯著降低Huh7細胞中MCL-1的表達水平(圖2),提示槲皮素對γδ T細胞的增效作用可能和Huh7細胞MCL-1的下調有關。當在Huh7細胞中轉染MCL-1質粒后,γδ T細胞聯合槲皮素對Huh7的細胞毒性受到明顯抑制(表3),表明槲皮素通過下調Huh7細胞中MCL-1蛋白的表達增強γδ T細胞對其的細胞毒性。另外,流式細胞實驗顯示,槲皮素單獨處理不影響線粒體膜電位,但其通過抑制Huh-1的表達促進γδ T細胞依賴的線粒體膜電位下降,說明槲皮素能顯著增強γδ T細胞對Huh7細胞線粒體膜電位的損傷(圖3),而Western blot實驗結果則顯示槲皮素抑制MCL-1蛋白的表達顯著促進γδ T細胞依賴的細胞色素C的釋放和凋亡標志蛋白caspase-9和caspase-3的活化(圖2),表明槲皮素通過MCL-1/線粒體途徑增強γδ T細胞對肝癌的細胞毒性。
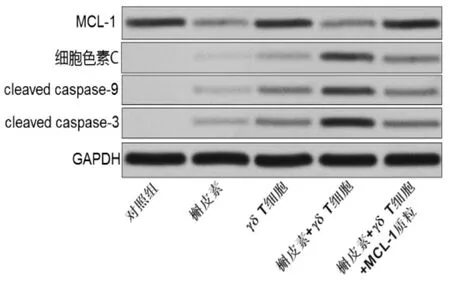
圖2 各組MCL-1表達水平
表3 槲皮素增強γδ T細胞對Huh7細胞的細胞毒性(±s)
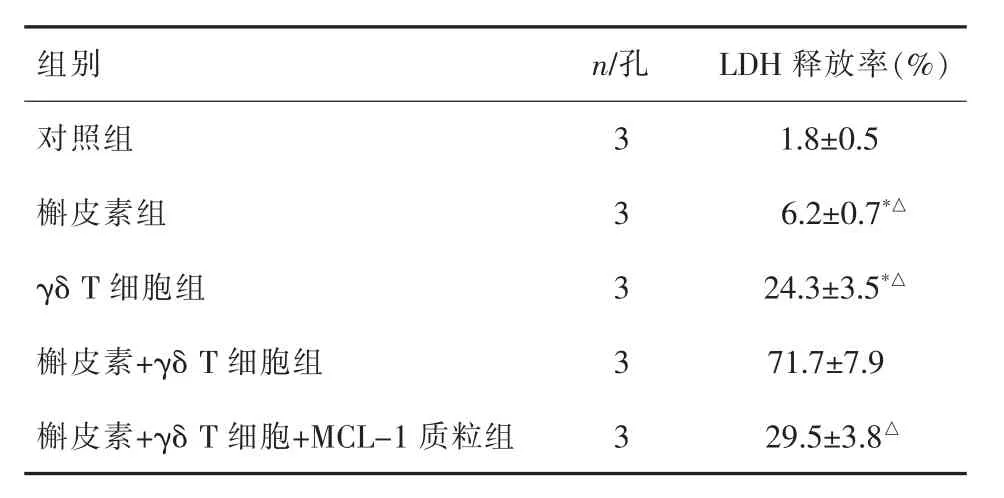
表3 槲皮素增強γδ T細胞對Huh7細胞的細胞毒性(±s)
與對照組比較*P<0.05,與槲皮素+γδ T細胞組比較△P<0.05
組別 n/孔 L D H釋放率(%)對照組 3 1.8±0.5槲皮素組 3 6.2±0.7*△γ δ T 細胞組 3 2 4.3±3.5*△槲皮素+γ δ T 細胞組 3 7 1.7±7.9槲皮素+γ δ T 細胞+M C L-1質粒組 3 2 9.5±3.8△
3 討論
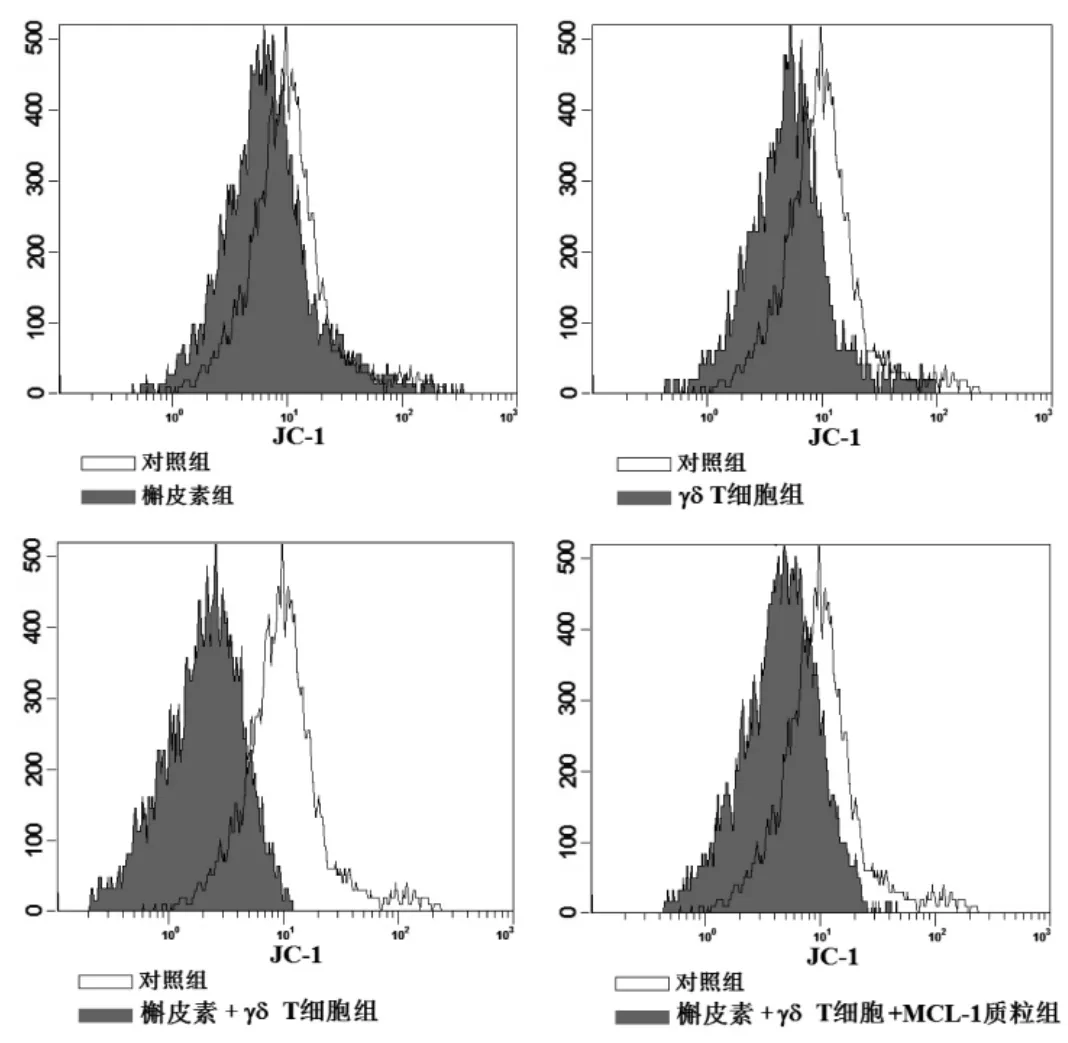
圖3 槲皮素對Huh7細胞線粒體膜電位的影響
肝癌是世界上發病率最高的消化道惡性腫瘤之一,預后差,死亡率居所有惡性腫瘤的第3位[4]。在肝癌治療中,盡管手術和肝移植治療是目前最有效的治療手段,然而對于不能進行手術的患者而言,免疫治療是不可缺少的替代治療手段[5],而一些免疫效應細胞也已經開始作為藥物進行臨床試驗,用于腫瘤治療[6]。槲皮素是一種天然黃酮類化合物,有較好的抗氧化和抗炎作用,近幾年的研究表明槲皮素還有一定的抗腫瘤效應,能增強腫瘤細胞對凋亡信號通路的敏感性[7]。然而,槲皮素對腫瘤免疫治療的協同作用至今無充分報道。本研究結果表明槲皮素能顯著增強γδ T細胞對肝癌的細胞毒性,因此槲皮素可作為一種免疫治療輔助藥物。
MCL-1是屬于Bcl-2蛋白家族的抗凋亡蛋白成員。研究表明人類腫瘤細胞中MCL-1往往會發生過表達,這可能是腫瘤細胞對不良環境的適應。通過輔助治療降低腫瘤細胞中MCL-1的表達水平,可以有效抑制腫瘤細胞的生長增殖,并降低其對化療藥物的耐藥性[8],因此MCL-1可以作為腫瘤治療的一個重要靶點。γδ T細胞現已被作為一種免疫治療藥物進行臨床試驗。這種T細胞亞群主要通過分泌一些凋亡誘導因子使腫瘤細胞發生凋亡。在γδ T細胞介導的凋亡信號通路中,其分泌的凋亡誘導因子能引起線粒體膜電位的下降,從而使細胞色素C等凋亡活性物質從線粒體中釋放到細胞質中,導致caspase-9和caspase-3的活化,最終細胞凋亡[9-11]。
在本研究中,為了探討槲皮素增強γδ T細胞抗肝癌活性的分子機制,進行了western blot實驗。結果發現槲皮素能顯著下調肝癌細胞中MCL-1這一抗凋亡蛋白的表達水平。當用重組真核過表達質粒上調肝癌細胞中MCL-1的蛋白水平后,槲皮素對γδ T細胞的協同抗腫瘤作用受到明顯抑制,證明槲皮素是通過降低肝癌中MCL-1蛋白的表達促進γδ T細胞介導的線粒體途徑的凋亡。
綜上所述,本研究證明了槲皮素能有效提高γδ T細胞對肝癌的細胞毒性,增強γδ T細胞治療效果,為腫瘤免疫治療提供了更有效的策略和思路。
[1]Li Z.Potential of human gammadelta T cells for immunotherapy of osteosarcoma.Mol Biol Rep,2013,40(1):427
[2]Gonnermann D,Oberg HH,Wesch D,et al.Resistance of cyclooxygenase-2 expressing pancreatic ductal adenocarcinoma cells against γδ T cell cytotoxicity.Oncoimmunology,2015,4(3):e988460
[3]Prathapan A,Vineetha VP,Raghu KG.Protective effect of Boerhaavia diffusa L.against mitochondrial dysfunction in angiotensin II induced hypertrophy in H9c2 cardiomyoblast cells.PLoS One,2014,9(4):e96220
[4]Siegel R,Naishadham D,Jemal A.Cancer statistics.CA Cancer J Clin,2013, 63(1):11
[5]Sugai S,Yoshikawa T,Nakatsura T, et al.Hepatocellular carcinoma cell sensitivity to Vγ9Vδ2 T lymphocyte-mediated killing is increased by zoledronate.Int J Oncol, 2016, 48(5):1794
[6]Dokouhaki P,Schuh NW,Zhang L,et al.NKG2D regulates production of soluble TRAIL by ex vivo expanded human γδ T cells.Eur J Immunol,2013, 43(12):3175
[7]Xiang T,Fang Y,Wang SX.Quercetin suppresses HeLa cells by blocking PI3K/Akt pathway.J Huazhong Univ Sci Technolog Med Sci,2014, 34(5):740
[8]Mattoo AR,Zhang J,Jessup JM,et al.Inhibition of NANOG/NANOGP8 down regulates MCL-1 in colorectal cancer cells and enhance the therapeutic efficacy of BH3 mimetics.Clin Cancer Res,2014,20(21):5446
[9]Zou C,Zhao P,Fu L,et al.γδ T cells in cancer immunotherapy.Oncotarget,2017, 8(5):8900
[10]Huang G,Chen X,Xing C,et al.miR-20a-directed regulation of BID is associated with the TRAIL sensitivity in colorectal cancer.Oncol Rep,2017,37(1):571
[11]Laussmann MA,Passante E,Rehm M,et al.Proteasome inhibition can impair caspase-8 activation upon submaximal stimulation of apoptotic tumor necrosis factor-related apoptosis inducing ligand (TRAIL) signaling.J Biol Chem,2012,287(18):14402

