乳腺癌組織中RASAL2的表達變化及意義
王昭昕,李淑琴,王培順,王巖,高希濤
(連云港市第一人民醫院,江蘇連云港 222002)
乳腺癌全球每年新發病例約170萬,約占女性惡性腫瘤的25%,死亡病例約50萬,約占女性腫瘤相關死亡的15%[1]。近年來,以手術為基礎并輔以放化療、靶向治療的綜合治療方案,取得較大進展,但乳腺癌患者的預后仍不樂觀,術后復發和侵襲轉移是導致患者不良預后甚至死亡的重要原因[2],臨床亟需尋找新的有效生物分子靶標[3,4]。大鼠肉瘤蛋白活化因子2(RASAL2)是一種Ras GTP酶活性蛋白(GAP),由RASAL2基因編碼,定位于人染色體1q25。RASAL2是RAS基因的一個重要活性蛋白,近年研究[5]表明,RASAL2具有潛在的腫瘤抑制功能,在卵巢癌[6]、肺癌[7]及星形細胞瘤[8]等多種惡性腫瘤的侵襲轉移過程中發揮重要作用,且與患者不良預后密切相關。而關于RASAL2在乳腺癌中的表達情況及其與患者預后的關系,目前國內外研究較少。2010年1月~2017年6月,我們采用免疫組化SP法檢測乳腺癌組織及癌旁組織中RASAL2表達,并探討其意義。
1 資料與方法
1.1臨床資料選取我院2010年1月~2012年1月乳腺癌患者70例。納入標準:完整的病例治療;術前未進行雌激素及放化療的治療;術后標本經病理證實為浸潤性乳腺癌;所有患者簽署知情同意書。排除標準:肝、腎疾病,免疫系統疾病,嚴重的心腦血管疾病及感染性疾病。患者年齡:<45歲28例,≥45歲42例;絕經前21例,絕經后49例;腫瘤直徑:≤3 cm 34例,>3 cm 36例;有淋巴結轉移46例,無淋巴結轉移24例;存在脈管侵襲41例,無脈管侵襲29例;組織學分級:I+Ⅱ級31例,Ⅲ級39例;TNM分期,I+Ⅱ期25例,Ⅲ+Ⅳ期45例;三陰乳腺癌22例,非三陰乳腺癌48例。本研究經醫院倫理委員會審核同意。采用電話或者門診的方式進行隨訪,隨訪時間為手術后6~60個月。
1.2乳腺癌組織及癌旁組織中RASAL2表達檢測采用免疫組化SP法。取手術切除的乳腺癌組織及其癌旁正常組織(距腫瘤邊緣≥1 cm),4%中性甲醛固定,石蠟包埋,5 μm厚切片;切片常規脫蠟至水,3%H2O2室溫孵育10 min,PBS洗滌,微波修復抗原,滴加正常山羊血清室溫封閉20 min,棄去血清,滴加RASAL2一抗工作液(美國Santa公司,稀釋比1∶150),37 ℃孵育2 h,PBS洗滌3次,每次5 min,滴加生物素二抗(北京普博斯生物科技有限公司,稀釋比1∶200),室溫孵育30 min,PBS洗滌3次,每次5 min,DAB顯色,充分沖洗后,蘇木素復染,常規脫水,透明,干燥,封片。以PBS替代一抗作陰性對照。RASAL2蛋白陽性表達主要定位于細胞質,顯微鏡(CK30-F200,日本Olympus公司)下觀察,對細胞染色強度進行評分:棕褐色為3分,棕黃色為2分,淡黃色為1分,無著色為0分。顯微鏡下計數陽性細胞,隨機觀察10個高倍鏡視野,平均每個高倍鏡視野的陽性細胞數:無著色為0分,1~25%為1分,26~50%為2分,51~75%為3分,>75%為4分。最后得分為兩項乘積(0~12),≥5判定為陽性表達。
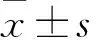
2 結果
2.1RASAL2在乳腺癌及癌旁組織中的表達比較乳腺癌及癌旁組織中RASAL2的陽性表達率分別為32.86%(23/70)、88.57%(62/70),二者比較,P<0.05。
2.2RASAL2表達與乳腺癌患者臨床病理特征的關系乳腺癌組織中,RASAL2表達與患者年齡、絕經狀態、腫瘤大小、組織學分級無關(P均>0.05),而與淋巴結轉移、脈管侵襲、TNM 分期、三陰乳腺癌有關(P均<0.05),見表1。
2.3RASAL2表達與乳腺癌患者預后的關系本研究中70例乳腺癌患者,術后獲隨訪6~60個月,其中死亡8例。將患者分為RASAL2陰性表達組(47例)與RASAL2陽性表達組(23例),繪制的Kaplan-Meier生存曲線結果顯示,RASAL2陰性表達組的術后5年生存率為85.11%(40/47),生存時間為6~60(53.28±2.09)個月,而RASAL2陽性表達組的術后5年生存率為95.65%(22/23),生存時間為12~60(59.74±0.26)個月。Log-Rank檢驗結果顯示,RASAL2陽性表達者生存時間較陰性表達者延長(χ2=7.037,P=0.008)。
3 討論
乳腺癌是一種高度異質性腫瘤,根據其基因表達不同,可分為五種分子亞型,包括Luminal A型、Luminal B型、HER2過表達型、Basal型(即三陰性型)和Normal型,不同分子亞型之間,其腫瘤生物學行為、生長速度、特定信號通路活性及腫瘤細胞組成方面存在顯著差異[9]。
在多數腫瘤細胞中,存在RAS信號通路的異常激活[10],有研究證實,RAS上游誘導因子或下游效應因子發生基因突變是RAS信號通路異常激活的主要機制[10, 11]。RAS的GTP酶是RAS信號通路的重要調節因子,RAS與鳥嘌呤核苷酸交換因子(GEF)和GAP共同組成RAS信號通路的開關。GEF激活GDP轉變為GTP,激活RAS信號通路,而GAPs則促進GTP水解為GDP,終止激活作用[12]。RASAL2屬于GAP家族,在腫瘤形成和侵襲過程中發揮作用,如甲狀腺癌[13]等。本研究結果發現,RASAL2在乳腺癌組織中的陽性表達率低于癌旁組織,差異有統計學意義,提示RASAL2在乳腺癌中可能發揮抑癌基因功能,其表達缺失促進了乳腺癌的腫瘤形成。
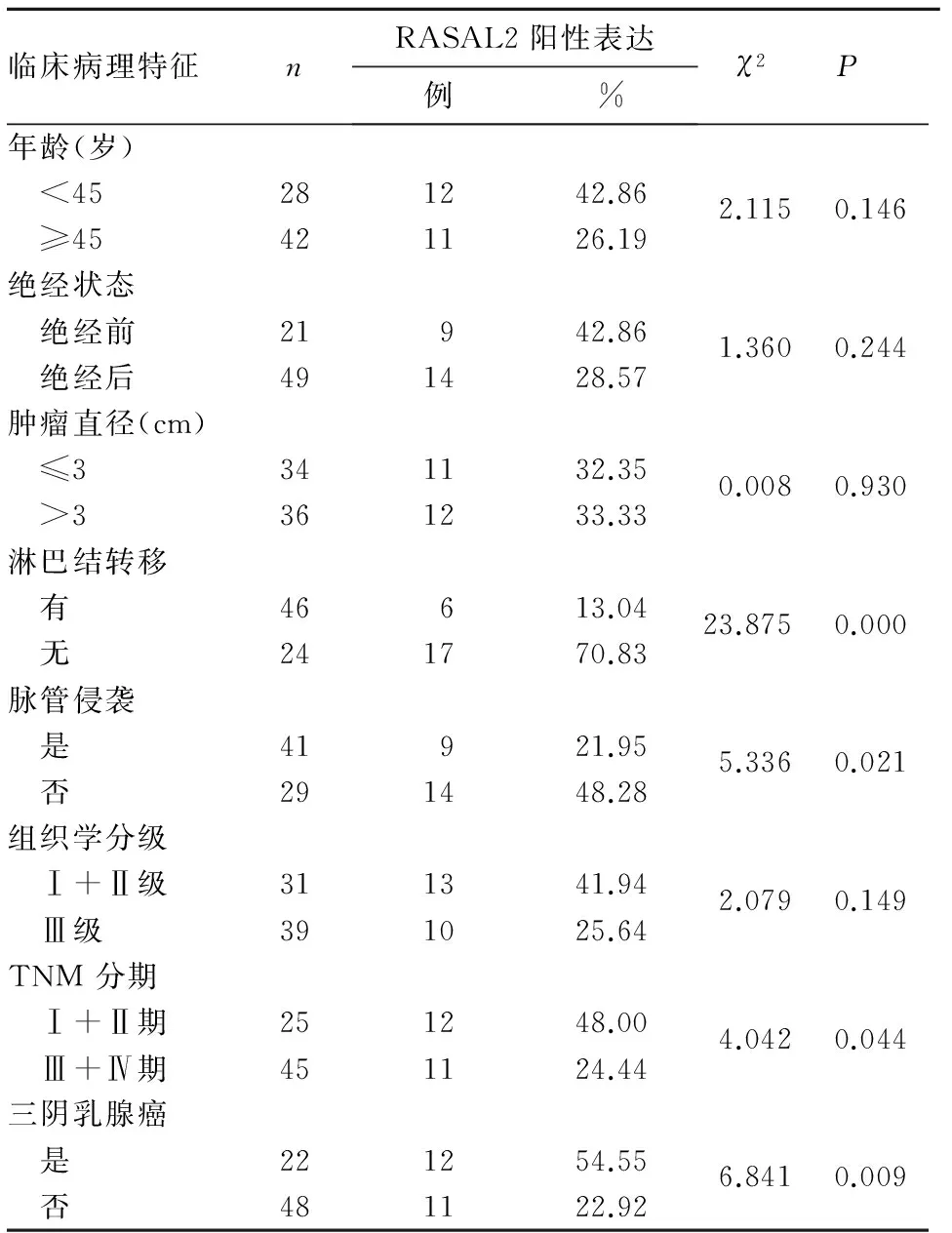
表1 RASAL2表達與乳腺癌患者臨床病理
本研究進一步分析發現,存在淋巴結轉移、脈管侵襲及TNM分期高的乳腺癌組織中RASAL2陽性表達率低,且Kaplan-Meier生存曲線結果表明,RASAL2陽性表達率低的乳腺癌患者術后5年總生存率和平均生存時間均較低,以上結果提示RASAL2低表達與乳腺癌患者的淋巴結轉移、侵襲和不良預后密切相關,與McLaughlin等[5]的研究結果一致。
最近研究證實,在三陰乳腺癌和雌激素受體(ER)陰性乳腺癌中,具有抗遷移能力的microRNA-203表達降低,而RASAL2作為microRNA-203的靶基因,其表達則顯著增加,且高表達RASAL2是乳腺癌不良預后的潛在靶標[15]。本研究結果亦發現,在三陰乳腺癌組織中,RASAL2的陽性表達率顯著高于非三陰乳腺癌,與上述研究結果一致,提示RASAL2在三陰乳腺癌中發揮抑癌基因功能。
綜上所述,RASAL2在乳腺癌組織中的陽性表達低于癌旁組織,且其低表達與乳腺癌患者的淋巴結轉移、脈管侵襲和腫瘤TNM分期密切相關,提示RASAL2是乳腺癌腫瘤發生和惡性進展中一個重要調節因子。
參考文獻:
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Hainaut P, Plymoth A. Targeting the hallmarks of cancer: towards a rational approach to next-generation cancer therapy[J]. Curr Opin Oncol, 2013,25(1):50-51.
[3] Yamamoto S, Han W, Kim Y, et al. Breast Cancer: Radiogenomic Biomarker Reveals Associations among Dynamic Contrast-enhanced MR Imaging, Long Noncoding RNA, and Metastasis[J]. Radiology, 2015,275(2):384-392.
[4] Omenn GS, Guan Y, Menon R. A new class of protein cancer biomarker candidates: differentially expressed splice variants of ERBB2 (HER2/neu) and ERBB1 (EGFR) in breast cancer cell lines[J]. J Proteomics, 2014,107:103-112.
[5] McLaughlin SK, Olsen SN, Dake B, et al. The RasGAP gene, RASAL2, is a tumor and metastasis suppressor[J]. Cancer Cell, 2013,24(3):365-378.
[6] Huang Y, Zhao M, Xu H, et al. RASAL2 down-regulation in ovarian cancer promotes epithelial-mesenchymal transition and metastasis[J]. Oncotarget, 2014,5(16):6734-6745.
[7] Li N, Li S. RASAL2 promotes lung cancer metastasis through epithelial-mesenchymal transition[J]. Biochem Biophys Res Commun, 2014,455(3-4):358-362.
[8] Weeks A, Okolowsky N, Golbourn B, et al. ECT2 and RASAL2 mediate mesenchymal-amoeboid transition in human astrocytoma cells[J]. Am J Pathol, 2012,181(2):662-674.
[9] Dai X, Xiang L, Li T, et al. Cancer Hallmarks, Biomarkers and Breast Cancer Molecular Subtypes[J]. J Cancer, 2016,7(10):1281-1294.
[10] Downward J. Targeting RAS signalling pathways in cancer therapy[J]. Nat Rev Cancer, 2003,3(1):11-22.
[11] Pylayeva-Gupta Y, Grabocka E, Bar-Sagi D. RAS oncogenes: weaving a tumorigenic web[J]. Nat Rev Cancer, 2011,11(11):761-774.
[12] Bos JL, Rehmann H, Wittinghofer A. GEFs and GAPs: critical elements in the control of small G proteins[J]. Cell, 2007,129(5):865-877.
[13] Xu Y, Deng Y, Ji Z, et al. Identification of thyroid carcinoma related genes with mRMR and shortest path approaches[J]. PLoS One, 2014,9(4):e94022.

