潰瘍性結腸炎小鼠外周血和結腸組織中Tfh、Tfr細胞水平變化及意義
李世權,呂曉丹,謝彥飛,陳蘭,詹靈凌,呂小平
(廣西醫科大學第一附屬醫院,南寧530021)
炎癥性腸病(IBD)包括潰瘍性結腸炎(UC)和克羅恩病,其病因和發病機制尚不清楚。腸道黏膜內免疫反應的過度活化是導致IBD發生發展的關鍵[1]。濾泡輔助性T細胞(Tfh)和濾泡調節性T細胞(Tfr)是CD4+T細胞新的亞型。Tfh高表達趨化因子受體(CXCR5)、程序性細胞死亡蛋白1(PD-1)、誘導協同刺激分子(ICOS)、白細胞介素21(IL-21)等細胞因子,在促進和維持生發中心(GC)的形成、刺激B細胞分化、產生高親和力抗體、抗體類別轉換及維持長時間體液免疫應答中發揮重要作用[2]。Tfr能限制GC反應,調節Tfh細胞分化,起到維持免疫耐受和防止自身免疫的作用[3]。Tfh、Tfr細胞在濾泡GC平衡機體免疫穩態方面起重要作用。研究顯示,Tfh/Tfr平衡紊亂,則自身免疫性疾病(類風濕關節炎、IBD、1型糖尿病、系統性紅斑狼瘡、重癥肌無力、原發性干燥綜合征等)的發病風險增加[4~6]。IBD發病是否與Tfh/Tfr的失衡有關報道較少。2016年5月~2017年6月,我們觀察了潰瘍性結腸炎小鼠外周血及結腸組織中Tfh和Tfr的水平變化,并探討其臨床意義。
1 材料與方法
1.1動物、試劑及儀器來源20只健康雄性昆明小鼠(9~12周齡,體質量40~45 g)購自廣西醫科大學實驗動物中心。三硝基苯磺酸(TNBS)購自Sigma公司;淋巴細胞分離液購自北京索萊寶公司;流式細胞術熒光標記一抗CD4抗體(APC)、PD-1抗體(FITC)、FOXP3抗體(PerCP/Cy5.5?)及對應的同型對照抗體均購自Abcam公司,Anti-Mouse CXCR5(PE)及其同型對照抗體購自BD公司;三色免疫熒光一抗抗小鼠Foxp3 eFluor 660、抗CD185(CXCR5)eFluor 450、抗CD4 FITC、抗CD279(PD-1)APC購自eBioscience公司;Western blotting抗體GAPDH購自Abcam公司、PD-1抗體購自Novusbio公司。冷凍離心機購自德國Eppendorf公司;流式細胞儀購自美國BD公司;石蠟切片機及病理圖像分析儀購自德國Leica公司;共聚焦顯微鏡購自Olympus公司;電泳儀power/pac300購自美國Bio-Rad公司;垂直電泳槽購自北京六一儀器廠。
1.2動物分組及UC模型建立將小鼠按隨機數字表法分為正常對照組、觀察組各10只。觀察組制備小鼠UC模型,參考文獻[7]方法。造模前小鼠適應性喂養3 d,保持室溫20~22 ℃,濕度50%,明暗交替周期12 h;禁食24 h后,予4%水合氯醛按40 mg/kg腹腔注射麻醉后,由肛門插入直徑5 mm硅膠管至腸道內約8 cm,一次性結腸灌注100 mg/kg TNBS(溶于50%乙醇溶液)0.4 mL,提起小鼠尾部倒立3 min,放回籠內常規飼養。正常對照組予相同劑量的0.9%氯化鈉溶液灌腸。造模第8天,予4%水合氯醛40 mg/kg腹腔注射麻醉,用標記的肝素抗凝采血管收集小鼠腹主動脈血2 mL,迅速置于4 ℃冰箱中,并將小鼠結腸取出縱行切開,用冰生理鹽水反復沖洗干凈,以潰瘍部位為中心用眼科剪剪取直徑約1 cm結腸組織數塊,一部分置入4%多聚甲醛溶液固定,另一部分置于-80 ℃冰箱或液氮中保存備用。
1.3小鼠癥狀、體征觀察造模過程中每天記錄小鼠體質量、大便情況,進行大便潛血實驗。采用UC疾病活動指數(DAI)[8]對小鼠的體質量、大便性狀、出血情況進行評分。體質量不變為0分,體質量下降1%~5%為1分,6%~10%為2分,11%~15%為3分,>15%為4分;大便性狀正常為0分,大便松散為2分,黏糊狀為3分,腹瀉為4分;大便正常為0分,隱血弱陽性為2分,隱血強陽性為3分,顯性出血為4分。計算以上3項評分的平均值。
1.4小鼠結腸組織病理變化觀察取石蠟切片,行HE染色,在光學顯微鏡下觀察腸黏膜損傷情況。組織損傷評價參照Schmidt等[9]的評分標準,包括炎癥細胞浸潤及組織損傷兩方面。炎癥細胞浸潤評分:無炎癥細胞浸潤為0分,炎癥細胞浸及固有黏膜層1分,炎癥細胞浸及黏膜下層2分,炎癥細胞浸及整個腸壁3分;組織損傷評分:無黏膜損傷0分,不連續黏膜上皮損傷為1分,黏膜有糜爛或輕度潰瘍為2分,嚴重黏膜損傷伴潰瘍侵及腸壁為3分。計算兩項評分的平均值。
1.5小鼠外周血CD4+CXCR5+Foxp3+Tfr、CD4+CXCR5+PD-1+Tfh檢測采用流式細胞術。取小鼠EDTA抗凝的外周血2 mL,用Ficoll密度梯度離心法分離外周血單個核細胞,用細胞計數板計數,將細胞稀釋為10×106/mL。Tfh流式管內加入CD4(APC)、PD-1(FITC)、CXCR5(PE)流式抗體各2 μL,進行三色熒光標記,于4 ℃避光孵育20 min。Tfr流式管加入CD4(APC)、CXCR5(PE)流式抗體各2 μL,4 ℃避光孵育20 min后,加入FoxP3破膜液500 μL,于37 ℃避光孵育30 min,加入FoxP3(PerCP/Cy5.5?)抗體或FoxP3 1 μL,室溫避光孵育20 min,用PBS 2 mL清洗,4 ℃、1 500 r/min離心5 min,4 ℃,棄上清,重復清洗1次。加入PBS 300 μL重懸細胞,采用流式細胞儀檢測外周血單個核細胞中CD4+CXCR5+Foxp3+Tfr、CD4+CXCR5+PD-1+Tfh細胞在CD4+T細胞中的比例。
1.6小鼠結腸組織中CD4+CXCR5+Foxp3+Tfr、CD4+CXCR5+PD-1+Tfh檢測采用三色免疫熒光標記法。將結腸組織病理切片脫蠟、水化、清洗,置于0.01 mol/L枸鹽酸緩沖液(pH 6.0)中行高壓熱修復,水洗,用3%雙氧水室溫孵育10 min,PBS沖洗5 min×2次;免疫組化筆劃圈,滴加正常山羊血清封閉液50 μL,置于室溫20 min后封閉;一抗4 ℃孵育過夜(三標三抗體同時加,濃度均為1∶100);PBS洗3次,去離子水洗2次,每次5 min;抗熒光淬滅劑封片,共聚焦顯微鏡下觀察并拍照記錄;圖像采用Image-Pro Plus5.0軟件分析,以光密度與分布面積的比值表示CD4+CXCR5+Foxp3+Tfr、CD4+CXCR5+PD-1+Tfh細胞因子在結腸組織中的表達量。
1.7結腸組織中PD-1蛋白表達檢測采用Western blotting法。提取各組小鼠腸黏膜組織中的總蛋白,使用BCA蛋白定量試劑盒在570 nm波長處測定總蛋白濃度。蛋白經過10% SDS-PAGE電泳后,將凝膠中蛋白電轉移至硝酸纖維素膜上,以TBST液配置5%脫脂奶粉溶液進行封閉,加入PD-1一抗(1∶1 000),于搖床上4 ℃孵育過夜,洗滌后加入熒光二抗(1∶10 000),室溫孵育60 min后,ECL底物化學發光顯色后曝光顯影。目標條帶使用圖像分析軟件進行分析,目的蛋白的灰度值/內參GAPDH的灰度值以校正誤差,所得結果代表樣品目的蛋白相對表達量。
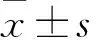
2 結果
2.1兩組癥狀、體征比較正常對照組小鼠反應靈敏,飲食活動正常,毛發有光澤,無便血,DAI為0。觀察組造模次日出現懶動、拱背、厭食、體質量下降、糞便隱血陽性,進食和飲水量減少;隨著時間推移,觀察組小鼠癥狀逐漸加重,造模第2~7天出現不同程度的肉眼血便,DAI為(2.65±1.13)分,與正常對照組比較差異有統計學意義(P<0.05)。
2.2兩組組織學變化比較正常對照組小鼠結腸黏膜層單層柱狀上皮細胞排列整齊完整,腸腺清晰,可見大量吸收細胞與杯狀細胞,形態正常,無炎性細胞浸潤,肌層薄厚均勻無異常改變。觀察組小鼠結腸炎癥主要累及黏膜和黏膜下層,少數可達漿膜層,結腸黏膜不完整,可見多灶性淺潰瘍,大部分腺體被破壞,腺體正常結構喪失,排列紊亂,腺腔大多消失;可見大量淋巴細胞、中性粒細胞等炎性細胞浸潤。觀察組組織損傷評分[(5.25±0.89)分]高于正常對照組[(0.30±0.48)分],兩組比較差異有統計學意義(P<0.05)。
2.3兩組外周血Tfh、Tfr細胞比例比較與正常對照組比較,觀察組外周血Tfh細胞比例高,Tfr細胞比例低,Tfh/Tfr高(P均<0.05)。見表1。
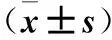
表1 兩組外周血Tfh、Tfr細胞比例比較
2.4兩組結腸組織中Tfh、Tfr細胞比例比較與正常對照組比較,觀察組小鼠結腸組織中Tfh細胞比例高,Tfr細胞比例低(P均<0.05)。見表2。
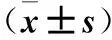
表2 兩組結腸組織中Tfh、Tfr細胞比例比較
2.5兩組結腸組織中PD-1蛋白表達比較正常對照組、觀察組PD-1蛋白相對表達量分別為0.09±0.01、0.16±0.03,兩組比較,P<0.05。
3 討論
目前IBD的確切病因尚還清楚,但公認的病因是機體對腸道(細菌)抗原的免疫反應失衡,導致腸黏膜發生過度炎癥反應。引起腸道黏膜免疫反應的免疫細胞主要為CD4+T淋巴細胞,可分化為輔助性T細胞(Th1)、Th2、Th17、胸腺調節性T細胞(Treg)等多種功能性的免疫細胞,通過表達與合成不同細胞因子在黏膜炎癥反應中起主要作用,Th1/Th2、Th17/Treg失調產生過量的促炎性細胞因子,從而導致腸道炎癥損傷,與IBD的發生發展有重要關系[10,11]。近年來在淋巴GC中發現兩類新型的CD4+T細胞亞群,Tfh和Tfr細胞,Tfh細胞高表達CXCR5,在B細胞表達的細胞因子CXCL13趨化作用下,促使Tfh遷移至B淋巴細胞濾泡區域;Tfh高表達轉錄因子Bcl-6和ICOS,對Tfh細胞的分化和維持具有重要作用[12];此外,Tfh細胞還分泌大量的細胞因子IL-21[13]。Tfr從Treg分化而來[10],其表面不僅表達Treg細胞的特征性轉錄因子FoxP3,而且還高表達Tfh細胞一樣的趨化受體CXCR5,能趨化定位到GC調節Tfh細胞的數量,抑制B細胞的分化成熟及抗體生成。缺乏Tfr細胞或Tfr/Tfh失衡將產生大量自身抗體,從而增加自身免疫性疾病的發病風險[14]。Tfr細胞對動物實驗模型和自身免疫性疾病患者表現出抗自身免疫的保護作用。因此,通過分析Tfr細胞和Tfh細胞間的比例變化,不僅對預測機體免疫反應的質量和數量有幫助,且通過調節Tfr細胞治療自身免疫性疾病將成為可能[15,16]。
功能性相似的Tfh細胞不僅表達在人和動物實驗模型的次級淋巴器官,在外周血中同樣發現類似的CXCR5+Tfh細胞。本研究結果顯示,TNBS誘導小鼠UC后,其外周血Tfh細胞比例升高,與既往研究[4,6]結果一致。此外,本研究發現UC小鼠外周血Tfr細胞比例下降,Tfh/Tfr升高。提示外周血Tfh/Tfr異常可能在IBD自身免疫反應中發揮重要作用。
本研究結果顯示,UC小鼠結腸組織CD4+CXCR5+PD-1+Tfh水平升高,而CD4+CXCR5+Foxp3+Tfr水平下降,PD-1蛋白表達升高。Tfh在發揮輔助B細胞功能時,需高表達CXCR5,而位于B細胞區的濾泡樹突狀細胞分泌CXCR的配體CXCL13,通過PI3K信號通路傳導促使Tfh遷移到T-B細胞的交界區,在交界區域接受眾多細胞因子的刺激,同時與B細胞相互作用,進一步分化為成熟的Tfh細胞,并趨化至濾泡區與B細胞形成GC,協助B細胞分化成熟,并實現Tfh自身的分化。Tfh細胞同樣高表達抑制性受體PD-1,與CXCR5、ICOS一樣亦是Tfh細胞的表面標志物之一,可能給Tfh細胞提供一個抑制性的信號,防止CD4+T細胞過度分化為Tfh細胞。PD-1通過與PD-L1相互作用抑制Tfr細胞的數量,促進Tfr細胞向Tfh細胞轉化[2]。本研究結果亦提示結腸組織中CD4+CXCR5+PD-1+Tfh和CD4+CXCR5+Foxp3+Tfr的異常表達及PD-1異常升高可能成為UC發病的機制之一。
總之,Tfh細胞及PD-1水平升高,導致Tfr細胞的表達受到抑制,Tfh/Thr比例失衡可能在IBD的發病機制中扮演重要角色,此為探討IBD的發病機制及治療措施提供了理論依據。
參考文獻:
[1] Sreedhar R, Arumugam S, Thandavarayan RA, et al. Curcumin as a therapeutic agent in the chemoprevention of inflammatory bowel disease[J]. Drug Discov Today, 2016,21(5):843-849.
[2] Sage PT, Francisco LM, Carman CV, et al. The receptor PD-1 controls follicular regulatory T cells in the lymph nodes and blood[J]. Nat Immunol, 2013,14(2):152-161.
[3] Wollenberg I, Agua-Doce A, Hernandez A, et al. Regulation of the germinal center reaction by Foxp3+ follicular regulatory T cells[J]. J Immunol, 2011,187(9):4553-4560.
[4] Simpson N, Gatenby PA, Wilson A, et al. Expansion of circulating T cells resembling follicular helper T cells is a fixed phenotype that identifies a subset of severe systemic lupus erythematosus[J]. Arthritis Rheum, 2010,62(1):234-244.
[5] Costantino AB, Acosta CD, Onetti L, et al. Follicular Helper T cells in peripheral blood of patients with rheumatoid arthritis[J]. Reumatol Clin, 2016,13(6):338-343.
[6] Wang Z, Wang Z, Diao Y, et al. Circulating follicular helper T cells in Crohn′s disease (CD) and CD-associated colorectal cancer[J]. Tumour Biol, 2014,35(9):9355-9359.
[7] Salaga M, Mokrowiecka A, Zakrzewski PK, et al. Experimental colitis in mice is attenuated by changes in the levels of endocannabinoid metabolites induced by selective inhibition of fatty acid amide hydrolase (FAAH)[J]. J Crohns Colitis, 2014,8(9):998-1009.
[8] Sanchez-Fidalgo S, Cardeno A, Sanchez-Hidalgo M, et al. Dietary extra virgin olive oil polyphenols supplementation modulates DSS-induced chronic colitis in mice[J]. J Nutr Biochem, 2013,24(7):1401-1413.
[9] Schmidt N, Gonzalez E, Visekruna A, et al. Targeting the proteasome: partial inhibition of the proteasome by bortezomib or deletion of the immunosubunit LMP7 attenuates experimental colitis[J]. Gut, 2010,59(7):896-906.
[10] Maceiras AR, Almeida SCP, Mariotti-Ferrandiz E, et al. T follicular helper and T follicular regulatory cells have different TCR specificity[J]. Nat Commun, 2017,8:15067.
[11] Shale M, Schiering C, Powrie F. CD4+T-cell subsets in intestinal inflammation[J]. Immunol Rev, 2013,252(1):164-182.
[12] Choi YS, Kageyama R, Eto D, et al. ICOS receptor instructs T follicular helper cell versus effector cell differentiation via induction of the transcriptional repressor Bcl-6[J]. Immunity, 2011,34(6):932-946.
[13] Nurieva RI, Chung Y, Hwang D, et al. Generation of T follicular helper cells is mediated by interleukin-21 but independent of T helper 1, 2, or 17 cell lineages[J]. Immunity, 2008,29(1):138-149.
[14] Sage PT, Sharpe AH. T follicular regulatory cells in the regulation of B cell responses[J]. Trends Immunol, 2015,36(7):410-418.
[15] Fukuyo S, Nakayamada S, Iwata S, et al. Abatacept therapy reduces CD28+CXCR5+ follicular helper-like T cells in patients with rheumatoid arthritis[J]. Clin Exp Rheumatol, 2017,35(4):562-570.
[16] Pitzalis C, Jones GW, Bombardieri M, et al. Ectopic lymphoid-like structures in infection, cancer and autoimmunity[J]. Nat Rev Immunol, 2014,14(7):447-462.

