酒醅發酵法降解河豚毒素的條件優化研究
喬 菊,代啟虎,李 冉,梁田田,盧 瑛,李柏林,歐 杰
上海海洋大學 食品學院,分子生物學實驗室,農業部水產品貯藏保鮮質量安全風險評估實驗室(上海),上海 201306
河豚毒素(Tetrodotoxin,TTX)是一種毒性非常強的海洋生物活性物質,它是典型的神經N a+通道阻斷劑。最初主要是從豚科魚(Tetrodontidae)中被發現,被Tahara(1909)命名為Tetrodotoxin。
TTX是世界上最致命的生物毒素之一[1],毒性是氰化鈉的1250倍,0.5 mg就可以致人于死命[2]。TTX中毒之后,它的潛伏期短、同時病死率很高,吸收后會損壞中樞神經和末梢神經系統,使神經傳導出現障礙,先會感到神經麻痹,后是運動神經麻痹,嚴重的腦干麻痹則會導致呼吸循環衰竭[3]。TTX主要分布在河豚的卵巢、腎臟、肝臟、血液、眼睛、魚鰓還有皮膚內,尤是以卵巢和肝臟中含量較多[4]。TTX及其類似物不僅分布于河豚魚體內,另外還存在于多種脊椎及無脊椎動物體內,例如兩棲動物、棘皮動物、節肢動物、軟體動物等[5]。TTX的理化性質非常穩定,在中性和酸性溶液中穩定,在堿性水溶液中比較容易被分解,降解為幾種喹啉化合物[6]。TTX一般難以通過烹調手段來破壞,中毒后也沒有有效的解救措施[7]。
在白酒釀造過程中,酒醅是指加酒曲后發酵好的糧食。這類糧食發酵過程中,會有大量的微生物繁殖生長,其中的微生物主要有酵母、霉菌和細菌。在日本的石川縣,用河豚卵巢做的米糠浸漬醬菜,是用鹽腌藏河豚卵巢,然后放入到米糠中讓其發酵,鹽漬一段時間之后,
河豚卵巢的毒性可降低到一個可食用的范圍[8]。這可能是米糠中的某些微生物有降解TTX毒性的作用。方國鋒等用EDC/NHS化學偶聯法將磁性納米微球與TTX單克隆抗體(實驗室自備)[9]進行偶聯,制備了磁性免疫探針,又參考徐曉巍等的方法[10]制成了免疫層析試紙條。本研究采用此試紙
1 材料與方法
條為測量方法,利用酒醅中的微生物種群來降解河豚毒素。
1.1 儀器,試劑及材料
純度大于99%的TTX標準品,購自北京盈澤納新化工技術研究院;超濾離心管購自上海蒙昌儀器有限公司;酒醅為山西杏花春汾酒集團有限責任公司提供;實驗動物為SPF級別昆明鼠,雄性,19~21 g,購自上海斯萊克實驗動物有限責任公司。
恒溫培養箱購自上海一恒科學儀器有限公司;ZWY-2102C Incubator Shaker購自上海智誠分析儀器制造有限公司;Eppendorf離心機5810B型購自德國Eppendorf公司;MAR磁信號分析系統購自美國Magna Bio Sciences公司。
1.2 樣品前處理
TTX經酒醅發酵降解后,在5000 r/min的條件下離心15 min,取上清液;上清液在10000 r/min的條件下離心15 min,取上清;上清液調節pH至中性(試紙條在中性環境下檢測才準確,所以檢測之前要對樣品進行調節pH至中性的操作),取4 mL配平pH的上清液加入到超濾離心管中,在4000 r/min條件下離心20 min。取經超濾的樣品液按比例加入層析液和磁珠,滴加到試紙條上,30 min之后用磁信號儀進行磁信號值的測定。
1.3 實驗方法
免疫層析檢測采用的是間接競爭模式,對于陽性樣本,C線區域有明顯的顏色反應;陰性則T線顯色,本實驗所使用試紙條是基于相同原理制成的。即是說河豚毒素的毒性越大,則試紙條C線顯色越深,所測C線的磁信號值越大;反之,隨著河豚毒素被降解,試紙條T線顯色越深,所測到的T線的磁信號值就會越大。另外,試紙條測河豚毒素時最大檢測上限為5μg/mL,所以本實驗中TTX的初始濃度都定為5μg/mL。以TTX標準溶液的濃度為橫坐標,對應的試紙條T線的磁信號值為縱坐標建立對數標準曲線,以此判斷磁性免疫層析法是否適用于TTX的定量分析和檢測。結果處,以各影響因素為橫坐標,樣品檢測試紙條上T線信號值為縱坐標來做圖。TTX的降解率={(樣品試紙條T線磁信號值-5μg/mL TTX標準品試紙條T線磁信號值)/(陰性對照磷酸緩沖液(PBS)試紙條T線磁信號值-5μg/mL TTX標準品試紙條T線磁信號值)}×100%。
1.4 降解條件優化
1.4.1 酒醅添加量對降解效果的影響 秤取4、8、12、16、20 g酒醅,分別對應加入3、7、11、15、19 mL滅過菌的去離子水,然后再對應加入1 mL的20μg/mL、40μg/mL、60μg/mL、80μg/mL、100μg/mL的TTX標準品溶液。充分攪拌均勻后,放置到恒溫培養箱中靜置培養,溫度設為30℃。72 h后,經前處理后測磁信號值。
1.4.2 溫度對降解效果的影響 酒醅中加入TTX標準溶液,攪拌均勻后,分別放置在條件為20℃、25℃、30℃、35℃、40℃的無水恒溫培養箱中。反應72 h后,取出,經前處理后測磁信號值。
1.4.3 搖床轉速對降解效果的影響 參照賈晉斌等[11]研究酒曲發酵液降解河豚毒素時搖床轉速的設定,本實驗在酒醅中加入河豚毒素之后,攪拌均勻,分別放置在條件為20 r/min、50 r/min、80 r/min、100 r/min、150 r/min的搖床中30℃反應,72 h后,取出,經前處理后測磁信號值。
1.4.4 時間對降解效果的影響 TTX標準溶液加入到酒醅中后,用上面確定的最佳降解條件進行培養。每隔一天取出一個樣品,放入-20℃冰箱中保存備測。7 d后對7個樣品經前處理后,測磁信號值。主要為了計算最佳條件下酒醅對TTX的降解率會達到多少。
1.4.5 小鼠生物法檢測降解效果 將上述降解1~7 d的TTX樣品,用小鼠法[12-14]來檢測酒醅對TTX的降解效果。每只小鼠的注射劑量為1 mL,每個樣品注射3只體重相差不大的小鼠,取3只小鼠的死亡時間的平均數作為該樣品的致死時間。當注射器把樣品全部注入小鼠腹腔內時開始計時,以出現了河豚毒素中毒的典型癥狀為標準判斷小鼠是否中毒,當小鼠停止呼吸時便停止計時。小鼠中毒的癥狀是開始先安靜,之后躁動轉圈、動作不靈活、呼吸困難、身體抽搐,最終死亡。
1.5 統計分析
文中的試紙條結果都是5次平行試驗的平均值,小鼠則是3次平行試驗的平均值。用SPSS軟件對數據進行統計分析。其中同列肩標不同字母表示差異顯著(P≤0.05),肩標相同字母則表示無顯著差異(P>0.05)。
2 結果
2.1 免疫層析定量檢測
對不同濃度TTX標準品試紙條的T線部分的磁信號進行檢測,建立標準曲線如圖1所示。TTX的含量在100~5000 ng/mL的范圍內,與磁信號的值具有良好的線性關系,關系式y=-0.1303x+813.88,R2為0.9944。由此可見,磁性免疫層析方法可用于TTX的定量分析和檢測。
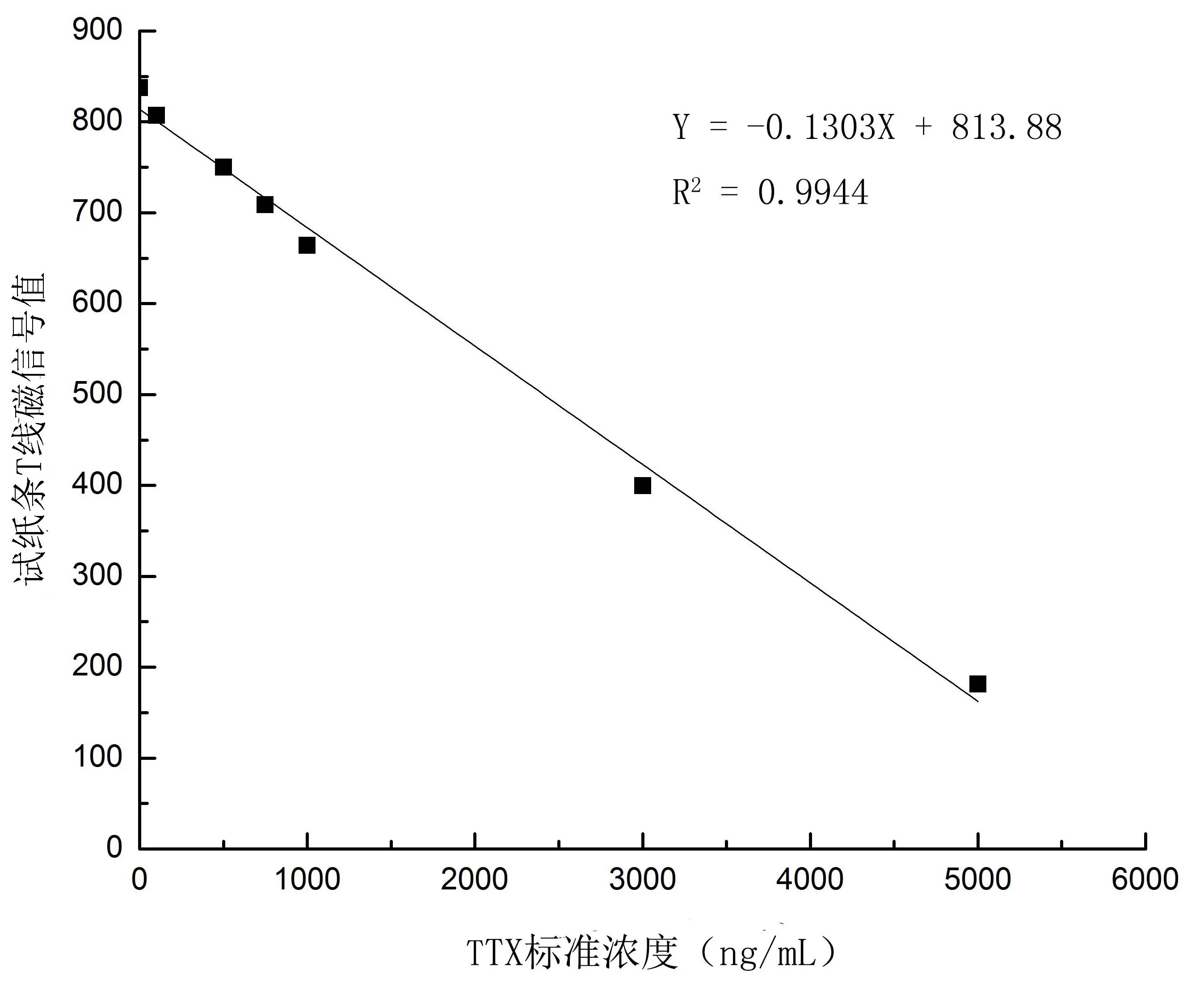
圖1 河豚毒素免疫層析法檢測定量標準曲線Fig.1 Standard curve of immunochromatography for TTX
2.2 降解條件的優化
2.2.1 酒醅添加量對降解效果的影響 SPSS軟件的統計分析結果(表1)顯示隨著酒醅添加量的增多,試紙條的T線磁信號值在不斷增大,說明河豚毒素在不斷被降解,毒性越來越低。酒醅添加量到達16 g之前,試紙條上T線磁信號值之間變化顯著(P≤0.05)。這可能是因為,隨著酒醅量的增加,微生物的數量也在增加,因而與河豚毒素的作用加強。而當酒醅添加量為16 g、20 g時,試紙條T線磁信號值之間沒明顯差異(P>0.05)。這可能是當微生物數量繼續增加時,由于受到包括溶氧量等其他條件的限制,化合物降解不再發生變化。所以最優酒醅添加量為16 g。

表1 不同酒醅添加量對TTX降解的影響結果的顯著性分析Table 1 Notability analysis on influence of different fermented grains dosage to TTX degradation
2.2.2 溫度對降解效果的影響 如圖2,當溫度達到30℃時,試紙條T線磁信號值最大,說明此時河豚毒素的毒性最低。根據方法中降解率的計算公式,得出此溫度下河豚毒素的降解率達到43.6%。30℃之前,T線磁信號值隨溫度增加而增加,30℃之后,TTX線磁信號值不斷下降。溫度對微生物的生長有很大的影響,在最適生長溫度范圍之內,隨著溫度的升高,反應作用會不斷加強,但超過限定范圍時,一些活性物質如酶會失活,從而影響反應的結果。所以30℃為最佳降解溫度。
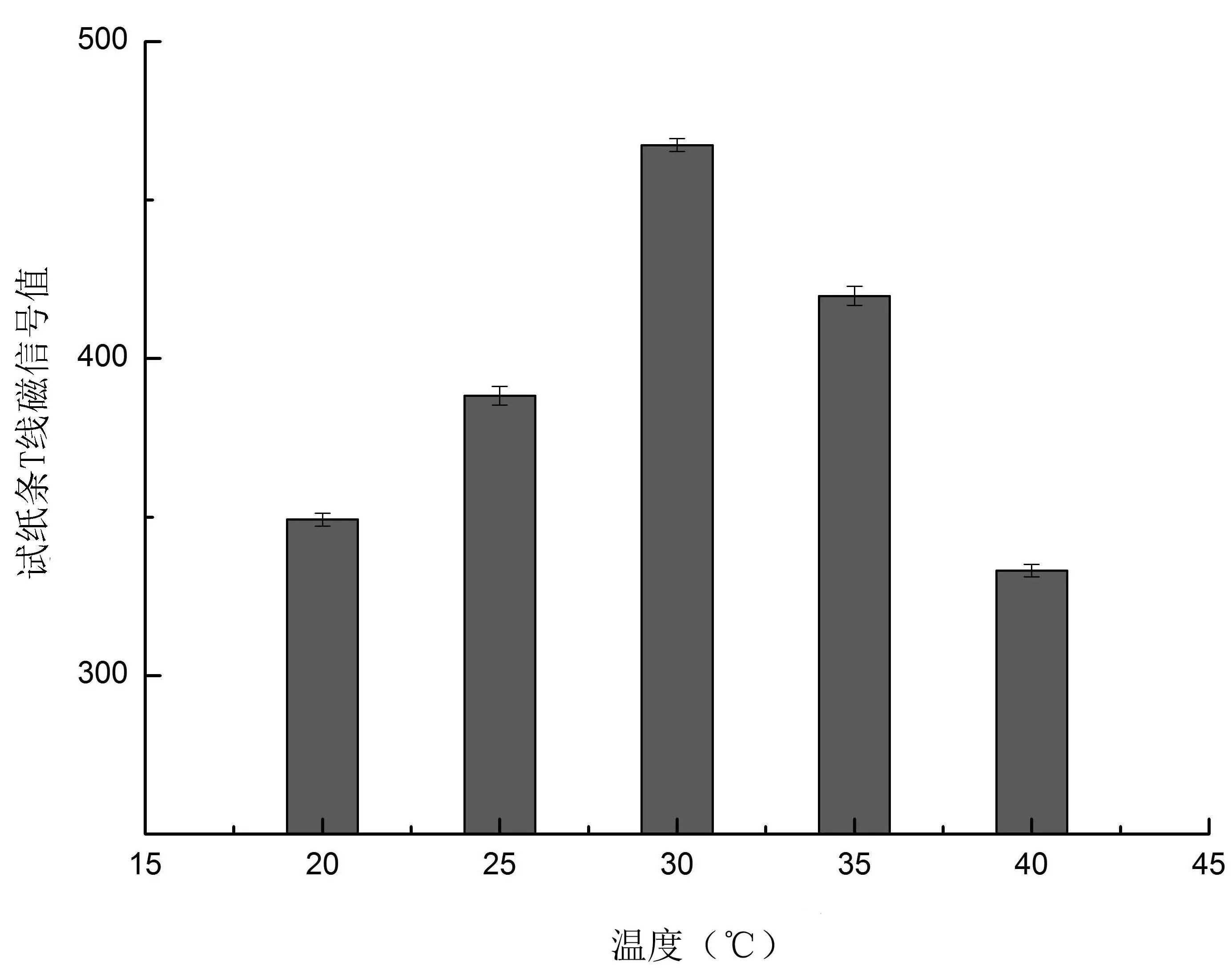
圖2 不同溫度對酒醅降解TTX的影響Fig.2 Influence of different temperatures on TTX degradation rate
2.2.3 搖床轉速對降解效果的影響 由圖3可知,當搖床轉速為50 r/min時,試紙條T線磁信號值最大,說明此時酒醅對TTX的降解能力最佳,根據降解公式算出降解率可達53.8%。酒醅是半固體,搖床振蕩影響通氣量,通氣量不同則發酵結果不同。不同搖床轉速對TTX降解結果顯示通氣量確實對TTX的降解起到促進作用。
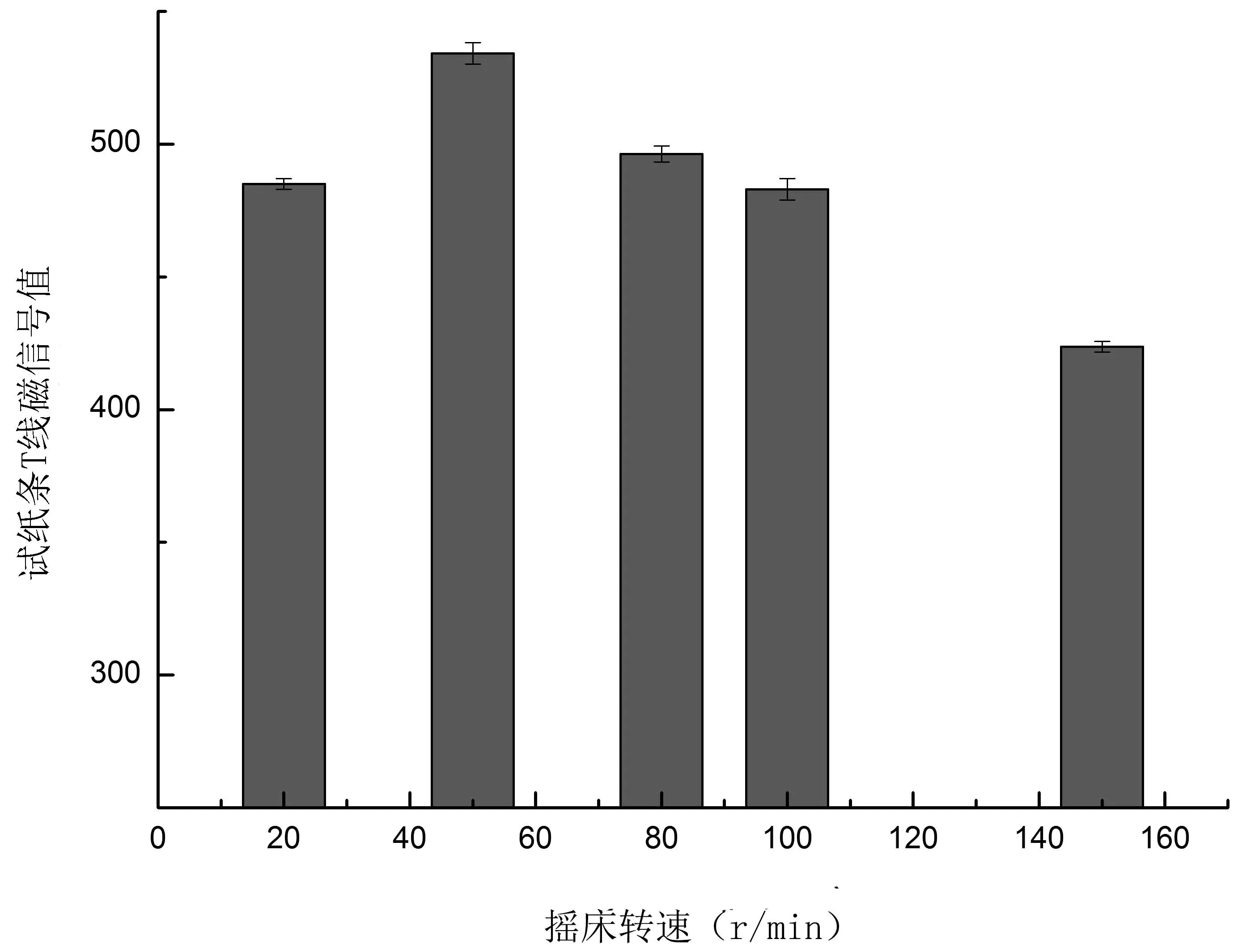
圖3 搖床轉速對酒醅降解TTX的影響Fig.3 Influence of different shaker rotate speeds on TTX degradation rate
2.2.4 時間對降解效率的影響 觀察表2統計分析結果,5 d以前,試紙條T線磁信號值之間變化顯著(P≤0.05),但當降解達到第5、6、7 d時,試紙條T線磁信號值之間無顯著差異(P>0.05)。根據降解率計算公式算出第5 d時的降解率達68.3%。可能是在適宜的條件下培養時,隨著時間的延長,酒醅中微生物的數量在不斷增加,對河豚毒素的降解作用也在增強。而當降解達到第5、6、7 d時,酒醅中降解河豚毒素的活性物質不再發生變化,導致降解率不變。因此實驗時,5 d就可以進行1次數據測定。

表2 時間酒醅降解TTX的影響結果的顯著性分析Table 2 Notability analysis on influence of time to TTX degradation
2.2.5 小鼠生物法檢測結果 觀察表3的顯著性分析表格,在降解5 d之前,小鼠的死亡時間之間變化顯著(P≤0.05),5 d之后小鼠的死亡時間變化不顯著(P>0.05)。這準確驗證了酒醅降解TTX的時間規律。雖然不能達到完全解毒的效果,但證明了酒醅確實有降解TTX的能力。酒醅降解7 d后,腹腔注射TTX的小鼠的死亡時間為17′29″,依據國標法[13]附錄A中表A,查出此時的TTX的毒力為1.26 MU。5μg/mL的TTX腹腔注射小鼠時,小鼠的死亡時間為1′23″,小于4 min,查出毒力遠遠大于6.13 MU。毒力降低值大于4.87 MU。

表3 小鼠生物法檢測酒醅對TTX的降解效果的顯著性分析Table 3 Significant analysis on the degradation effect of fermented grains on TTX by mouse bioassay
3 討論
本實驗研究了酒醅降解河豚毒素的最優條件,結果表明在酒醅添加量為16 g,溫度為30℃,搖床轉速為50 r/min的條件下,酒醅對河豚毒素的降解能力最強,用小鼠生物法來驗證時間對降解效果的影響時,發現隨著反應的進行,小鼠的死亡時間在延長,第五天之后趨于不變,驗證了酒醅降解河豚毒素的時間規律,同時也證明了酒醅對河豚毒素確實有降解作用,其中有可能是酒醅中的微生物在起降解作用。賈晉斌,舒靜[11]等研究酒曲對河豚毒素的轉化實驗中發現酒曲發酵液對河豚毒素的降解具有較為顯著的效果,結果表明在溫度為30~35℃,搖床轉速為50 r/min的條件下,酒曲對河豚毒素的降解能力最佳。TTX含有苯吡啶結構,而微生物在好氧和厭氧環境下都可以利用吡啶及其衍生物[15]。TTX也是一種氨基全氫化喹唑啉化合物,能夠降解喹啉及其衍生物的菌株也被大量分離鑒定出來,如假單胞菌屬(Pseudomonassp.)[16]可降解喹啉,黃單孢菌屬(Xanthomonas)[17]可降解4-甲基喹啉。
關于TTX的降解機理以及TTX被轉化為何種物質,這需要進一步的研究,現在還沒有確定的研究結果。汾酒屬于清香型白酒,李增勝、任潤斌[18]研究了清香型白酒在發酵過程中的主要微生物,認為酵母菌類中主要有擬內孢霉、酵母菌屬、假絲酵母和異常漢遜酵母;霉菌類中主有根霉、紅曲霉、梨頭霉、毛霉和黃米曲霉;細菌類中主要有革蘭氏陰性芽孢細菌、乳酸菌和醋酸菌。介于微生物在毒素降解中的作用,所以酒醅能夠降解TTX可能是是酒醅中的微生物對河豚毒素起了生物轉化的作用。微生物轉化的本質是某種微生物將一種物質(底物)轉化成為另一種物質(產物)的過程,是通過微生物細胞將復雜的底物進行結構修飾,也就是利用微生物代謝過程產生的某個或某一系列的酶之間的相互作用對底物特定基團進行的催化反應[19]。也許可以根據酒醅中的菌相來建立一個微生物體系,通過不斷調試加入微生物的比例,不斷優化,可以達到降解河豚毒素的作用。這對找出TTX的降解機理是個機會,可以作為一個研究的方向。
[1]Do HK,Kogure K,Imada C,etal.Tetrodotoxin production of actinomycetes isolated from marine sediment[J].Journal of Applied Microbiology,1991,70(6):464-468
[2]岳田芳.海藻希瓦氏菌發酵產生河豚毒素的提取與檢測[D].青島:中國海洋大學,2008
[3]洪 專,易瑞灶,許 晨,等.河豚毒素中毒機理與臨床救治探討[J].中國海洋藥物,2004,23(3):49-53,14
[4]劉燕婷,雷紅濤,鐘青萍.河豚毒素的研究進展[J].食品研究與開發,2008,29(2):156-160
[5]Miyazawa K,Noguchi T.Distribution and origin of tetrodotoxin[J].J Toxicol--Toxicon Review,2001(20):11-33
[6]Charles TH.The Chemical and Evolutionary Ecology of Tetrodotoxin(TTX)Toxicity in Terrestrial Vertebrates[J]. Marine Drugs,2010,8(3):577-593
[7]劉燕婷.河豚毒素的研究進展[J].時珍國醫國藥,2002,13(11):691-692
[8]Fujii T,Mayumi M.Fugu meat,pickles ovary.National processed marine products overview[C/OL].[2013-04-16]. http://nrifs.fra.affrc.go.jp/kakou/souran/ransounukaduke/.
[9]叢 蕾.河豚毒素特異性單克隆抗體的制備[D].上海:上海海洋大學,2011
[10]徐曉巍,崔正權,盧瑛,等.基于磁性納米探針的乙肝前S1抗原的快速磁性免疫層析方法的建立[J].生物學雜志,2016,33(1):98-103
[11]賈晉斌,舒 靜,彭 銳,等.酒曲生物轉化降解河豚毒素的初步研究[J].中國醫藥生物技術,2013,8(4):269-273
[12]王 靜,楊麗君,李兆杰,等.昆明系小鼠生物法定量測定水產品中河豚毒素[J].食品科學,2011,32(4):181-184
[13]段發淼,謝心磊,朱寶平.用小鼠單位法檢測河豚毒素[J].中國衛生檢驗雜志,2000,10(4):463-464
[14]中華人民共和國國家質量監督檢驗檢疫總局.SN/T 1569.2-2013出口河豚魚中河豚毒素檢測方法 第2部分:小鼠生物法[S].北京:中國標準出版社,2013
[15]Li YM,Gu G,Zhao J,etal.Anoxic degradation of nitrogenous heterocyclic compounds by acclimated activated sludge[J].Process Biochemistry,2001,37(1):81-86
[16]Kilbane JJ,Ranganathan R,Cleveland L,et a1.Selective removal of Nitrogen from Quinoline and Petroleum byPseudomona ayucidaIGNT9m[J].Appl.Environ.Microbiol,2000,66(2):688-693
[17]Sutton SD,Pfaller SL,Shann JR,et a1.Aerobic biodegradation of 4-methylquinoline by a soil bacterium[J].Applied and Environmental Microbiology,1996,62(8):2910-29l4
[18]李增勝,任潤斌.對清香型白酒發酵過程中酒醅中的主要微生物[J].釀酒,2005,32(5):33-34
[19]Chen DJ,Zhu BQ.Application of microbial transformation in modern pharmaceutical industry[J].Chin J Antibiotics, 2006,31(2):112-118

