非原位拉曼光譜區分富鋰層狀氧化物的集成結構:一種預測Li2MnO3活化程度的有效方法
陳丹丹 李廣社 范建明 李保云 張 丹 馮 濤 李國華 李莉萍*,
0 引 言
鋰離子電池因具有高的能量密度、良好的循環性能、環境友好等優點而被廣泛應用于便攜電子設備和電動汽車領域[1-4]。而正極材料是限制鋰離子電池容量和能量密度的瓶頸所在[5]。眾多研究者致力于尋找高容量、高安全性和低成本的正極材料來替代目前主要的商業化LiCoO2材料[6-11]。富鋰層狀氧化物在首次充電過程中電壓達到4.5 V以上時,Li2MnO3組分發生電化學活化貢獻容量,從而使富鋰材料顯示出很高的容量(>250 mAh·g-1)[12-14]。同時,富鋰材料因富含低成本的錳元素、安全性高等特點,被認為是最有前景的下一代鋰離子電池正極材料[15-16]。然而,一些內在因素制約著富鋰材料的容量和循環性能,進而制約著其商業化的發展。
一方面,由于Li+的半徑與Ni2+的半徑相近,材料中普遍存在Li/Ni混占現象[17]。Zhang等[18]發現采用不同原料合成的同組分富鋰材料中Li/Ni混占程度存在差異。Zheng等[19]深入探究了Li/Ni混占對不同組分的層狀材料熱穩定性的影響。另一方面,在首次充放電過程中,Li2MnO3組分在4.5 V以上的活化充分與否直接影響富鋰材料平臺區容量的貢獻,Li2MnO3的活化情況與富鋰材料的兩相集成方式有關。上述2方面的問題通常來源于合成條件的影響,不同的合成條件影響富鋰材料的晶型、晶粒尺寸、相純度、形貌、比表面積等方面,使得富鋰材料的電化學性能與其對應的合成方法密切相關[20-21]。
富鋰材料的兩相集成方式目前公認的結論有2個,即分別用 Li1+(x/(2+x))M1-(x/(2+x))O2(M=Mn、Co、Ni、Cr等)表示的固溶體結構和x Li2MnO3·(1-x)LiMO2(M=Mn、Co、Ni、Cr等)表示的復合物結構,從結構角度分析,固溶體結構的富鋰材料源于Li+在晶格中有序排列,不同種類的過渡金屬離子隨機地出現在晶格中的過渡金屬位上[22]。復合物結構的富鋰材料首先由Thackeray等[23-25]提出,并指出富鋰材料由空間上有序分布的Li2MnO3域和無序分布的LiMO2域組成。根據兩組分域的大小我們將復合物分為納米復合物和非納米復合物。在富鋰材料兩相集成方式與性能的關系的探究中,Gu等[26]發現復合結構的Li1.2Mn0.6Ni0.2O2晶粒表面和晶界處富鎳而內部富錳的現象,即存在元素偏析現象。相比于在原子水平上均勻分布的固溶體結構的富鋰材料,復合物結構的富鋰材料多了晶粒、晶界和元素偏析這些因素的限制,這對于材料的電化學性能來說是不利的。此外,McCalla和Li等[27-28]通過結合電化學性能數據和XRD數據分析發現單相的固溶體結構的材料不具備納米復合物材料對電化學性能帶來的不利影響。Tang等[29]通過結合掃描透射電子顯微鏡和電化學性能分析發現在復合物結構的富鋰材料內存在Li2MnO3域富集現象,使得材料在電化學循環過程中更不容易被活化而表現出差的電化學性能,即當富鋰材料以固溶體結構存在或Li2MO3分離域的尺寸越小,在有限的充電過程中,材料活化的越充分,在4.5 V左右的電壓平臺越長,貢獻的容量越多。目前探究富鋰材料兩相集成方式所采用的方法通常是高端的電鏡技術,理論計算等難實現、難分析的技術表征手段 (如高角度環形暗場掃描透射電子顯微鏡(HAADF/STEM&D-STEM)、魔角旋轉核磁共振(MASNMR)、X射線吸收光譜(XAS)等)和工藝復雜的電化學性能測試,而采用簡單易行的方法探究富鋰材料的兩相集成方式,并將之與電化學性能相聯系的研究十分缺乏。
基于此,我們采用5種方法,即溶膠-凝膠法、高溫固相法、共沉淀法、水熱法和溶劑熱法合成了富鋰錳基正極材料Li1.2Mn0.6Ni0.2O2。使用掃描電子顯微鏡(SEM)和X射線粉末衍射(XRD)對5個樣品的形貌和體相結構進行了表征。更重要的是,我們采用非原位拉曼光譜對5個樣品進行測試,并與文獻中的Li2MnO3和LiMn0.5Ni0.5O2的拉曼光譜對比來分析樣品的局部結構,通過著重分析5個樣品在488 cm-1左右(ν1)和 600 cm-1左右(ν2)的拉曼峰確定兩相集成方式。結合電化學性能測試結果,尤其是首次充電過程中由Li2MnO3活化貢獻容量的多少來進一步探究材料的集成結構與電化學性能之間的聯系。
1 實驗部分
1.1 試劑與樣品制備
本工作使用的試劑包括LiOH·H2O(純度95%)、LiAc·4H2O(純度 99%)、Ni(Ac)2·4H2O(純度 98%)、Mn(Ac)2·4H2O(純度 99%)、一水合檸檬酸(純度 99.5%)、NaOH(片狀,純度 96%)、尿素(純度 99%)。
采用5種合成方法,即溶膠-凝膠法、高溫固相法、共沉淀法、水熱法和溶劑熱法合成Li1.2Mn0.6Ni0.2O2正極材料。
(1) 溶膠-凝膠法
所采取的溶膠-凝膠法屬溶膠-凝膠機制中的配合物型。 LiAc·2H2O、Mn(Ac)2·4H2O 和 Ni(Ac)2·4H2O 按 照 nLi∶nMn∶nNi=6∶3∶1 溶于 200 mL 去離 子 水中,檸檬酸作為配位劑,濃氨水調節溶液pH值在7~8之間得到金屬離子配合物溶膠,置于80℃的水浴中蒸干形成金屬離子配合物凝膠。得到的凝膠于180℃的烘箱中發泡一夜并充分研磨后置于馬弗爐中500℃保溫5 h,再于900℃下反應12 h。得到的樣品記為SG。
(2) 高溫固相法
以金屬乙酸鹽為原料,按照化學計量比投料并充分研磨混合均勻后置于馬弗爐內500℃熱處理6 h后取出進行二次研磨,二次研磨后的粉體置于馬弗爐內900℃煅燒12 h,得到的樣品記為HS。
(3) 共沉淀法
以過渡金屬硫酸鹽為原料,先按化學計量比將過渡金屬硫酸鹽溶于去離子水中,配成體積為100 mL的溶液A。再配制20 mL 2 mol·L-1的NaOH溶液與10 mL濃氨水溶于70 mL去離子水中配成等體積的溶液B。溶液A與溶液B在Ar氣氛下,同時滴加進反應容器進行共沉淀反應,滴加速率為1 drop·s-1。滴加完畢后攪拌一夜令其沉淀完全,抽濾,用去離子水洗滌除去殘留的Na+等雜質元素后于80℃烘箱中烘干得到前驅體,將其與鋰源混合,研磨均勻于900℃馬弗爐中煅燒反應12 h,得到的樣品記為CP。
(4) 水熱法
以過渡金屬乙酸鹽和尿素為原料,按照過渡金屬與尿素的物質的量比為1∶2投料于100 mL反應釜內,加入60 mL去離子水配成均一澄清的溶液,置于180℃烘箱中反應15 h后,對產物抽濾,洗滌,烘干,得到前驅體。將前驅體與鋰源混合,充分研磨后于馬弗爐內900℃煅燒12 h,得到的樣品記為HT。
(5) 溶劑熱法
以過渡金屬乙酸鹽和尿素為原料,按照過渡金屬與尿素的物質的量比為1∶1.2投料于100 mL反應釜中,以20 mL無水乙醇與40 mL去離子水的混合溶液作為反應介質配成澄清均一的溶液,于200℃烘箱中反應36 h,對反應產物抽濾,洗滌,烘干,得到前驅體。將前驅體與鋰源充分研磨混合均勻于900℃馬弗爐內反應12 h,得到的樣品記為ST。
1.2 樣品表征
X射線衍射(XRD)測試采用日本Rigaku公司MiniFlex600型 X射線衍射儀,Cu Kα 射線(λ=0.154 18 nm),管電流 15 mA,管電壓 40 kV,掃描范圍 10°~80°,掃描速度 2°·min-1,步長 0.02 °,光譜純KCl作為內標進行衍射峰位的校正;樣品形貌觀察采用日本JEOL公司的JSM-6700型場發射掃描電子顯微鏡(SEM),加速電壓為 10 kV,分辨率為 1 μm;采用法國Jobin Yvon公司的JY-HR800型激光拉曼光譜儀對樣品進行拉曼光譜測試,激發波長為532 nm,測試的波數范圍為200~800 cm-1;采用法國Jobin Yvon公司的Ultima 2型電感耦合等離子體原子發射光譜(ICP-AES)對樣品中的元素組成進行分析。
1.3 電池組裝與性能測試
將合成的電極材料、導電碳黑和PVDF以質量比8∶1∶1與一定量N-甲基吡咯烷酮溶劑混合制成漿料均勻地涂在鋁箔上,于100℃真空烘箱烘干12 h,活性物質質量為2~2.5 mg。以金屬鋰片為對電極,1 mol·L-1LiPF6/(碳酸乙烯酯+碳酸二甲酯+碳酸甲乙酯)(LiPF6/(EC+DMC+EMC))(VEC∶VDMC∶VEMC=1∶1∶1)為電解液,聚丙烯材料為隔膜,在充滿氬氣的手套箱內組裝成2025型扣式電池。在深圳新威爾電子有限公司Neware測試系統上進行電化學性能測試,充放電測試的電壓區間為2.0~4.8 V。
2 結果與討論
圖1為5個樣品的掃描電鏡(SEM)圖,可以看出5個樣品形貌類似,都是不規則的顆粒,存在部分團聚現象,樣品HT和ST較其他3個樣品團聚的更嚴重一些。樣品SG、HS和CP尺寸較小,約為100~400 nm,樣品HT和ST的顆粒粒徑分布散亂,在100 nm到1μm之間都有所分布。因5個樣品形貌相近,均為無規則顆粒,因此形貌不是影響電化學性能的主要因素。
圖2為5個富鋰材料的X射線衍射(XRD)圖,可以明顯地看出5種方法所合成的樣品均具有典型的六方晶系(空間群為R3m)層狀結構[30]。在38°和65°左右分別對應(006)和(012)、(018)和(110)兩對清晰可見的劈裂峰,是層狀材料的特征衍射峰[4]。在20°~25°之間存在一些微弱的衍射峰與單斜晶系C2/m空間群的超晶格結構密切相關,這是由過渡金屬層中獨特的LiMn6有序結構貢獻的[31]。從圖2中給出的20°~25°的XRD放大圖我們可以看出,歸屬于C2/m空間群的3個晶面(020)、(110)和(110)的衍射峰強度隨著合成方法的不同而不同。表1給出了XRD精修擬合的結構參數,c/a值可以代表三方畸變的程度,當c/a大于4.899時證明材料中的陽離子高度有序[20],5個樣品的c/a值相近,具有相近的陽離子有序結構。Li/Ni disordering代表Li/Ni混占程度,5個樣品的Li/Ni混占程度相近。同時,5個樣品的XRD擬合誤差Rwp、Rp和χ2相近,故5個富鋰樣品的體相結構基本相同,不存在明顯差別。

圖1 樣品的SEM圖Fig.1 SEM images of as-prepared samples
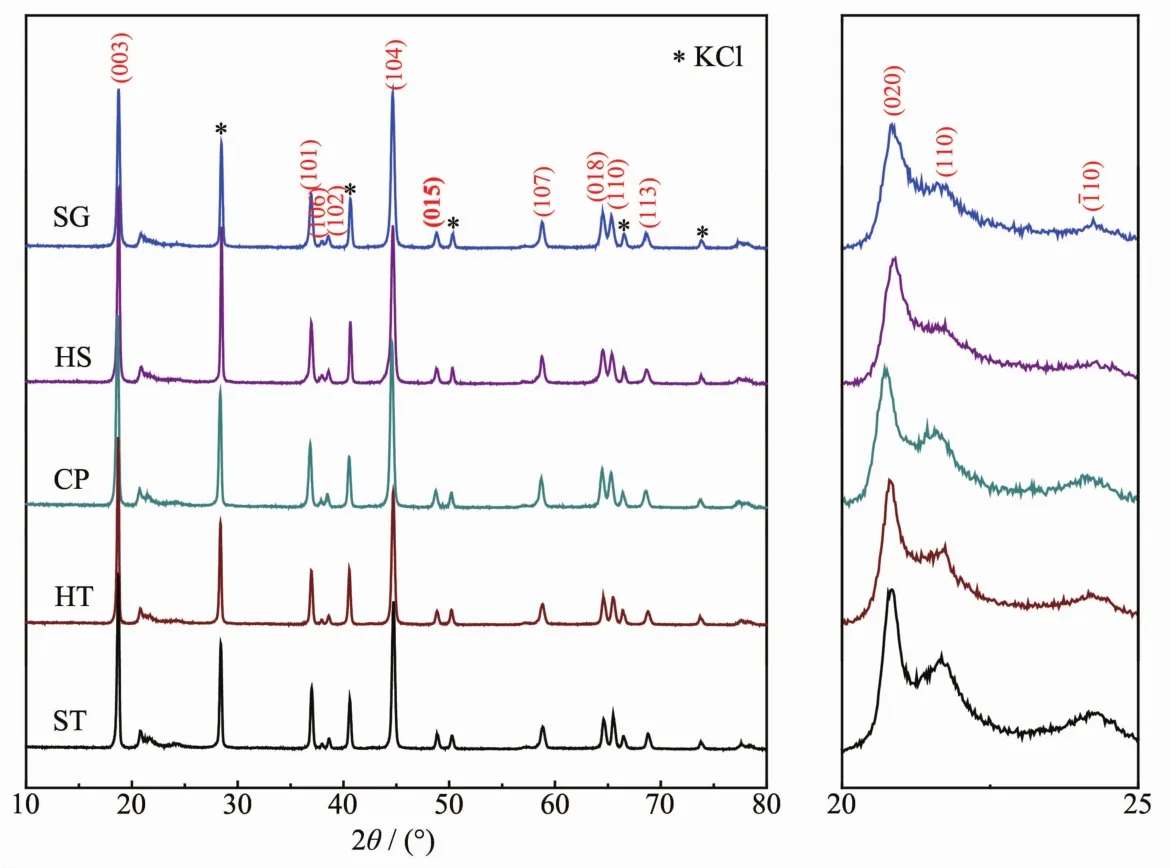
圖2 樣品的XRD圖Fig.2 XRD patterns of as-prepared samples
樣品整體的晶體結構信息可通過多種衍射方法來獲得,但是針對關系到富鋰材料電化學性能的過渡金屬離子周圍的局部結構采用拉曼光譜來分析更加地簡單高效[32-34]。圖3(a)是樣品的拉曼光譜圖,圖3(b)是從文獻中引用的Li2MnO3及LiNi0.5Mn0.5O2的拉曼光譜圖[35-36],對比二者旨在找到5個同組分的富鋰樣品在局部結構上的區別。Li2MnO3具有 Ag(621、574、442、252 cm-1)和 Bg(502、422、377、330 cm-1)8個拉曼振動模式[35]。LiNi0.5Mn0.5O2具有2個拉曼振動模式,分別為600 cm-1的A1g振動模和500 cm-1左右以寬峰形式存在的Eg振動模[36-38]。由于富鋰材料在結構上存在爭議,在分析5個樣品的拉曼光譜時做出如下假設,即富鋰材料的拉曼光譜是由各組分的局部組分相疊加的結果。Li2MnO3和LiNi0.5Mn0.5O2的拉曼光譜發生疊加作用的區域在450~700 cm-1之間。小于450 cm-1部分的拉曼振動全部來自Li2MnO3組分,這也是富鋰材料相比于LiMO2(M=Mn、Co、Ni)的特征峰。樣品 SG、HS、HT 和ST小于450 cm-1的幾個峰很明顯,由此說明材料中存在類似于Li2MnO3的局部對稱性。然而樣品CP除了425 cm-1存在一個比較弱的峰之外,其他的峰并不明顯,證明樣品CP中并不存在明顯的Li2MnO3域。根據峰位置分析5個樣品在488 cm-1左右(ν1)和 600 cm-1左右(ν2)的拉曼峰由 Li2MnO3和LiNi0.5Mn0.5O2共同貢獻。 ν1峰是由 Li2MnO3的 Bg(502 cm-1)和 LiNi0.5Mn0.5O2的 Eg(503 cm-1)共同貢獻。ν2峰是由 Li2MnO3的 Ag(621 cm-1)和 LiNi0.5Mn0.5O2的A1g(600 cm-1)共同貢獻。表2給出了5個樣品2個拉曼峰ν1和ν2的具體參數。
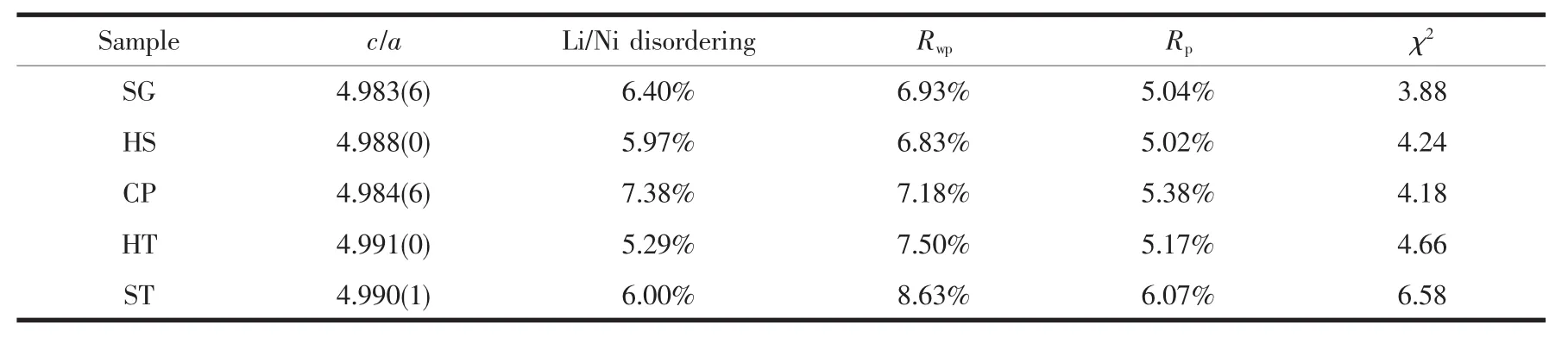
表1 樣品精修后的結構參數Table 1 Structural parameters for all samples refined by GSASsoftware
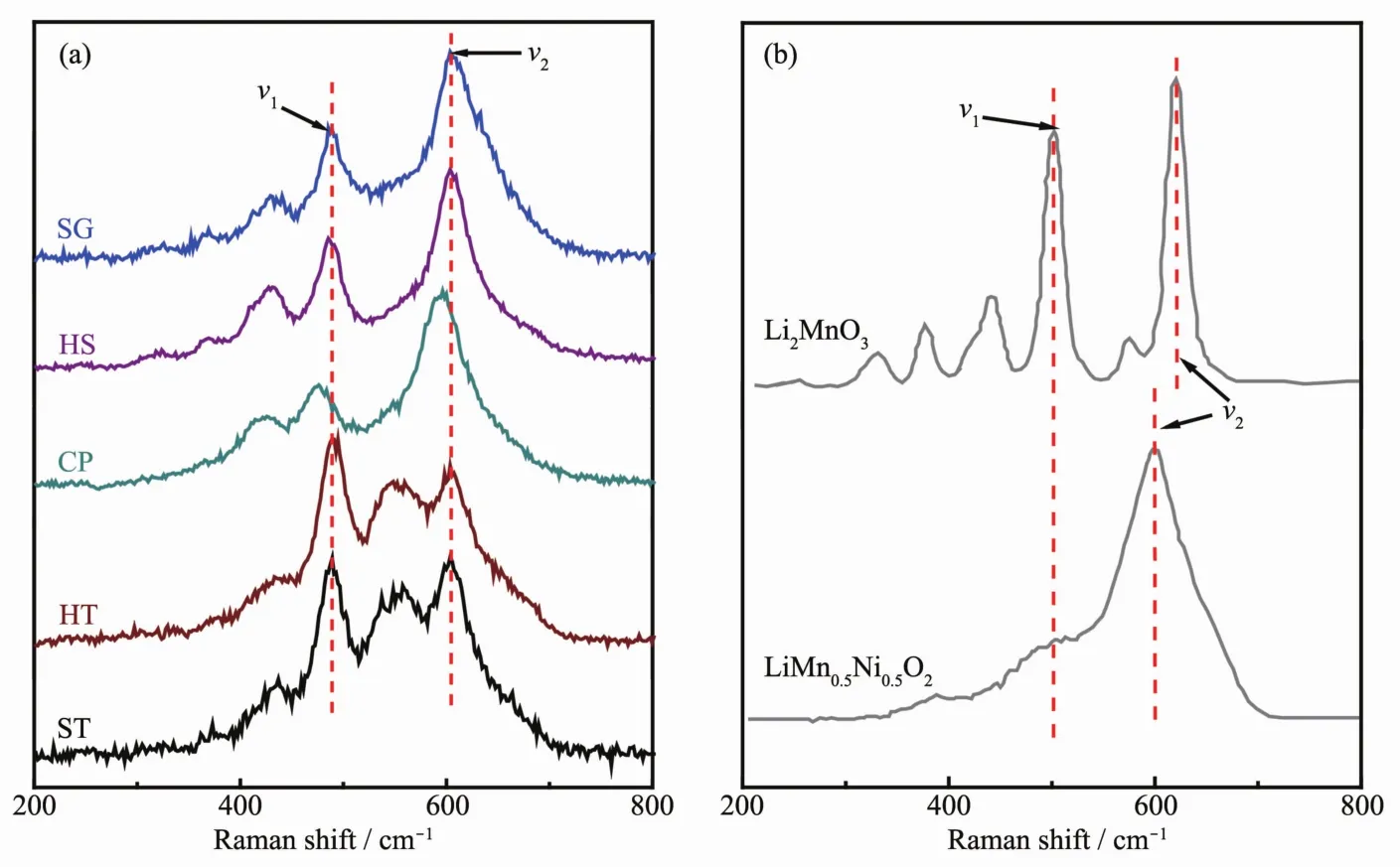
圖3 (a)5個樣品的拉曼光譜圖;(b)Li2MnO3和LiNi0.5Mn0.5O2的拉曼光譜[35-36]Fig.3 Raman spectra of as-prepared samples(a),Li2MnO3 and LiNi0.5Mn0.5O2(b)
五個樣品的 ν1峰相較于 Li2MnO3的 Bg(502 cm-1)和LiNi0.5Mn0.5O2的Eg(503 cm-1)均向低波數方向移動,這是因為Li2MnO3的Bg(502 cm-1)和LiNi0.5Mn0.5O2的Eg(503 cm-1)相重合,由于二者峰形差別較大使得ν1峰位發生明顯的移動,但我們發現樣品CP移動的幅度要比其他4個樣品大一些。樣品SG、HS、HT和 ST的 ν2峰相較于 LiNi0.5Mn0.5O2的 A1g振動模式輕微地向高波數方向移動,即向著Li2MnO3的Ag振動模方向移動,這是材料中存在的Li2MnO3域造成的,是兩者相互疊加的結果,而兩組分疊加并不能解釋樣品CP的ν1峰向低波數方向移動這種情況。最值得注意的是在550~575 cm-1處的拉曼振動,此處的振動峰來源于Li2MnO3的Ag(574 cm-1)。可以明顯地看到在樣品SG、HS、CP中此處的拉曼峰強度較弱,峰形不明顯,與ν2峰以類似于肩峰的形式存在。而樣品HT和ST在此處的拉曼振動峰比較尖銳,具有明顯的峰形,與ν2峰以類似于劈裂峰的形式存在。我們可以看到Li2MnO3的Ag(574 cm-1)就很明顯和尖銳,由此可以說明,樣品HT和ST中存在較大的Li2MnO3域。比較5個樣品ν2和ν1的峰強度 Iν2/Iν1, 樣品 SG 和 HS 的 Iν2/Iν1相近, 且均與LiNi0.5Mn0.5O2接近, 樣品 HT 和 ST 的 Iν2/Iν1相近,并靠近 Li2MnO3的 Iν2/Iν1。 而樣品 CP 與其他樣品顯著不同, 其 Iν2/Iν1要比Li2MnO3和LiNi0.5Mn0.5O2的都要大很多。綜上所述,采用由Li2MnO3和LiNi0.5Mn0.5O2共同貢獻的假設并不能得到很好的解釋樣品CP的拉曼譜圖,所以樣品CP很有可能是以固溶體結構存在的;樣品HT和ST的拉曼振動峰高度表現出了Li2MnO3的振動特征,二者可能是以復合物結構存在;樣品SG和HS的拉曼光譜介于上述2種類型之間,即以Li2MnO3和LiNi0.5Mn0.5O2共生的納米復合結構存在。
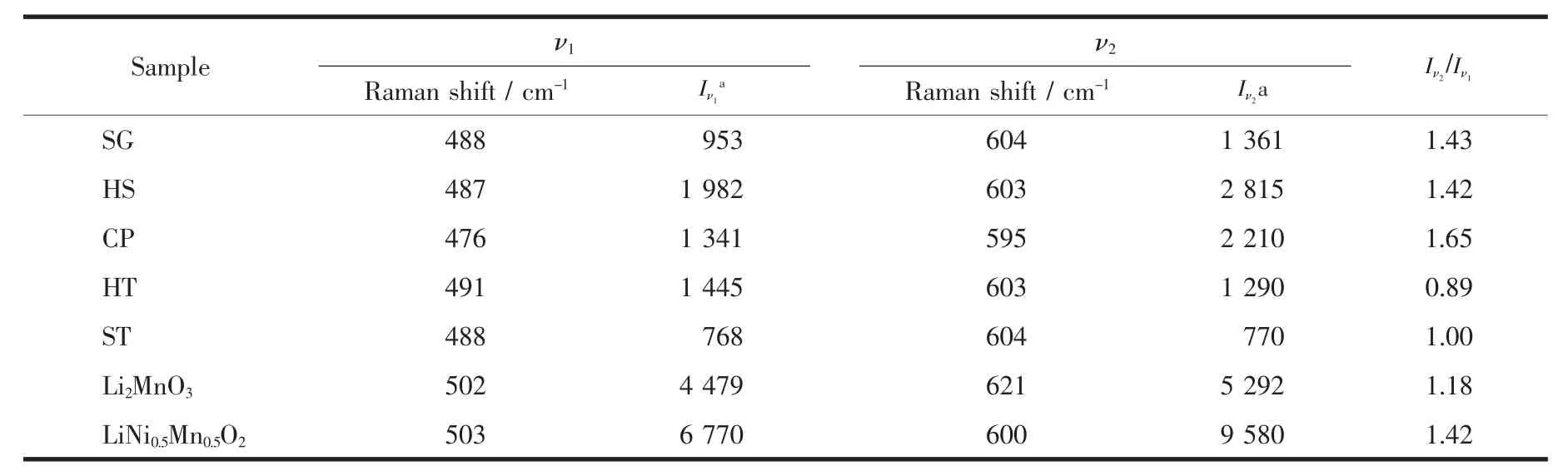
表2 樣品的特征拉曼振動峰相關數據Table 2 Raman band data for all samples
通過結合前人的工作探究和本文中我們通過拉曼光譜分析得到的5個富鋰樣品的兩相集成方式信息,我們預測具有固溶體結構的樣品CP電化學性能可能最優,其次是具有納米復合物結構的樣品SG和HS,而具有非納米復合物結構的樣品HT和ST的電化學性能有可能最差。
采用ICP-AES對樣品的Li、Mn、Ni元素組成進行分析,在相同金屬投料比的條件下,采用不同方法合成的樣品中,金屬元素組成相近。5個樣品均于室溫條件下2.0~4.8 V(vs Li+/Li)的電壓范圍內進行恒電流充放電的電化學性能測試。圖4(a)為5個樣品在20 mA·g-1下的首次充放電曲線。樣品SG、HS和CP具有相似的首次充放電曲線,即在首次充電過程中存在明顯的2個階段,第一個階段是位于3.8~4.5 V的斜坡區域,這是由LiNi0.5Mn0.5O2中Li+脫出伴隨著Ni2+被氧化成Ni4+所貢獻的。第2個階段為位于4.5 V左右的電壓平臺,這部分容量來源于Li2MnO3活化,脫出Li2O而形成類MnO2相[18]。樣品HT和ST的首次充放電曲線明顯不同于樣品SG、HS和CP,其由Li2MnO3活化貢獻的容量平臺很短,幾乎看不到。表3給出了5個樣品各個階段理論充電比容量和在20 mA·g-1下實際充電比容量及二者之間的差值。對比5個樣品的斜坡區域,發現樣品HT和ST的ΔCLiNi0.5Mn0.5O2最大,其后依次是樣品CP、HS和SG。而樣品SG和HS的在這一階段的實際充電比容量要高于理論充電比容量,這種情況的出現源于多種因素的疊加,如組分的細微差異、測試系統誤差,活性物質測量帶來的誤差都會造成實際值高于理論值,因此這一部分容量的損失我們不能夠用準確的某一個因素去判斷,需要綜合多種因素進行考量。我們認為理論比容量與實際比容量的差值在±10 mA·g-1左右都是正常。本文中我們主要探究兩相集成方式對Li2MnO3活化情況的影響,關于第一階段的影響因素不再進行深入探討。根據表3,在首次充電過程中, 樣品 CP、SG、HS、ST和 HT的分別為 47.88、61.84、73.14、167.93 和 169.28 mAh·g-1。樣品CP由Li2MnO3活化貢獻的實際充電比容量最接近理論充電比容量,Li2MnO3更容易被活化。相應地,樣品ST和HT中的Li2MnO3很難被活化,表現出很低的實際充電比容量。樣品SG和HS的容量介于上述三者之間。圖4(b)給出了5個樣品于100 mA·g-1下的循環性能圖。經歷100次循環后,樣品SG、HS、CP、HT和ST的放電比容量由首次的 放 電 比 容 量 203.8、163.4、199.2、50.6 和 65.3 mAh·g-1變為 173.7、151.8、185.3、55.3 和 101.8 mAh·g-1,容量保持率分別為 85.3%、93.3%、93.0%、107.8%和156.9%。由此可見,樣品HT和ST中的Li2MnO3在首次循環過程中沒有得到充分活化,在后續循環過程中緩慢活化,使得放電比容量在后續的循環中逐步上升,再次證明了在樣品HT和ST中的Li2MnO3組分在首次充電過程中難以活化這個事實。
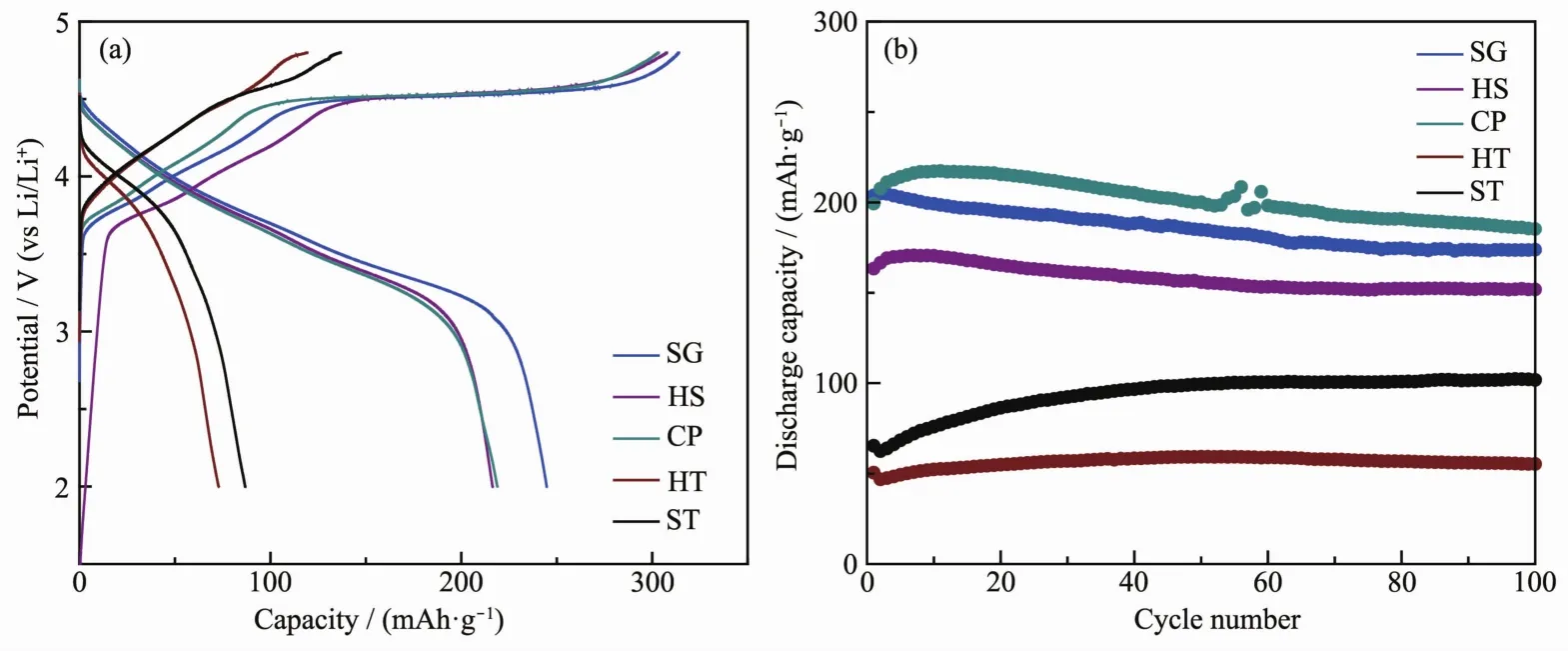
圖4 樣品(a)在20 mA·g-1下的首次充放電曲線和(b)在100 mA·g-1下的循環性能曲線Fig.4 (a)First charge-discharge curves at a current density of 20 mA·g-1 and(b)cycling performances at a current density of 100 mA·g-1 of as-prepared samples
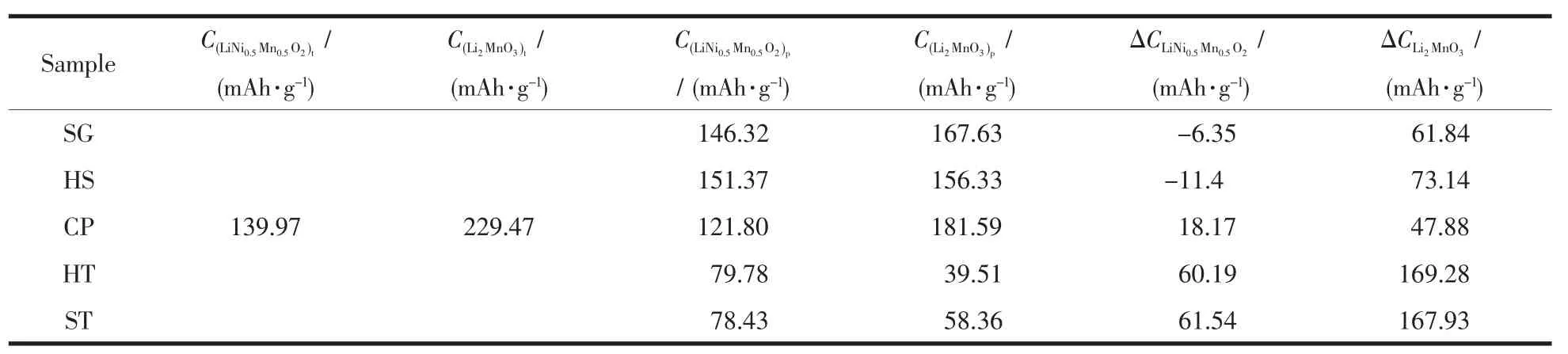
表3 樣品中2個組分通過計算得到的理論放電比容量C t和電化學性能測試得到的實際放電比容量C p及其二者的差值ΔCTable 3 A comparison of theoretical first charge capacities(C t)by each component,practical charge capacities(C p)obtained by electrochemical tests and deviation of theoretical capacities and pratical capacities(ΔC)
圖5為不同電流密度下5個樣品的首次充放電曲線。樣品HT和ST在不同電流密度下的首次充電曲線在4.5 V左右的平臺區域仍舊不明顯。同時,從圖5中可以看出樣品SG、HS和CP具有更好的倍率性能,尤其是樣品CP。在20、100、200和400 mA·g-1電流密度下,樣品CP首次放電比容量分別為 218.0、199.2、193.7 和 178.7 mAh·g-1。 證 明 了Li2MnO3組分活化為材料貢獻了高的充電比容量,使其在放電過程中也呈現出高的比容量。
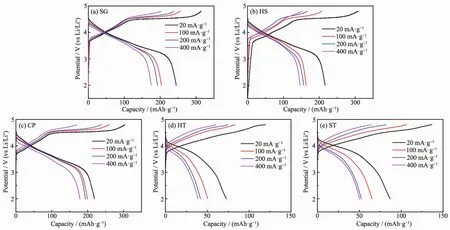
圖5 五個樣品在不同電流密度下的首次充放電曲線Fig.5 First charge-discharge curves at different current density
圖 6為 5個樣品在 100、200和 400 mA·g-1下的循環性能圖。可以看到,在200 mA·g-1下,樣品SG、HS、CP、HT和 ST經歷 100次循環后放電比容量分別為 154.2、138.7、164.1、45.6 和 61.5 mAh·g-1,容量保持率分別為80.0%、88.4%、84.7%、108.6%和117.6%。 在 400 mA·g-1下,樣品 SG、HS、CP、HT 和ST經歷100次循環后放電比容量分別為144.5、124.2、169.7、43.6 和 59.7 mAh·g-1,容量衰減率分別為17.5%、15.3%、5.00%、-11.4%和-18.3%。結合對圖4(b)和圖5的分析,我們發現樣品HT和ST的循環性能的反常現象在其他電流密度下仍舊存在,再次說明了樣品HT和ST中的Li2MnO3在電化學循環過程中難以被活化。
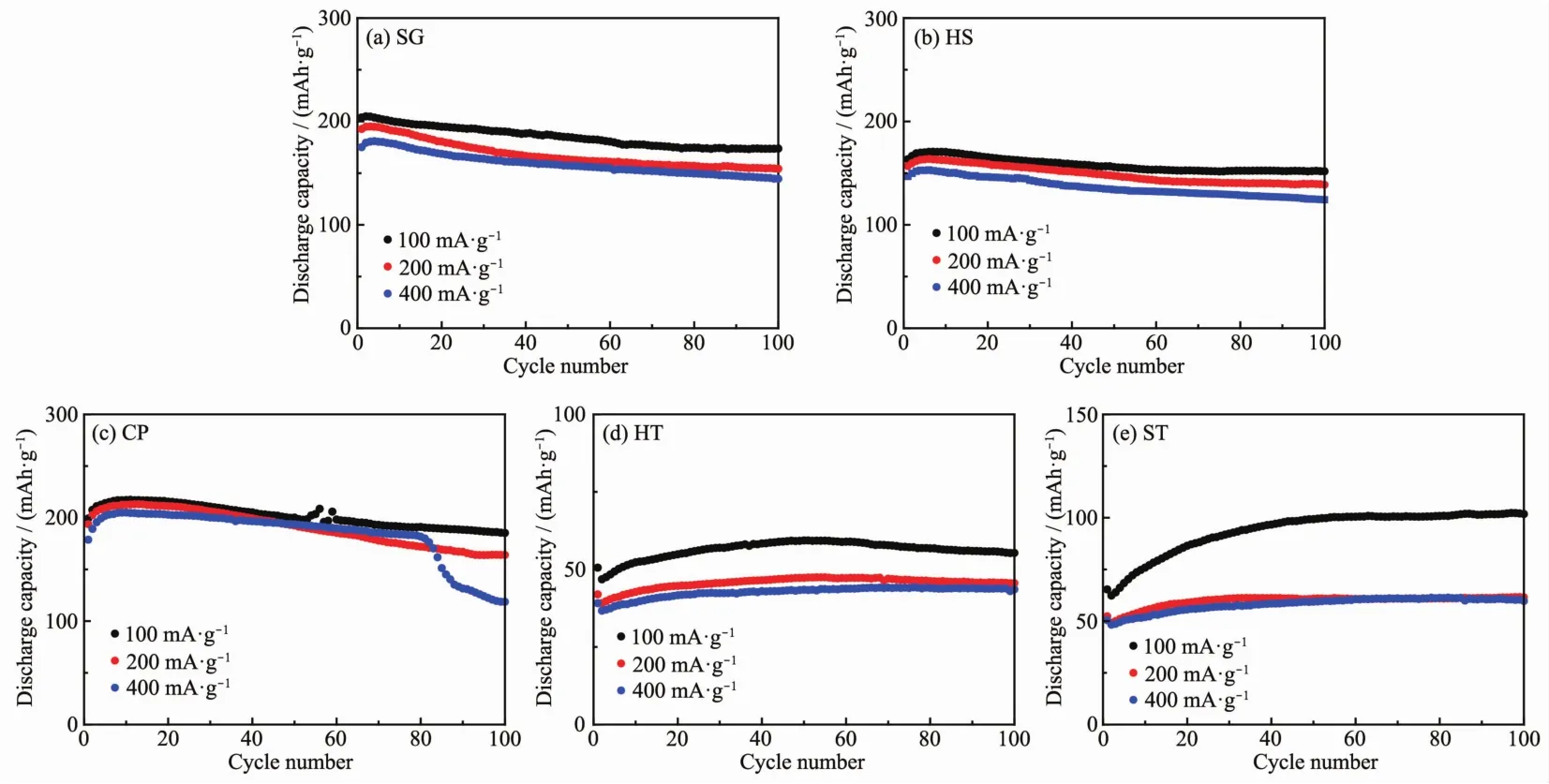
圖6 五個樣品在不同電流密度下的循環性能曲線Fig.6 Cycling performances of as-prepared samples at different current density
3 結 論
本文通過5種方法,即溶膠-凝膠法、高溫固相法、共沉淀法、水熱法和溶劑熱法合成了Li1.2Mn0.6Ni0.2O2正極材料。SEM和XRD分析表明5個富鋰樣品形貌相近,體相結構相同。拉曼光譜測試分析發現5個樣品的兩相集成方式不同,樣品CP傾向于以固溶體結構存在,樣品SG和HS以納米復合物形式存在,樣品HT和ST以非納米復合物形式存在。結合前人工作我們對5個樣品的電化學性能進行了預測,即在首次充電過程中樣品CP中的Li2MnO3可以充分活化使其具有較高的容量,較好的電化學性能,其次是樣品SG和HS,最差的是樣品HT和ST。通過電化學性能測試發現樣品CP的ΔCLi2MnO3為 47.88 mAh·g-1,由 Li2MnO3活化貢獻的實際充電比容量最接近理論充電比容量,Li2MnO3更容易被活化。樣品ST和HT的分別為167.93 和 169.28 mAh·g-1, 其中的 Li2MnO3很難被活化,表現出很低的實際充電比容量。這與我們預測的電化學性能結果相吻合,由此我們認為可以通過非原位拉曼光譜測試來區分富鋰材料的集成結構進而預測富鋰材料的電化學性能。
參考文獻:
[1]Choi N S,Chen Z,Freunberger S A,et al.Angew.Chem.Int.Ed.,2012,51(40):9994-10024
[2]Santhanam R,Rambabu B.J.Power Sources,2010,195(17):5442-5451
[3]Dunn B,Kamath H,Tarascon JM.Science,2011,334(6058):928-935
[4]Zhang X H,Luo D,Li G S,et al.J.Mater.Chem.A,2013,1(34):9721-9729
[5]Goodenough J B,Kim Y.Chem.Mater.,2010,22(3):587-603
[6]Yu H,Ishikawa R,So Y G,et al.Angew.Chem.Int.Ed.,2013,52(23):5969-5973
[7]Zhao X,Reddy M V,Liu H,et al.RSC Adv.,2014,4(47):24538-24543
[8]Yu H,Kim H,Wang Y,et al.Phys.Chem.Chem.Phys.,2012,14(18):6584-6595
[9]WANGHai-Yan(王海燕),TANG Ai-Dong(唐愛東),HUANG Ke-Long(黃可龍),et al.Chinese J.Inorg.Chem.(無機化學學報),2008,24(4):593-599
[10]Wei WF,Chen L B,Pan A Q,et al.Nano Energy,2016,30:580-662
[11]WEI Xuan-Ni(韋旋妮),LAI Qiong-Jie(賴瓊鈺),GAO Yuan(高媛),et al.Chinese J.Inorg.Chem.(無機化學學報),2005,21(7):999-1003
[12]Ohzuku T,Nagayama M,Tsuji K,et al.J.Mater.Chem.,2011,21(27):10179-10188
[13]Thackeray M M,Kang S H,Johnson C S,et al.J.Mater.Chem.,2007,17(30):3112-3125
[14]Song B,Lai M O,Liu Z,et al.J.Mater.Chem.A,2013,1(34):9954-9965
[15]Lee S,Kim E Y,Lee H,et al.J.Power Sources,2014,269:418-423
[16]JIANG Yao-Xue(姜搖雪),SHI Nan-Nan(史楠楠),ZHANG Yao-Ying(張搖瑩),et al.Chem.J.Chinese Universities(高等學校化學學報),2015,36(4):739-744
[17]Dixit H,Zhou W,Idrobo J,et al.ACS Nano,2014,8(12):12710-12716
[18]Zhang X H,Yu C,Huang X D,et al.Electrochim.Acta,2012,81(30):233-238
[19]Zheng J X,Liu T C,Hu Z X,et al.J.Am.Chem.Soc.,2016,138(40):13326-13334
[20]Ben-Kamel K,Amdouni N,Mauger A,et al.J.Alloys Compd.,2012,528(5):91-98
[21]ZHENG Zhuo(鄭卓),HUA Wei-Bo(滑緯博),WU Zhen-Guo(吳振國),et al.Chinese J.Inorg.Chem.(無機化學學報),2017,33(2):307-314
[22]Lu Z H,Chen Z H,Dahn JR,et al.Chem.Mater.,2013,15(16):3214-3220
[23]Johnson CS,Kim JS,Lefief C,et al.Electrochem.Commun.,2004,6(10):1085-1091
[24]Thackeray M M,Johnson C S,Vaughey JT,et al.J.Mater.Chem.,2005,15(23):2257-2267
[25]Thackeray M M,Kang S H,Johnson C S,et al.J.Mater.Chem.,2007,17(30):3112-3125
[26]Gu M,Genc A,Belharouak I,et al.Chem.Mater.,2013,25(11):2319-2326
[27]McCalla E,Li J,Rowe A W,et al.J.Electrochem.Soc.,2014,161(4):A606-A613
[28]Li J,Camardese J,Glazier S,et al.Chem.Mater.,2014,26(24):7059-7066
[29]Tang D C,Liu D T,Liu Y Y,et al.Prog.Nat.Sci.,2014,24(4):388-396
[30]Fan J M,Li G S,Li G H,et al.Electrochim.Acta,2017,245(10):118-127
[31]Jarvis K A,Deng Z Q,Allard L F,et al.Chem.Mater.,2011,23(16):3614-3621
[32]Inaba M,Iriyama Y,Ogumi Z,et al.J.Raman Spectrosc.,1997,28(8):613-617
[33]Ammundsen B,Burns GR,Islam M S,et al.J.Phys.Chem.B,1999,103(25):5175-5180
[34]Hwang SJ,Park H S,Choy J H,et al.Electrochem.Solid-State Lett.,2001,4(12):A213-A216
[35]Ruther R E,Dixit H,Pezeshki A M,et al.J.Phys.Chem.C,2015,119(32):18022-18029
[36]Karan N K,Saavedra-Arias J J,Pradhan D K,et al.Electrochem.Solid-State Lett.,2008,11(8):A135-A139
[37]Jeong SK,Song C H,Nahm K S,et al.Electrochim.Acta,2006,52(3):885-891
[38]Julien C.Solid State Ionics,2000,136-137(2):887-896

