阿爾茨海默病重組4Aβ15-TF亞單位疫苗的免疫原性研究
周果,李慶麗,陳博陽,師丹陽,陸健昇,周曉巍,余云舟
軍事醫學研究院 生物工程研究所,北京 100071
阿爾茨海默病(Alzheimer's disease,AD)俗稱老年癡呆,是一種伴隨著記憶力減退、認知功能障礙的神經退行性疾病,由德國醫生Alzheimer Alois于1906年首次發現[1]。目前它是老年人中僅次于心、腦血管病和癌癥的第四大致死病,給患者的家庭和社會造成了極大的經濟負擔和壓力。AD發病機制的主流假說是由Hardy于1992年提出的淀粉樣蛋白級聯假說(amyloid cascade hypothesis),該假說認為患者腦內淀粉樣前體蛋白(amyloid precursor protein,APP)水解產生過量有毒性的β淀粉樣蛋白(β-amyloid,Aβ)的聚集,是產生神經毒性的主要原因[2-3]。目前認為AD的主要組織病理學特征是患者大腦中胞外過度積累的Aβ42形成的淀粉樣斑塊,以及細胞內由過度磷酸化的Tau蛋白形成的神經纖維纏結[4]。因此,以毒性Aβ作為靶標,成為很多研究者治療AD的著力方向。
將Aβ作為重要靶標,通過主動免疫或被動免疫的方式清除過多聚集的Aβ是預防或治療AD的主要方法[4-5]。1999年Schenk等首次將人纖維化的Aβ42用于免疫AD轉基因小鼠并取得了一定的效果[6-7];一年后,Elan和Wyeth研究的AN-1792疫苗以人源纖維化Aβ42聯合QS21佐劑首次進行了臨床試驗,在Ⅰ期實驗中取得初步性良好反應后,臨床Ⅱ期有6%的患者出現了腦膜炎而被迫終止了實驗[8-9],多數人認為患者存在自身毒性T細胞免疫反應可能是炎癥出現的原因[10]。Aβ42是由1個B細胞表位(1~15)和2個T細胞表位(17~21,29~42)組成的多肽,研究發現,許多利用Aβ的N端B細胞表位制備的抗原蛋白免疫動物或AD模型動物后均能誘發Th2型免疫反應,避免Th1型炎癥細胞反應[11],因此AD免疫治療的研究方向是選擇靶向Aβ42的B淋巴細胞表位作為抗原疫苗。
本研究中重組融合抗原4Aβ15-TF采用的是Aβ42的B淋巴細胞表位Aβ15,同時基于研究表明Aβ分子中具毒性的是Aβ寡聚體[12-13],而進行了4個拷貝多重復串聯,形成多聚體結構,并加入一個輔助T細胞表位(AKFVAAWTLKAAA,簡稱TF),能夠刺激機體產生相應的T淋巴細胞反應,增加抗原的免疫原性。結果顯示,該重組融合抗原免疫C57BL/6小鼠取得了良好的免疫效果,為進一步研究靶向Aβ的AD重組亞單位疫苗奠定了基礎。
1 材料與方法
1.1 材料
6~8周齡雌性SPF級C57BL/6小鼠購自軍事醫學研究院實驗動物中心;大腸桿菌BL21(DE3)感受態細胞購自北京全式金生物技術有限公司;大腸桿菌Top10感受肽細胞和DNA純化回收試劑盒購自天根生物科技(北京)有限公司;pTIG-Trx原核表達載體為本實驗室保存;DNA聚合酶Prime STAR和T4DNA連接酶購自TaKaRa公司;限制性內切酶購自NEB公司;質粒小提試劑盒購自Omega公司;山羊抗小鼠IgG-HRP購自ZSGBBIO公司;山羊抗小鼠IgG1/IgG2a/IgG2b/IgG3/IgMHRP購自Santa Cruz公司;蛋白質分子量標準、轉膜緩沖液和Western印跡顯色試劑盒購自Thermo公司;基因和引物合成、基因測序、Aβ42多肽合成由上海生工生物工程股份有限公司完成。
1.2 原核表達載體的構建
重組融合蛋白4Aβ15-TF的基因序列由上海生工生物工程股份有限公司合成,并引入EcoRⅠ和XhoⅠ酶切位點,瓊脂糖凝膠電泳后純化回收得到目的片段,與原核表達載體pTIG-Trx雙酶切后室溫連接2 h,然后將連接產物轉化大腸桿菌Top10感受態,37℃過夜孵育,挑取單克隆菌落培養并提取質粒進行雙酶切鑒定,將陽性克隆測序驗證。
1.3 重組融合蛋白4Aβ15-TF的表達和純化
將測序正確的質粒轉化大腸桿菌表達菌株BL21(DE3)感受態細胞,過夜培養,挑取單克隆接種到5 mL 2×YT培養基(含100 μg/mL氨芐西林)中,37℃、220 r/min培養至菌液D600nm值達到0.6~1.0,按1%的比例轉至200 mL培養基中,37℃、220 r/min培養至菌液D600nm值達到0.6~1.0,加入終濃度為0.2 mmol/L的IPTG誘導表達,16℃、220 r/min過夜培養,8000 r/min離心10 min收集菌體,去掉上清培養基,用20 mmol/L pH8.0的PB緩沖液重懸,冰水浴條件下超聲波破碎,待破碎完全后4℃、8000 r/min離心20 min,收集上清用0.45 μm的濾紙過濾,加入終濃度為20 mmol/L的咪唑,以1 mL/min的速度讓上清穿過Ni柱使目的蛋白與其結合,上樣結束后用50~500 mmol/L咪唑進行梯度洗脫,最后用SDS-PAGE對收集的蛋白進行純度和含量鑒定,
1.4 Western印跡鑒定目的蛋白
純化好并脫去咪唑的目的蛋白用Western印跡進一步鑒定。樣品電泳結束后于轉膜緩沖液中浸泡15 min,按下層濾紙、PVDF膜、SDS-PAGE膠、上層濾紙的順序疊加鋪于轉膜儀上(避免氣泡),620 mA轉膜20 min,將膜于5%脫脂牛奶中室溫封閉2 h,加入1∶500稀釋的抗Aβ42抗體,室溫孵育2 h,用TBS-T洗膜3次,每次10 min,加入1∶5000稀釋的山羊抗小鼠IgG-HRP,室溫孵育30 min,TBST洗膜3次,每次10 min,將West?ern印跡顯影液A液和B液按1∶1的體積配制1 mL,用凝膠成像儀曝光顯影。
1.5 重組亞單位疫苗免疫C57BL/6小鼠
將6~8周齡的SPF級雌性C57小鼠隨機分成實驗組和陰性對照組,每組8只。實驗組每只小鼠每次免疫蛋白的劑量為5 μg,將重組抗原蛋白用無菌的PBS稀釋至50 μg/mL,并在配制疫苗時加入1/10體積的鋁佐劑(10 mg/mL)而成亞單位疫苗,采用肌內注射方式,注射體積100 μL,免疫3周后剪尾采血,每間隔3周加強免疫,共4次,免疫方案不變。
1.6 重組亞單位疫苗免疫后抗體水平、滴度和亞型測定
用包被液稀釋人工合成抗原Aβ42至終濃度為2 μg/mL,酶聯板每孔加入100 μL,4℃過夜包被抗原;用PBS-T洗滌6次,每孔加入200 μL 2%牛血清白蛋白(BSA),37℃封閉2 h;將采集的血清樣品于4℃、5500 r/min離心10 min后取上清,按1∶100稀釋(抗體滴度和亞型的測定先進行1/ 100稀釋,再按1/4梯度稀釋),每孔加入稀釋好的血清100 μL,37℃孵育2 h,PBS-T洗6次,每孔50 μL加入1∶5000用封閉液稀釋的山羊抗小鼠的IgG-HRP(或IgG1-HRP/IgG2a-HRP/IgG2b-HRP/ IgG3-HRP/IgM-HRP),37℃孵育0.5 h,PBS-T洗6次,加入50 μL現配的顯色液(240 mmol/L檸檬酸,50 mmol/L Na2HPO4,0.4 mg/mL OPD,0.1% H2O2),避光顯色10 min后用2 mol/L的H2SO4終止反應,酶標儀讀取D492nm及D630nm值。血清抗體水平取樣品的平均值,抗體滴度用終末稀釋ELISA法計算,以D492nm≥0.3為陽性結果。
1.7 細胞免疫水平測定
小鼠斷頸處死后在75%乙醇溶液中浸泡30 min,于超凈臺中取脾,用玻璃棒在400目細胞篩上研磨,用5 mL RPMI-1640培養基沖洗細胞篩,收集脾細胞懸液于15 mL離心管中,800 r/min離心10 min,棄上清;用5 mL NH4Cl吹打重懸沉淀,放置5 min,800 r/min離心10 min,棄上清;重復2次后加入5 mL RPMI-1640培養基(含10% FBS)重懸并計數;用RPMI-1640培養基稀釋脾細胞懸液至1×106/mL,在96孔板每孔中加入100 μL脾細胞懸液,并加入濃度為5 μg/mL的Aβ42和TF 100 μL,同時設置未刺激的空白對照組和ConA刺激的陽性對照組,每個組設置3個重復孔;將混勻后的96孔細胞板放入CO2細胞培養箱中,37℃培養3 d后在超凈工作臺中于每孔分別加入10 μL MTS,繼續培養4~5 h,測定各孔的D492nm值,計算刺激指數(stimulate index,SI)。

1.8 統計學分析
實驗數據以x±s表示,用SPSS統計學軟件采用單因素方差進行分析,P<0.05認為差異具有統計學意義。
2 結果
2.1 原核表達載體的構建
用柔性肽GS將4個Aβ15串聯,加入輔助T細胞表位,并對氨基酸表位進行密碼子優化,N端添加EcoRⅠ酶切位點,C端添加XhoⅠ酶切位點,合成基因序列4Aβ15-TF(圖1),將該基因克隆到原核表達載體pTIG-Trx中,用試劑盒提取該質粒進行雙酶切鑒定,鑒定正確的載體測序驗證,構建成pTIG-Trx-4Aβ15-TF。
2.2 重組融合蛋白4Aβ15-TF的表達、純化及鑒定
鑒定正確的質粒轉化表達后,用pH8.0的PB緩沖液重懸收集的菌體,冰水浴下進行超聲波破碎,破碎后收集上清,表達的目的蛋白主要以可溶性方式存在于上清中,用0.45 μm的濾紙過濾后經Ni柱純化,將純化后的蛋白進行SDS-PAGE和Western印跡(圖2),蛋白大小約為20 000(二聚體),且能特異性與抗Aβ42抗體結合,經鑒定為本研究所設計的蛋白。
2.3 重組亞單位疫苗免疫C57BL/6小鼠后抗體水平、滴度和亞型測定
用ELISA檢測小鼠免疫后的體液免疫反應。抗體水平測定結果表明(圖3),重組融合抗原4Aβ15-TF免疫小鼠產生了較強的針對Aβ42的特異性抗體,初次免疫后的血清抗體水平免疫組明顯高于PBS組,具有極其顯著的差異(P<0.01),抗體的水平隨免疫次數的增加而提高。抗體滴度結果如圖4,4次免疫后免疫組抗體滴度可達1∶120 000左右,相對于PBS組具有明顯差異(P< 0.01),由此表明嵌合疫苗能夠誘導機體產生較強的體液免疫反應。
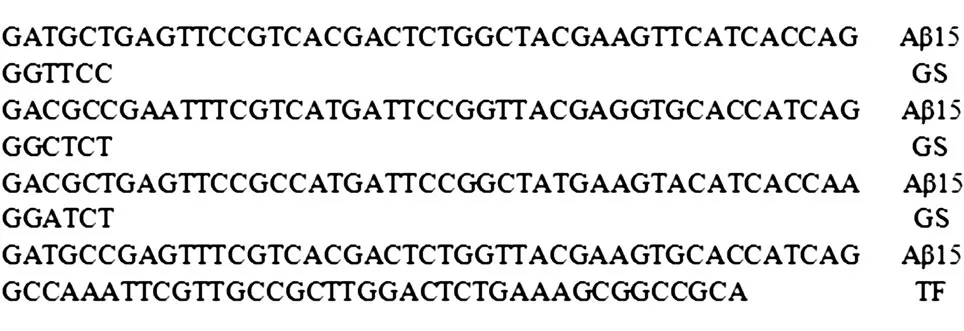
圖1 重組融合蛋白4Aβ15-TF的基因序列
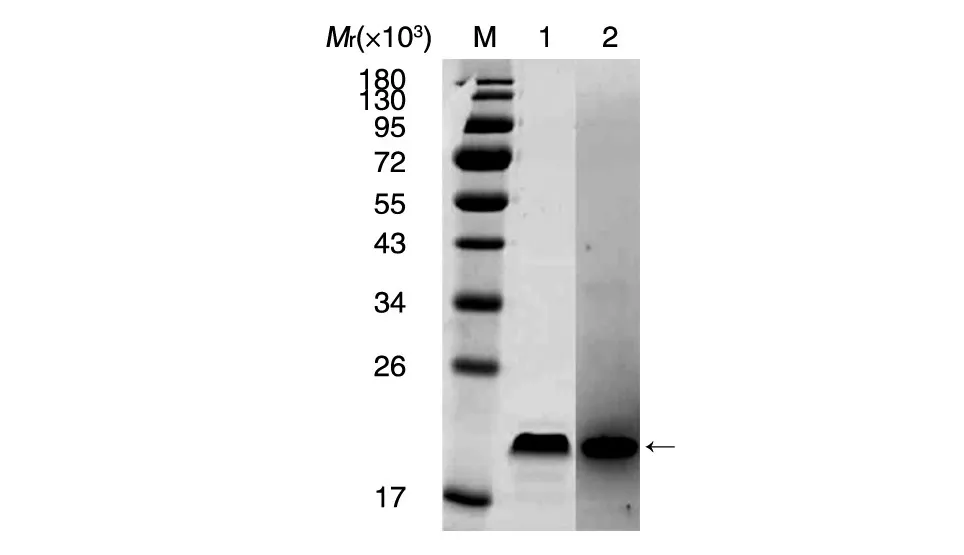
圖2 目的蛋白純化后的SDS-PAGE和Western印跡M:蛋白marker;1:SDS-PAGE鑒定純化產物;2:Western印跡鑒定純化產物;箭頭示目的蛋白條帶(20 000)
另外,對第3次免疫后采取的血清的抗體亞型進行了測定,結果表明(圖5)這種抗原免疫小鼠后產生的抗體亞型主要是IgG1,并且伴隨著少量的IgG2b,這說明抗原免疫后所產生抗體的主要來源是Th2型免疫反應。
2.4 重組亞單位疫苗免疫C57BL/6小鼠后T淋巴細胞增殖實驗
將免疫后小鼠的脾臟取出,分離淋巴細胞,用抗原刺激后,在CO2孵箱中培養 4 d,測定細胞的增殖情況,結果見圖6。經Aβ42抗原刺激的免疫組淋巴細胞增殖情況與對照組相比沒有明顯差異(P>0.05),沒有產生特異性的針對Aβ42的T細胞免疫反應;而經TF刺激的免疫組產生了相應的T細胞免疫反應,且與對照組相比有極其顯著的統計學差異(P<0.01)。
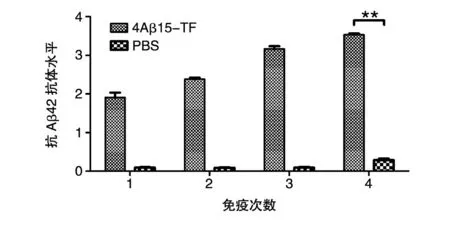
圖3 重組亞單位疫苗免疫小鼠后產生的特異性抗體水平
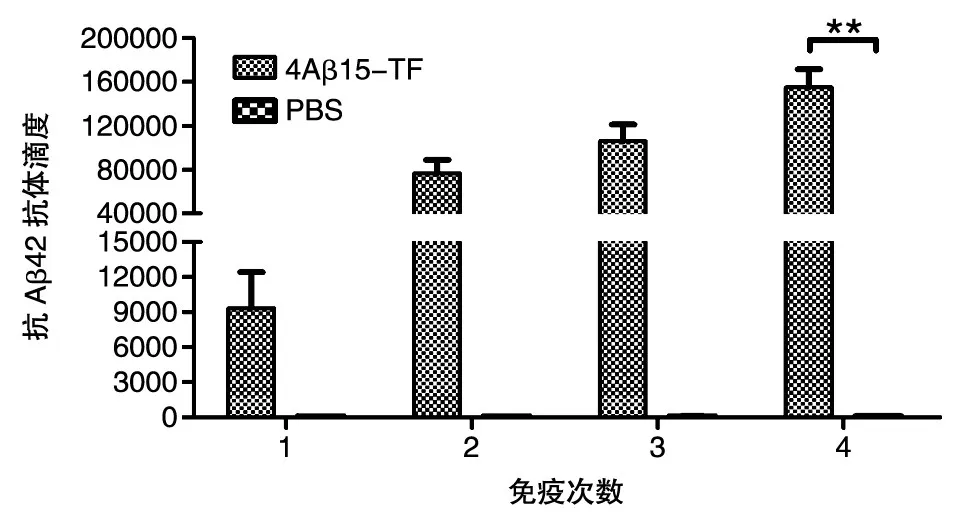
圖4 重組亞單位疫苗免疫小鼠后的抗體滴度
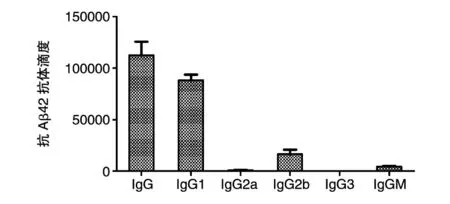
圖5 重組亞單位疫苗免疫小鼠后抗體亞型測定
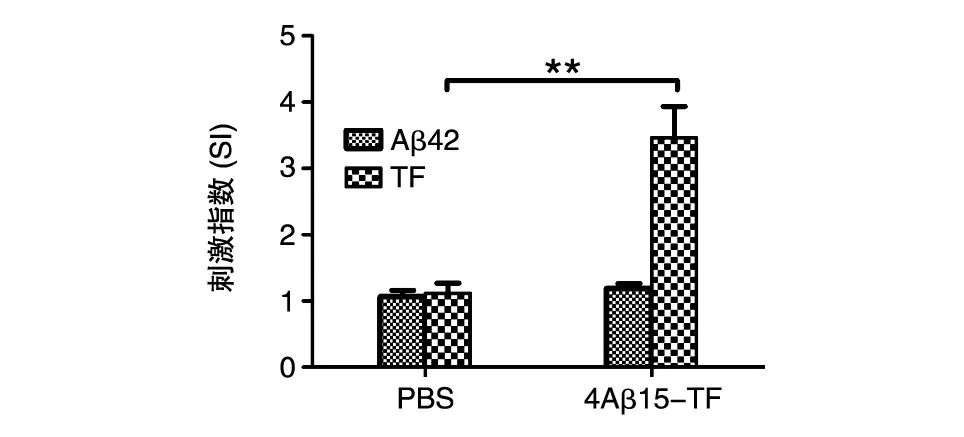
圖6 重組蛋白免疫小鼠后脾細胞經抗原刺激的增殖情況
3 討論
早期針對Aβ的主動免疫治療研究有2個問題,一是主動免疫用抗原免疫原性相對較差;二是臨床試驗中出現了炎癥反應,研究表明炎癥的出現是因為機體產生了針對Aβ42的Th1型細胞免疫反應。針對這些問題,我們只選取Aβ42中的B細胞表位Aβ15構建疫苗抗原分子,以避免出現自身Th1型炎癥細胞免疫反應;另外,Aβ分子中具毒性的是Aβ寡聚體,故將多個Aβ15分子用GS串聯,形成多聚體結構,同時融合了一個輔助性T細胞表位TF,以增強抗原的免疫原性。先前,本研究室利用這種策略研究6Aβ15-T重組融合蛋白抗原,結果表明該分子作為抗原疫苗具有良好的免疫原性,免疫小鼠后產生了高滴度的針對Aβ42的特異性抗體,并進一步證明其在AD模型鼠上也有著良好的免疫治療效果[14-15]。
將分子佐劑與蛋白疫苗結合,再共同作用于機體,也能增強疫苗的免疫原性。本實驗室在先前研究中用重組融合抗原聯合了幾種常見的佐劑免疫小鼠,結果發現鋁佐劑相對于其他佐劑,在快速增強抗原的免疫原性和誘使趨向Th2型抗體反應等方面更具優勢[15],而且鋁佐劑應用更加廣泛,也是適用于人的安全佐劑。另外,先前本實驗室對6Aβ15-T的研究結果也顯示鋁佐劑增強了抗原的免疫原性,并且產生的抗體反應趨向于Th2型[14]。因此,本研究采用鋁佐劑聯合重組嵌合抗原4Aβ15-TF免疫C57BL/6小鼠評價其免疫原性,證實其有效性。
在本研究中,我們探討了4個拷貝串聯的重組分子作為AD疫苗的可行性,設計了一個重組融合抗原分子4Aβ15-TF,人工合成其基因序列后用基因工程技術構建了原核表達載體pTIGTrx-4Aβ15-TF,表達且純化到了穩定性好、純度較高的4Aβ15-TF抗原,用其結合鋁佐劑免疫小鼠后產生了較強的針對Aβ42的特異性抗體,抗體水平隨免疫次數的增加而提高,4次免疫后的血清抗體滴度水平可達1∶120 000,證明此抗原有較好的免疫原性。血清抗體亞型主要是IgG1型和少量IgG2b型,證明免疫反應主要趨向于Th2型。免疫后沒有產生針對Aβ42而只產生了針對TF的特異性細胞免疫反應。后續,還將對重組融合抗原4Aβ15-TF作為亞單位疫苗在AD模型鼠上進行更進一步的研究,明確其免疫預防或治療效果,并與6Aβ15-T進行比較,為預防和治療AD提供安全有效的候選亞單位疫苗。
[1] Selkoe D J.Alzheimer's disease:gene,proteins,and therapy[J].Physiol Rev,2003,81:741.
[2] Crews L,Rockenstein E,Masliah E.APP transgenic modeling of Alzheimer's disease:mechanisms of neuro?degeneration and aberrant neurogenesis[J].Brain Struct Funct,2010,214(2-3):111-126.
[3] Hardy J,Selkoe D J.The amyloid hypothesis of Al?zheimer's disease:progress and problems on the road?to therapeutics[J].Science,2002,297(5580):353-356.
[4] Gody? J,Jo?czyk J,Panek D,et al.Therapeutic strate?gies for Alzheimer's disease in clinical trials[J].Phar?macol Rep,2016,68(1):127-138.
[5] Salomone S,Caraci F,Leggio G M,et al.New phar?macological strategies for treatment of Alzheimer's dis?ease:focusondiseasemodifyingdrugs[J].BrJClin Pharmacol,2012,73:504-517.
[6] Schenk D,Barbour R,Dunn W,et al.Immunization with amyloid-beta attenuates Alzheimer-disease-likepa?thology in the PDAPP mouse[J].Nature,1999,400:173-177.
[7] Schenk D,Hagen M,Seubert P.Current progress in beta-amyloidimmunotherapy[J].Curr Opin Immunol, 2004,16:599-606.
[8] Panza F,Logroscino G,Imbimbo B P,et al.Is there still any hope for amyloid-based immunotherapy for Alzheimer's disease[J]?Curr Opin Psychiatry,2014,27 (2):128-137.
[9] Panza F,Solfrizzi V,Imbimbo B P,et al.Amyloidbased immunotherapy for Alzheimer's disease in the time ofpreventiontrials:the way forward[J].Expert Rev Clin Immunol,2014,10(3):405-419.
[10]Cribbs D H,Ghochikyan A,Vasilevko V,et al.Adju?vant-dependent modulation of Th1 and Th2 responses to immunization with beta amyloid[J].IntImmunol, 2003,15:505-514.
[11]Agadjanyan M G,PetrovskyN,Ghochikyan A.A fresh perspective from immunologists and vaccine re?searchers:active vaccination strategies to prevent and reverse Alzheimer's disease[J]. Alzheimers Dement, 2015,11:1246-5129.
[12]WisniewskiT,Drummond E.Developingtherapeutic vaccines againstAlzheimer's disease[J].ExpertRev Vaccines,2016,15:401-415.
[13]Meli G,Lecci A,Manca A,et al.Conformational tar?geting ofintracellularAbeta oligomers demonstrates their pathological oligomerization inside the endoplas?mic reticulum[J].Nat Commun,2014,5:3867.
[14]Yu Y Z,Liu S,Wang H C,et al.A novel Aβ B-cell epitope vaccine(rCV01)for Alzheimer's disease im?proved synaptic and cognitive functions in 3x Tg-AD mice[J].J Neuroimmune Pharmacol,2016,11:657-668.
[15]劉思,趙萌,許文惠,等.融合輔助性T細胞表位的重組Aβ15表位嵌合抗原免疫原性研究[J].軍事醫學, 2014,38(1):44-47.

