腹腔注射脂多糖對幼鼠癲癇發作及海馬TLR4/HMGB1/P-IκB-α表達的影響
禚志紅 張 靜 李國棟 王懷立△
1)鄭州大學第一附屬醫院兒科,河南 鄭州 450052 2)鄭州大學生命科學學院,河南 鄭州 450052
癲癇是兒童神經系統常見的慢性疾病,約30%的患兒發展為難治性癲癇,藥物治療困難。近年來研究發現,炎癥在癲癇發作的發生及維持方面發揮著復雜而重要的作用,深入研究炎癥與癲癇發生發展的關系,有可能為難治性癲癇的病因治療提供一定的線索。本研究在海人酸(kainic acid,KA)誘導幼年大鼠癲癇發作前2 h腹腔注射脂多糖(lipopolysaccharide,LPS)預處理,檢測急性期海馬組織Toll樣受體4(Toll like receptor 4,TLR4)、高遷移率族蛋白(High mobility group protein 1,HMGB1)的基因及蛋白、磷酸化核因子抑制蛋白α(phosphorylated IkappaB-alpha,P-IκB-α)的蛋白表達水平,探討脂多糖預處理對幼鼠癲癇發作的影響以及可能的機制。
1 材料與方法
1.1實驗動物及主要試劑儀器
1.1.1 實驗動物:出生21 d的清潔級健康雄性SD大鼠,體質量40~50 g,由河南省實驗動物中心提供,許可證號:SCXK(豫)2015-0004。隨機分為生理鹽水組7只(對照組)、海人酸誘導組26只(模型Ⅰ組)、LPS預處理組31只(模型Ⅱ組)。每組造模成功后且存活的動物再隨機分為3 h、24 h兩個亞組,對照組僅設3 h亞組,每個亞組7只。
1.1.2 主要試劑:KA(美國santacruz,SC-200454A);LPS(美國Sigma,DG-L2880);RNA提取試劑盒(上海生工生物工程有限公司,SK1312);RNA 逆轉錄試劑盒(美國Thermo scientific,K1621);熒光定量PCR預混液(美國Thermo scientific,K0251);全蛋白提取試劑盒(上海生工生物工程有限公司,BSP003);改良型BCA法蛋白質濃度測定試劑盒(上海生工生物工程有限公司,SK3051);磷酸酶抑制劑復合物Ⅲ(上海生工生物工程有限公司,PL019);抗β-actin兔多克隆抗體(中國BBI,AB10024);抗TLR4兔多克隆抗體(英國abcam,ab13556);抗P-IκB-α小鼠多克隆抗體(美國Santacruze,sc-8404);抗HMGB1兔多克隆抗體(英國abcam ab191583);山羊抗小鼠IgG (中國BBI,D110087);猴抗兔IgG(中國BBI,AB10056)。
1.1.3 主要儀器:超微量分光光度計(美國Thermo scientific,NANODROP 2000);熒光定量PCR儀(瑞士Roche,LightCycler 480Ⅱ);臺式高速冷凍離心機(美國Sigma,1-14K);酶標儀(美國Molecular Devices,SpectraMax i3x);垂直電泳槽(美國Biorad,Mini-Protean 3);轉移電泳槽(美國Biorad);轉移電泳儀(美國Biorad,Powerpac);化學發光成像系統(美國Syngene,G:BOX Chemi-XT4)。
1.2方法
1.2.1 實驗動物模型制備及行為學觀察:模型組Ⅰ及對照組腹腔注射等量的生理鹽水,模型組Ⅱ腹腔注射LPS(100 μg/kg)。模型組Ⅰ和模型組Ⅱ注射生理鹽水/LPS后2 h腹腔注射KA(12 mg/kg)以誘導癲癇發作,對照組注射等量的生理鹽水。觀察注射KA/生理鹽水后2 h內各組大鼠的行為學表現,根據Racine標準對KA誘導的癲癇發作進行分級:Ⅰ級:面肌抽動,節律性咀嚼動作;Ⅱ級:節律性點頭或濕狗樣抖動;Ⅲ級:一側前肢陣攣;Ⅳ級:雙側前肢陣攣并站立;Ⅴ級:全身強直陣攣、跌倒[1]。Ⅳ級及以上為造模成功,SE持續2 h后,將水合氯醛(350 mg/kg)腹腔注射使發作終止,未達到Ⅳ級者從模型組中剔除。SE后3 h、24 h留取腦組織備用。
1.2.2 熒光定量PCR法檢測海馬內TLR4基因和HMGB1基因:①引物的設計與合成:根據Gene Bank中 SD大鼠TLR4、HMGB1及β-actin的基因序列,Primer Primer5.0軟件設計引物序列(見表1),由上海生工生物工程有限公司合成。引物用DEPC水配制為100 μM的工作液,-20 ℃保存備用。②總RNA的提取和CDNA的合成:在相應時間點將大鼠處死,冰上操作分離海馬組織,按說明書提取海馬組織中的總RNA;用Thermo Scientific Nano Drop2000分光光度計測定RNA的濃度和純度。依說明書進行mRNA的反轉錄、合成CDNA,-20 ℃保存備用。③Q-PCR反應:參照Thermo Scientific Maxima SYBR Green qPCR 預混液說明書在Light Cycler 480 實時熒光定量PCR儀進行RT-PCR反應。分析熔解曲線特異性,2-△△Ct分析法對大鼠海馬組織TLR4、HMGB1基因相對表達量進行分析,得相對表達倍數為N(N =2-△△Ct),其中△△Ct=(待測組的目的基因平均Ct值-待測組管家基因平均Ct值)-(對照組的目的基因平均Ct 值-對照組管家基因平均Ct 值)。

表1 TLR4、HMGB1基因引物序列
1.2.3 Westernblot檢測海馬內TLR4蛋白、P-IκB-α蛋白、HMGB1蛋白的表達
1.2.3.1 海馬組織蛋白提取:大鼠在相應時間點斷頭取腦,冰上快速分離海馬組織。蛋白提取按照試劑盒操作說明進行。提取蛋白后按照試劑盒說明進行蛋白定量。
1.2.3.2 SDS-PAGE凝膠電泳:將玻璃板洗凈后用雙蒸水浸泡沖洗。根據目的蛋白分子量選擇相應濃度的下層分離膠。依次配制分離膠和5%的濃縮膠,待濃縮膠聚合后,將待測樣品與上樣液充分混合,99 ℃水浴5 min。加入電泳緩沖液,蛋白樣品按30 μg依次上樣。開始電泳,電泳時間1.5~2 h。
1.2.3.3 轉膜:預先用甲醇浸泡PVDF膜15 ~ 20 min,蒸餾水漂洗,后浸泡于轉膜緩沖液中。按照:負極-海綿墊-濾紙-凝膠-PVDF膜-濾紙-海綿墊-正極的順序放置,關閉轉膜夾并插入充滿緩沖液的轉移電泳槽中。將電泳槽置于4 ℃冰盒中,200 mA恒流轉移1 h。
1.2.3.4 封閉和雜交:5%的脫脂牛奶室溫封閉1~2 h。TBST振蕩洗滌3次×10 min。用一抗稀釋液分別配制一抗工作液β-actin (1:5 000),HMGB1 (1:700),TLR4 (1:700),P-IκB-α(1:50);將PVDF膜放入一抗工作液中4 ℃過夜。TBST振蕩洗滌3次×10 min。將PVDF膜放入用5%脫脂牛奶配制的相應二抗工作液中,室溫孵育1 h。TBST振蕩洗滌3次×10 min。
1.2.3.5 顯影反應:選擇ECL發光法,采用數字凝膠成像分析系統進行掃描,使用Image-Pro Plus 5.0軟件分析條帶光密度,將目的蛋白條帶的光密度值與內參(β-actin)的光密度值做比值,計算各目的蛋白的相對表達量。
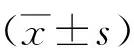
2 結果
2.1各組幼鼠癲癇發作成功及死亡情況比較行為學觀察模型Ⅰ組共26只SD鼠達SE并存活16只,模型Ⅱ組共31只SD鼠達SE并存活17只。模型Ⅰ組和模型Ⅱ組大鼠在KA注射后2 h內均出現行為改變,容易激惹、攻擊性強、飲食減少。見表2。

表2 各組幼鼠癲癇發作成功及死亡情況比較
2.2熒光定量PCR檢測急性期海馬組織TLR4基因、HMGB1基因的表達模型Ⅰ組、Ⅱ組在SE后3 h、24 h海馬TLR4及HMGB1基因表達量顯著高于對照組。SE后3 h模型Ⅱ組TLR4表達量顯著高于Ⅰ組,SE后24 h無顯著性差異;SE后3 h、24 h模型Ⅰ組HMGB1表達量與模型Ⅱ組比較無顯著性差異。見表3、4。
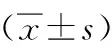
表3 各組SE后3 h和24 h海馬TLR4基因表達倍數比較
注:SE:癲癇持續狀態,Ct:熒光閾值循環數,TLR4:Toll樣受體4,對照組2-△△CT均為1,采用SPSS17.0軟件進行t檢驗,與生理鹽水比較:t=4.806,a1P<0.05;t=4.954,a2P<0.05;t=3.924,a3P<0.05;t=3.792,a4P<0.05;與模型Ⅰ組(3 h)比較:t=2.362,b1P<0.05;與模型Ⅰ組(24 h)比較:t=0.589,c1P>0.05
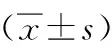
表4 各組SE后3 h和24 h海馬HMGB1基因表達倍數比較
注:SE:癲癇持續狀態,Ct:熒光閾值循環數,HMGB1:高遷移率族蛋白1,對照組2-△△CT均為1,采用SPSS17.0軟件進行t檢驗,與生理鹽水比較:t=3.626,a5P<0.05,t=5.255,a6P<0.05,t=4.046,a7P<0.05,t=2.836,a8P<0.05;與模型Ⅰ組(3 h)比較:t=0.569,b2P>0.05;與模型Ⅰ組(24 h)比較:t=0.691,c2P>0.05
2.3各組SE后3 h、24 hTLR4蛋白、HMGB1蛋白、P-IκB-α蛋白條帶灰度值分析Westernblot法檢測各組海馬TLR4蛋白、HMGB1蛋白、P-IκB-α蛋白表達 SE后各個時間點模型Ⅰ組與Ⅱ組海馬TLR4蛋白與P-IκB-α蛋白表達量均顯著高于對照組,與對照組比較,模型組HMGB1蛋白各時間點表達量無顯著性增加;SE后3 h模型Ⅱ組TLR4蛋白表達量顯著高于Ⅰ組,SE后24 h無顯著性差異;SE后3 h、24 h 模型Ⅱ組P-IκB-α蛋白表達量顯著高于Ⅰ組;模型Ⅰ組、Ⅱ組HMGB1蛋白表達量在各時間點均無顯著性差異。采用SPSS 17.0軟件進行t檢驗,結果見圖1、表5。

圖1 各組SE后3 h、24 hTLR4蛋白、HMGB1蛋白、P-IκB-α蛋白、β-actin蛋白表達情況

組別TLR4PIκBαHMGB1對照組0.16±0.0750.62±0.0230.333±0.95模型Ⅰ組(3h)0.61±0.032d10.87±0.021e10.41±0.93f1模型Ⅰ組(24h)0.55±0.112d21.42±0.031e20.31±0.99f2模型Ⅱ組(3h)0.84±0.086d3,g11.32±0.044e3,g30.37±0.99f3,g5模型Ⅱ組(24h)0.63±0.094d4,g22.13±0.035e4,g40.40±0.98f4,g6F值11.38488.3440.567P值<0.01<0.01>0.05
注:SE:癲癇持續狀態,TLR4:Toll樣受體4,P-IκB-α:磷酸化核因子抑制蛋白α,HMGB1:高遷移率族蛋白1,采用SPSS17.0軟件進行t檢驗,與生理鹽水比較:t=7.804,d1P<0.05,t=4.256,d2P<0.05,t=8.385,d3P<0.05,t=4.262,d4P<0.05;t=4.383,e1P<0.05,t=14.521,e2P<0.05,t=6.627,e3P<0.05,t=19.458,e4P<0.05;t=0.389,f1P>0.05,t=0.106,f2P>0.05,t=0.213,f3P>0.05,t=0.279,f4P>0.05。與模型Ⅰ組比較:t=4.284,g1P<0.05,t=0.737,g2P>0.05,t=4.249,g3P<0.05,t=9.120,g4P<0.05,t=0.168,g5P>0.05,t=0.385,g6P>0.05
3 討論
近年來的實驗和臨床研究提示,炎癥反應可能參與癲癇的發生發展,但大多數數據來源于成年癲癇患者或成年嚙齒動物,對兒童癲癇患者或幼年動物的研究較少。腦內炎癥反應與癲癇發作可能互為因果關系:(1)癲癇發作和繼發細胞損傷可引發炎癥反應;(2)炎癥反應可能促進癲癇發作;(3)炎癥反應可能參與癲癇發作后持久的細胞損傷[2-6]。針對炎癥反應的治療方法對一些難治性癲癇及癲癇持續狀態的治療效果也優于傳統抗癲癇藥[6]。LPS也稱內毒素,是革蘭氏陰性菌細胞壁的主要成分之一,能被TLR4識別并激活膠質細胞的固有免疫反應。TLR4是第一種被認為識別病原相關分子模式(Pathogen-associated molecular patterns,PAMPs)的受體,LPS可以被TLR4識別引發機體的免疫反應,從而抵抗病原體入侵[7-8]。張艷祥等[9]通過海馬內注射LPS誘發大鼠癲癇發作,且通過LPS活化TLR4可以加重鋰-匹羅卡品誘導的大鼠癲癇持續狀態。HMGB1是一種核染色質成分,正常生理情況下存在于細胞核中,死亡的細胞釋放的HMGB1被視為組織損傷的信號,可被TLR4識別并激活固有免疫反應。HMGB1引發的免疫反應與外源性病原體入侵時相似,但分子機制仍未明確[7,10-12]。正常生理條件下活化核轉錄因子κB(Nuclear factor-κ-genebinding,NF-κB)與調節蛋白κB抑制劑(IκB-α)結合,以失活狀態存在于胞質中。當細胞受到TNF-α、LPS或吸入性麻醉劑等一系列外源性刺激時,TLR4/HMGB1信號通路依賴MyD88活化NF-κB,活化的NF-κB轉移入核并促進炎癥介質表達[13-14]。本研究在KA誘導幼年大鼠癲癇發作前2 h給予LPS預處理,檢測急性期海馬組織中TLR4、HMGB1基因及蛋白、P-IκB-α蛋白表達水平,探討TLR4/HMGB1/IκB-α在LPS加重幼年大鼠癲癇發作中的變化。
在癲癇小鼠模型和人類顳葉癲癇、Rasmussen腦炎的研究中發現,TLR4/HMGB1通路在癲癇慢性病程中可以促進驚厥發作[15-18],也參與膠質瘤相關癲癇的發生機制[19-20]。臨床研究也發現癲癇患兒血清中HMGB1等炎癥因子水平升高[16,21-24]。HMGB1作為一種損傷相關分子模式(Damage-associated molecular patterns,DAMPs),正常情況下存在于胞核中,當組織損傷時由死亡的細胞釋放到胞外。研究發現,海人酸誘導的癲癇細胞模型中,HMGB1可以通過改變表達量和細胞分布位置,參與癲癇發生的病理生理學過程[12,25],但是并未闡述具體機制及相關的信號通路。本研究發現LPS預處理可以增加KA造模的成功率及模型鼠的病死率,癲癇急性期海馬TLR4、HMGB1的基因表達均顯著增加,TLR4、P-IκB-α蛋白表達亦顯著增加,但HMGB1總蛋白無顯著改變;而LPS預處理可顯著增加TLR4、P-IκB-α蛋白的表達,對HMGB1的基因水平及蛋白表達無顯著性影響。提示LPS預處理使TLR4表達量升高,通過增加IκB-α磷酸化,在LPS預處理的幼鼠中促進癲癇發作急性期腦內炎癥反應,進而加重癲癇發作。
TLR4/HMGB1信號通路可能促進驚厥的發生和持續,或許可作為治療靶點改善難治性癲癇患者的治療效果[8,11,26]。研究發現,通過抑制HMGB1/TLR4信號通路可以減輕癲癇發作對神經系統的炎癥損傷[27],對難治性癲癇有一定的治療效果,也可抑制自身免疫性腦脊髓炎相關的癲癇[26,28-29]。但是由于炎癥網絡的復雜性,需要注意一系列炎癥因子的相互作用[30]。未來需要更多研究針對多種關鍵促炎因子聯合治療,以全面抑制炎癥網絡,可能達到更加一致的治療結果。本研究結果提示、癲癇發作引起的損傷細胞釋放HMGB1可以活化TLR4受體,通過磷酸化IκB-α活化下游炎癥反應,LPS預處理可以加強這一現象從而加重癲癇發作,提示抑制TLR4活性或者抑制IκB-α磷酸化或許可以減輕癲癇發作引起的腦內炎癥反應,進而為尋找針對病因治療的新型抗癲癇藥物提供理論依據。
[1] RACINE R J.Modification of seizure activity by electri-cal stimulation.II.Motor seizure[J].Electroencephalogr Clin Neurophysiol,1972,32(3):281-294.
[2] 張靜,禚志紅,王懷立.脂多糖預處理對癲癇幼鼠Toll樣受體4/高遷移率族蛋白1基因表達及海馬硬化的影響[J].中華實用兒科臨床雜志,2016,31(21):1 658-1 662.
[3] DUPUIS N,AUVIN S.Inflammation and epilepsy in the developing brain:clinical and experimental evidence[J].CNS Neurosci Ther,2015,21(2):141-151.
[4] LEGIDO A,KATSETOS C D.Experimental studies in epilepsy:immunologic and inflammatory mechanisms[J].Semin Pediatr Neurol,2014,21(3):197-206.
[5] VEZZANI A,VIVIANI B.Neuromodulatory properties of inflammatory cytokines and their impact on neuronal excitability[J].Neuropharmacology,2015,96(Pt A):70-82.
[6] MARCHI N,GRANATA T,JANIGRO D.Inflamma-tory pathways of seizure disorders[J].Trends Neurosci,2014,37(2):55-65.
[7] BIANCHI M E,MANFREDI A A.Dangers In and Out[J].Science,2009,323(5 922):1 683-1 684.
[8] FALIP M,SALAS-PUIG X,CARA C.Causes of CNS inflammation and potential targets for anticonvulsants[J].CNS Drugs,2013,27(8):611-623.
[9] 張艷祥,遲兆富,劉學伍,等.海馬內注射脂多糖導致癇性發作及其機制[J].山東大學學報(醫學版),2012,50(9):1-5.
[10] MISKIN C,HASBANI D M.Status epilepticus:immunologic and inflammatory mechanisms[J].Semin Pediatr Neurol,2014,21(3):221-225.
[11] MATIN N,TABATABAIE O,FALSAPERLA R,et al.Epilepsy and innate immune system:A possible immunogenic predisposition and related therapeutic implications[J].Hum Vaccin Immunother,2015,11(8):2 021-2 029.
[12] HUANG J S,WU Y,HUANG Q,et al.Expression level and distribution of HMGB1 in Sombati's cell model and kainic acid-induced epilepsy model[J].Eur Rev Med Pharmacol Sci,2015,19(15):2 928-2 933.
[13] LUO L,JIN Y,KIM I D,et al.Glycyrrhizin suppresses HMGB1 inductions in the hippocampus and subsequent accumulation in serum of a kainic acid-induced seizure mouse model[J].Cell Mol Neurobiol,2014,34(7):987-997.
[14] WANG D,SHI J,LV S,et al.Artesunate Attenuates Lipopolysaccharide-Stimulated Proinflammatory Responses by Suppressing TLR4,MyD88 Expression,and NF-kappaB Activation in Microglial Cells[J].Inflammation,2015,38(5):1 925-1 932.
[15] VEZZANI A.Epilepsy and inflammation in the brain:overview and pathophysiology[J].Epilepsy Curr,2014,14(1 Suppl):3-7.
[16] YANG W,LI J,SHANG Y,et al.HMGB1-TLR4 Axis Plays a Regulatory Role in the Pathogenesis of Mesial Temporal Lobe Epilepsy in Immature Rat Model and Children via the p38MAPK Signaling Pathway[J].Neurochem Res,2017,42(4):1 179-1 190.
[17] LUAN G,GAO Q,ZHA F,et al.Upregulation of HMGB1,toll-like receptor and RAGE in human Rasmussen's encephalitis[J].Epilepsy Res,2016,123:36-49.
[18] 李曉輝,王新軍,楊如意,等.顳葉難治性癲癇患者致癇灶腦組織中HMGB1、TLR4表達及意義[J].實用醫學雜志,2016,32(19):3 223-3 227.
[19] 周少龍,王新軍,付旭東,等.伴有癲癇的人腦膠質瘤中HMGB1/TLR4的表達研究[J].中華神經醫學雜志,2015,14(6):563-566.
[20] 王新軍,楊如意,單嶠,等.人腦膠質瘤組織HMGB1表達與膠質瘤相關性癲癇關系的探討[J].中華腫瘤防治雜志,2015,22(15):1 180-1 183.
[21] 王懷立,郭慶敏,禚志紅,等.癲(癇)患兒血清高遷移率族蛋白1及白細胞介素-6水平變化的意義[J].中華實用兒科臨床雜志,2015,30(22):1 738-1 740.
[22] 桂蘭,康靖,呂麗英.癲癇患兒血清HMGB1、IL-2、INF-γ 水平變化及其意義[J].山東醫藥,2017,57(11):60-62.
[23] 郭電渠,王新軍,楊如意,等.癲癇患者血清HMGBI及其受體TLR4水平及臨床意義分析[J].中華神經醫學雜志,2016,15(9):936-940.
[24] WALKER L E,FRIGERIO F,RAVIZZA T,et al.Molecular isoforms of high-mobility group box 1 are mechanistic biomarkers for epilepsy[J].J Clin Invest,2017,127(6):2 118-2 132.
[25] KANEKO Y,PAPPAS C,MALAPIRA T,et al.Extracellular HMGB1 Modulates Glutamate Metabolism Associated with Kainic Acid-Induced Epilepsy-Like Hyperactivity in Primary Rat Neural Cells[J].Cell Physiol Biochem,2017,41(3):947-959.
[26] MAROSO M,BALOSSO S,RAVIZZA T,et al.Toll-like receptor 4 and high-mobility group box-1 are involved in ictogenesis and can be targeted to reduce seizures[J].Nat Med,2010,16(4):413-419.
[27] 金玉玲,單鶴,劉蕾.吡格列酮對戊四氮致癇大鼠Toll樣受體、核因子-κB表達的影響[J].中國老年學,2016,36(16):3 890-3 893.
[28] RAVIZZA T,TERRONE G,SALAMONE A,et al.High Mobility Group Box 1 is a novel pathogenic factor and a mechanistic biomarker for epilepsy[J].Brain Behav Immun,2017 Oct 13.pii:S0889-1591(17)30464-6.
[29] LIU A H,WU Y T,WANG Y P.MicroRNA-129-5p inhibits the development of autoimmune encephalomye-litis-related epilepsy by targeting HMGB1 through the TLR4/NF-kB signaling pathway[J].Brain Res Bull,2017,132:139-149.
[30] DEY A,KANG X,QIU J,et al.Anti-Inflammatory Small Molecules To Treat Seizures and Epilepsy:From Bench to Bedside[J].Trends Pharmacol Sci,2016,37(6):463-484.

