再談鈉鉀元素的焰色反應
2018-03-19 03:01:42李俊生
中小學實驗與裝備
2017年6期
關鍵詞:實驗
李俊生
焰色反應實驗是中學化學實驗教學的重點實驗之一,2017年高考理綜(全國Ⅰ卷)35題更是出現了考核鉀元素焰色反應的理論問題。近年來的實驗教學表明,很多人對焰色反應實驗的理解存在一定的偏差,焰色反應實驗成功的操作要點還不明晰,特別是鈉元素或鉀元素焰色反應的機理還有很多使學生迷惑的問題,因此有必要對焰色反應的機理以及實驗操作要點做進一步的分析。
1焰色反應的機理
火焰中金屬元素的物理化學歷程是很復雜的,一般認為,試液霧粒在火焰中有如圖1所示的復雜的反應歷程。
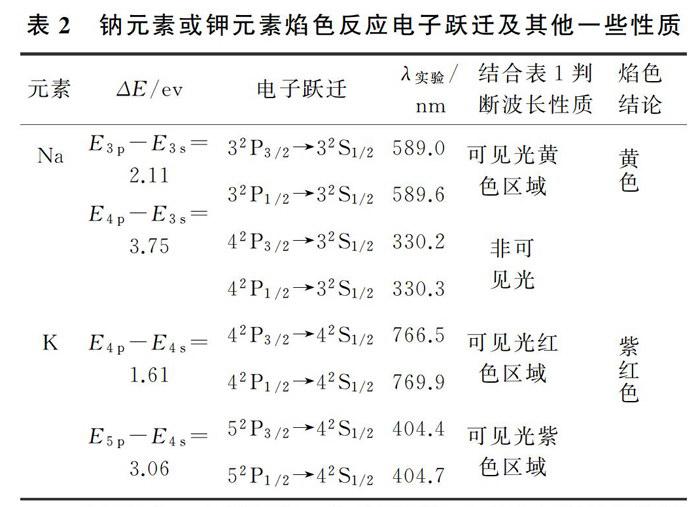
對于蘸在鉑絲表面的NaCl(aq)而言,圖1表明NaCl(aq)經過脫水、蒸發、分解等物理化學變化形成基態Na原子,基態Na原子再被熱能激發。激發的結果使Na原子的最外層電子吸收一定的能量而離開原來的能級,跳躍到較高的能級,處于較高能級的電子是不穩定的,躍遷回基態或低能態,產生不同波長的輻射,從而得到不同的焰色。其中輻射光的頻率滿足如下公式:
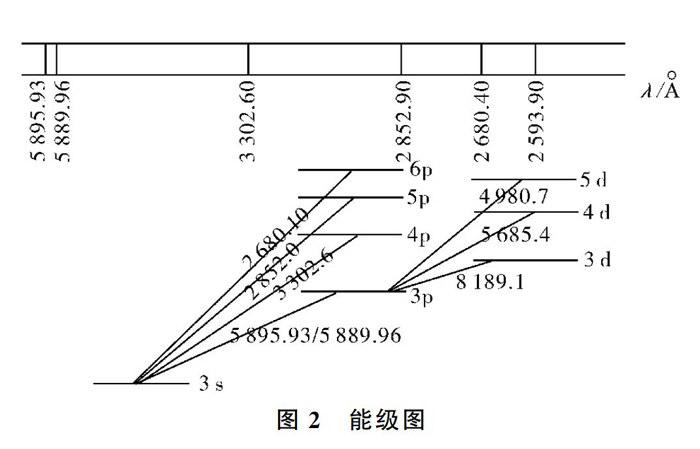
E1、E2表示電子在低能級或高能級時的能量,h為普朗克常數。鈉光譜的一個光譜系和鈉原子的簡單能級圖如圖2所示。
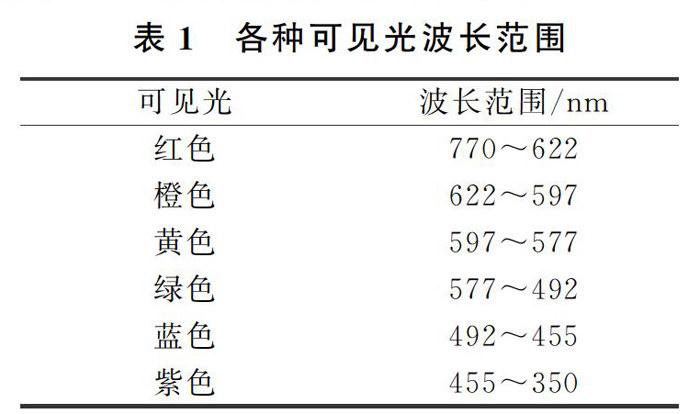
圖2表明了鈉原子[Na]3s1中3s1電子在不同能級的躍遷情況。在這些光譜線中,最強的是3s→3p的躍遷,波長分別是589.0~589.6nm雙線,它是鈉的特征雙線,稱作D線(黃色),而事實上人眼感知的可見光的波長范圍見表1。
由表1可以看到,鈉元素的3s一3p躍遷對應的波長處于可見光黃色區域,因此鈉元素的焰色反應為黃色。……
登錄APP查看全文
猜你喜歡
作文·小學低年級(2025年2期)2025-02-13 00:00:00
小雪花·小學生快樂作文(2024年11期)2024-12-31 00:00:00
作文·小學低年級(2024年2期)2024-04-29 00:00:00
作文·小學低年級(2023年3期)2023-04-29 00:00:00
小獼猴智力畫刊(2022年9期)2022-11-04 02:31:42
小主人報(2022年4期)2022-08-09 08:52:06
小哥白尼(趣味科學)(2019年6期)2019-10-10 01:01:50
發明與創新(2016年38期)2016-08-22 03:02:52
太空探索(2016年5期)2016-07-12 15:17:55
實驗流體力學(2011年5期)2011-01-14 01:25:28