宮頸癌組織中組織因子途徑抑制物-2表達變化及其與VEGF表達、微血管密度的相關性
李娜,熊嬌,史明媚,王露露,付立仙
(遵義醫學院附屬醫院,貴州遵義 563000)
血管形成是惡性腫瘤生長、侵襲和轉移的關鍵步驟,也是改善腫瘤預后的重要突破口[1]。組織因子途徑抑制物2(TFPI-2),又名胎盤蛋白-5,是一種Kunitz型絲氨酸蛋白酶抑制物,廣泛存在于人體組織和器官。TFPI-2能夠抑制多種蛋白酶活性,如基質金屬蛋白酶、纖溶酶等[2],在多種生理病理過程中發揮重要作用,如血管生成、腫瘤細胞的侵襲轉移等。有研究證實,TFPI-2能夠阻礙新生血管的形成,從而抑制人纖維肉瘤細胞的增殖、侵襲及遠處轉移[3]。但是TFPI-2在宮頸癌組織中的表達變化及其對宮頸癌血管新生的影響尚不清楚。微血管密度(MVD)是組織血管新生狀況的直接反映。血管內皮生長因子(VEGF)是經典的促血管生長因子,能夠促進細胞血管內皮增生,促進血管生成,并增加血管通透性[4]。本研究觀察了宮頸癌組織TFPI-2表達變化,并分析宮頸癌組織TFPI-2表達與VEGF表達及MVD的相關性,探討TFPI-2對宮頸癌組織血管新生的影響。現報告如下。
1 材料與方法
1.1 臨床資料 選擇2012年1月~2014年12月收治的80例宮頸癌患者的腫瘤組織標本為宮頸癌組。納入標準:病理診斷為宮頸癌、具有完整的病例資料。排除標準:患者合并其他惡性腫瘤、全身感染性疾病、肝腎疾病等。患者年齡33~62歲,其中≤50歲37例、>50歲43例。有HPV感染者45例、無HPV感染者35例;病理分級G1者32例,G2者31例,G3者17例;有淋巴結轉移59例、無淋巴結轉移21例;按照2009年NCCN指南臨床分期標準Ⅰ+Ⅱ期65例、ⅢⅢ+Ⅳ期15例。另收集50例宮頸上皮內瘤變(CIN)患者的病灶組織標本為CIN組,患者年齡30~65歲;20例接受宮頸活檢者病理結果為正常宮頸的受檢者的宮頸組織標本為對照組,年齡32~63歲。三組入組者年齡相比P>0.05。本研究已獲得醫院倫理委員會審核同意,入組者已簽署知情同意書。
1.2 各組標本TFPI-2、VEGF檢測 采用免疫組化SP法。各組標本經10%甲醛固定,石蠟包埋,5 μm切片。二甲苯脫蠟,100%、95%、85%乙醇浸泡水化,98 ℃的枸櫞酸鈉溶液(0.01 mol/L,pH=6.0)中浸泡15 min進行抗原修復,滴加正常山羊血清室溫封閉15 min,棄血清,滴加TFPI-2、VEGF一抗工作液,37 ℃孵育2 h,PBS洗滌5 min ,洗滌3次,,滴加生物素二抗,室溫孵育30 min,PBS洗滌5 min ,洗滌3次, DAB顯色,充分沖洗后蘇木素復染,常規脫水,透明,干燥,封片。以已知陽性切片為陽性對照,PBS替代一抗為陰性對照。陽性染色結果為細胞質內棕黃色顆粒。每份標本均選擇10個含有陽性細胞的高倍視野(×200)分別計數100個腫瘤細胞,取其平均值計算陽性細胞百分率。按陽性細胞百分率計分:無陽性細胞計0分,陽性細胞百分率≤25%計1分,陽性細胞百分率26%~50%計2分,陽性細胞百分率>50%計算3分。按染色程度計分:無陽性著色計0分,淺黃色計1分,深黃色計2分,棕黃色計3分。兩項得分之和>3分判定為陽性,≤3分定為陰性。
1.3 各組標本MVD檢測 采用免疫組化SP法行CD34染色,具體方法同1.2。結果判定采用Weidner量化分析法[5]:低光鏡下尋找微血管分布均勻區域(排除腫瘤出血區和邊緣反應區)。隨機選取5個視野,高倍鏡(×200)下計數染成棕黃色的血管數,計算平均值,即為MVD。與鄰近腫瘤細胞、血管、結締組織界限清晰,且呈棕黃色的內皮細胞或內皮細胞簇,即為1個微血管數;排除腫瘤硬化區以及、>8個紅細胞的血管。采用Decaussin法[6],以MVD平均值為分界線,≥平均值者判定為高MVD,否則判定為低MVD。
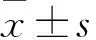
2 結果
2.1 三組標本TFPI-2、VEGF蛋白表達及MVD比較 宮頸癌組、CIN組、對照組TFPI-2陽性表達率分別為21.25%(17/80)、52.00%(26/50)和85.00%(17/20),宮頸癌組TFPI-2陽性表達率與CIN組、對照組相比,P均<0.05;CIN組TFPI-2陽性表達率與對照組相比,P均<0.05。宮頸癌組、CIN組、對照組VEGF陽性表達率分別為72.50%(58/80)、42.00%(21/50)和10.00%(2/50),宮頸癌組VEGF陽性表達率與CIN組、對照組相比,P均<0.05;CIN組VEGF陽性表達率與對照組相比,P均<0.05。
宮頸癌組、CIN組、對照組MVD分別為(22±8)、(10±2)、(6±2)條/HP,宮頸癌組MVD與CIN組、對照組相比,P均<0.05;CIN組MVD與對照組相比,P均<0.05。
2.2 宮頸癌組標本TFPI-2表達與VEGF表達、MVD的相關性 宮頸癌組標本中TFPI-2、VEGF均為陽性8例,TFPI-2陽性VEGF陰性5例,TFPI-2陰性VEGF陽性5例,TFPI-2、VEGF均為陰性1例,Spearman等級相關性分析結果顯示,宮頸癌組標本TFPI-2和VEGF蛋白表達呈負相關(r=-0.632,P<0.05)。以MVD平均值為分界線判定MVD高低,宮頸癌組標本高MVD者53例、低MVD者37例。宮頸癌組標本高MVD且TFPI-2陽性6例,高MVD且TFPI-2陰性47例,低MVD且TFPI-2陽性13例,低MVD且TFPI-2陰性24例。Spearman等級相關性分析結果顯示,宮頸癌組標本TFPI-2蛋白表達與MVD呈負相關(r=-0.685,P<0.05)。
3 討論
在我國,宮頸癌的發病率位居女性惡性腫瘤的首位。全世界每年大約有53萬宮頸癌新發病例和27萬死亡病例,且大約85%死亡病例發生在不發達國家或者發展中國家[7]。目前宮頸癌發病機制尚不完全清楚。因此,探討宮頸癌發生發展機制,將為臨床治療宮頸癌提供新的治療思路和理論依據,并為宮頸癌防治藥物的研發提供新機制、新靶點、新方向。
細胞外基質(ECM)被降解是腫瘤生長和侵襲的關鍵步驟,TFPI-2能夠下調與ECM相關的蛋白酶的酶活性,維持ECM的穩定性,從而減慢或者阻礙腫瘤細胞的侵襲轉移過程[8]。大量研究結果表明,TFPI-2在多種惡性腫瘤中呈低表達狀態,如胰腺癌[9]等。本研究結果顯示,宮頸癌組織TFPI-2蛋白陽性表達率顯著低于宮頸上皮內瘤樣變組織和正常宮頸組織,提示TFPI-2抑制了宮頸癌的發生,具有抑癌基因的功能,與Libra等[10]的研究結論一致。TFPI-2表達降低是宮頸癌相關的分子標志之一。惡性腫瘤的發生、增殖、侵襲轉移等均依賴于腫瘤血管生成[11],同時血管生成也是影響腫瘤患者預后的重要因素。目前,評估腫瘤血管生成狀態的金標準是MVD[12],MVD可直觀地反映腫瘤的血管生成能力。同時MVD能夠反映腫瘤的侵襲性及惡性程度,可以作為多種腫瘤預后預測的獨立指標[13]。
VEGF能夠增加血管通透性,促進血管內皮細胞的增殖,是促進血管生成的最主要的因子[14]。VEGF的表達水平,也可以作為評價血管活性強度的良好指標之一。VEGF不僅與腫瘤血管生成有關,而且與腫瘤的侵襲轉移密切有關[15,16]。本研究結果顯示宮頸癌組織TFPI-2蛋白表達和VEGF表達、MVD均呈負相關。表明TFPI-2能夠抑制宮頸癌組織血管形成。而VEGF可能是其中重要的效應蛋白。TFPI-2可能是通過抑制宮頸癌組織VEGF表達進而抑制宮頸癌組織血管生成。
TFPI-2通過下調VEGF蛋白表達抑制了宮頸癌新生血管的生成,阻斷其營養供應,抑制腫瘤增殖,進而發揮其抑制腫瘤侵襲轉移的作用。這為宮頸癌的臨床治療提供了新的研究方向。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Keizer MP, Pouw RB, Kamp AM, et al. TFPI inhibits lectin pathway of complement activation by direct interaction with MASP-2[J]. Eur J Immunol, 2015,45(2):544-550.
[3] Xu C, Deng F, Mao Z, et al. The interaction of the second Kunitz-type domain (KD2) of TFPI-2 with a novel interaction partner, prosaposin, mediates the inhibition of the invasion and migration of human fibrosarcoma cells[J]. Biochem J, 2012,441(2):665-674.
[4] Saponaro C, Malfettone A, Ranieri G, et al. VEGF, HIF-1α expression and MVD as an angiogenic network in familial breast cancer[J].PLoS One,2013,8(1):e53070.
[5] Weidner N. Intratumor microvessel density as a prognostic factor in cancer[J]. Am J Pathol, 1995,147(1):9-19.
[6] Decaussin M, Sartelet H, Robert C, et al. Expression of vascular endothelial growth factor (VEGF) and its two receptors (VEGF-R1-Flt1 and VEGF-R2-Flk1/KDR) in non-small cell lung carcinomas (NSCLCs): correlation with angiogenesis and survival[J]. J Pathol, 1999,188(4):369-377.
[7] Wardak S. Human Papillomavirus (HPV) and cervical cancer[J]. Med Dosw Mikrobiol, 2016,68(1):73-84.
[8]Libra M, Scalisi A, Vella N, et al. Uterine cervical carcinoma: role of matrix metalloproteinases (review)[J]. Int J Oncol, 2009,34(4):897-903.
[9] Folkman J. Role of angiogenesis in tumor growth and metastasis[J]. Semin Oncol, 2002,29(6 Suppl 16):15-18.
[10] Triratanachat S, Niruthisard S, Trivijitsilp P, et al. Angiogenesis in cervical intraepithelial neoplasia and early-staged uterine cervical squamous cell carcinoma: clinical significance[J]. Int J Gynecol Cancer, 2006,16(2):575-580.
[11] Randall LM, Monk BJ, Darcy KM, et al. Markers of angiogenesis in high-risk, early-stage cervical cancer: A Gynecologic Oncology Group study[J]. Gynecol Oncol, 2009,112(3):583-589.
[12] Cimpean AM, Mazuru V, Saptefrati L, et al. Prox 1, VEGF-C and VEGFR3 expression during cervical neoplasia progression as evidence of an early lymphangiogenic switch[J]. Histol Histopathol, 2012,27(12):1543-1550.
[13] Ferrara N. Vascular endothelial growth factor and age-related macular degeneration: from basic science to therapy[J]. Nat Med, 2010,16(10):1107-1111.
[14] Takahashi S. Vascular endothelial growth factor (VEGF), VEGF receptors and their inhibitors for antiangiogenic tumor therapy[J]. Biol Pharm Bull, 2011,34(12):1785-1788.
[15] Gessler F, Voss V, Seifert V, et al. Knockdown of TFPI-2 promotes migration and invasion of glioma cells[J]. Neurosci Lett, 2011,497(1):49-54.
[16] Tang Z, Geng G, Huang Q, et al. Expression of tissue factor pathway inhibitor 2 in human pancreatic carcinoma and its effect on tumor growth, invasion, and migration in vitro and in vivo[J]. J Surg Res, 2011,167(1):62-69.

