G0S2基因在食管癌組織中表達變化及對癌細胞增殖、凋亡的影響
祝鋮,李蓮,唐俊明,張蕾,鄭飛
(湖北醫藥學院附屬人民醫院,湖北十堰442000)
G0S2基因最早發現于血液單核細胞[1]。早期研究認為,G0S2基因在調節細胞周期及細胞增殖方面有重要作用[2]。研究發現,G0S2基因能夠與其他蛋白相結合來發揮自身生物學效應,如通過結合B淋巴細胞瘤-2基因促進腫瘤細胞凋亡[3]。G0S2基因可能具有抗癌作用,但尚未得到驗證。食管癌組織中存在G0S2基因甲基化現象,其因甲基化而沉默[4],提示G0S2基因消除甲基化恢復表達可能成為治療食管癌的新途徑。本研究觀察食管癌組織中G0S2基因的表達情況,并觀察G0S2基因高表達對食管癌細胞增殖和凋亡的影響,為防控食管癌提供新的方向。
1 材料與方法
1.1 材料來源 2016年3月~2017年4月本院手術切除的45例份食管癌組織(患者男40例、女5例,年齡47~70歲、中位年齡59歲,術前均未行放化療)及其相應的癌旁正常組織(距癌組織邊緣>5 cm),均經病理檢查證實,于液氮中凍存。TRIzol試劑、DEPC水購于美國Sigma公司;RNA逆轉錄試劑盒購于美國賽默飛公司;RT-PCR上、下游引物及GAPDH引物均購于武漢金開瑞生物工程公司;瓊脂糖粉購于Lonza公司;食管癌KYSE-70細胞購于中國科學院上海細胞所;G0S2腺病毒裂解液與空載體由本院臨床醫學研究所提供;甲基化抑制劑5-氮雜-2-脫氧胞苷試劑購于Sigma公司;RPMI-1640培養基、胎牛血清、胰酶等均購于美國Gibco公司。
1.2 食管癌及癌旁正常組織中G0S2基因表達檢測 采用qRT-PCR法。按照TRIzol試劑說明書提取組織RNA,根據RNA逆轉錄試劑盒說明書對已提取的RNA進行逆轉錄。G0S2行qRT-PCR擴增,上游引物:5′GGCCTGATGGAGACTGTGTG3′、下游引物:5′CTTGCTTCTGGAGAGCCTGT3′,全長115 bp。GAPDH上游引物:5′GAAGGTGAAGGTCGGAGTC3′,下游引物:5′GAAGATGGTGATGGGATTTC3′。qRT-PCR反應體系10 μL,反應條件:95 ℃預變性10 min,95 ℃變性15 s,60 ℃退火延伸32 s,共40個循環。讀取各樣本Ct值,用2-ΔΔCt法計算基因相對表達量。
1.3 KYSE-70細胞培養及處理 用含10%胎牛血清的RPM 1640培養基培養KYSE-70細胞,置于37 ℃、5% CO2、濕度適宜的培養箱中。待細胞長至70%~80%時,隨機分為空白組、Ad-Null組、Ad-G0S2組及0、25、50、100 μmol/L 5-氮雜-2-脫氧胞苷組。Ad-Null組、Ad-G0S2組分別轉染Ad-G0S2、Ad-Null,0、25、50、100 μmol/L 5-氮雜-2-脫氧胞苷組分別給予0、25、50、100 μmol/L濃度的甲基化抑制劑5-氮雜-2-脫氧胞苷進行處理。將各組細胞繼續培養24 h。用 qRT-PCR技術檢測各組G0S2mRNA表達,方法同1.2。轉染后及經5-氮雜-2-脫氧胞苷處理后細胞內G0S2mRNA相對表達量升高,說明實驗成功。
1.4 細胞增殖能力檢測 采用CCK-8法。收集各組細胞接種于96孔板,每孔1.0×104/mL,每組設置5個復孔。培養結束后向每孔滴加CCK-8試劑10 μL,孵育2 h。用酶標儀測定450 nm波長下各個孔的吸光度值。
1.5 細胞凋亡率檢測 采用Annexin V-FITC/PI雙染法。取各組細胞用4 ℃預冷無菌PBS洗滌2次,并用0.25%的胰酶(含0.02%EDTA)消化離心,用Binding Buffer 200 μL重懸細胞,調整細胞為(2~5)×105/mL,取細胞懸液195 μL,加入Annexin V-FITC 5 μL,輕輕混勻后間隔3 min再加入PI 10 μL,混勻,室溫避光孵育10 min。在反應管中加入無菌PBS 300 μL,混勻。上機檢測細胞凋亡情況,計算細胞凋亡率。
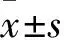
2 結果
2.1 G0S2基因在食管癌組織和癌旁組織中的表達比較 G0S2基因在食管癌組織和癌旁組織中的相對表達量分別為31.9±7.8、1,二者比較差異有統計學意義(P<0.05)。
2.2 G0S2對KYSE-70細胞增殖的影響 空白組、Ad-Null組、Ad-G0S2組及0、25、50、100 μmol/L 5-氮雜-2-脫氧胞苷組吸光度值分別為0.99±0.05、0.91±0.12、0.56±0.17、0.87±0.08、0.75±0.03、0.68±0.06、0.60±0.02。Ad-G0S2組吸光度較其他兩組低(P均<0.05),空白組與Ad-Null組吸光度值比較差異無統計學意義(P>0.05);隨5-氮雜-2-脫氧胞苷濃度升高,吸光度值逐漸降低,細胞增殖活力下降(P均<0.05)。
2.3 G0S2對食管癌KYSE-70細胞凋亡的影響 空白組、Ad-Null組、Ad-G0S2組及0、25、50、100 μmol/L 5-氮雜-2-脫氧胞苷組細胞凋亡率分別為3.2%±2.8%、3.6%±2.1%、12.1%±1.8%、1.3%±0.4%、4.1%±1.7%、7.3%±1.9%、9.5%±1.1%。Ad-G0S2組細胞凋亡率較其他兩組高(P<0.01),空白組與Ad-Null組凋亡率比較差異無統計學意義(P>0.05);隨5-氮雜-2-脫氧胞苷濃度升高,細胞凋亡率升高(P<0.05)。
3 討論
研究表明,G0S2基因能調節細胞增殖分化,促進癌細胞凋亡,抑制腫瘤發生發展等;調節細胞由G0期向G1期轉化,細胞進入G1期后誘導G0S2基因瞬時表達,G0S2反過來抑制細胞由G0期進入G1期,從而能使細胞穩定增殖和分化[5]。細胞只有正常地表達G0S2基因,才能夠正常、穩定地進入細胞分化的過程[6]。最近有研究指出,接受造血干細胞移植的患者,其外周血單核細胞中的G0S2基因表達明顯上調[7]。研究發現,膠質瘤患者中癌細胞G0S2基因低表達,與膠質瘤細胞的發生發展密切相關[8]。以上說明G0S2基因對細胞增殖有重要的穩定和調控作用。抑癌基因失活是癌癥發生的重要因素之一[9],而抑癌基因的啟動子區發生甲基化是其失活的重要環節[10]。癌組織與正常組織中的G0S2基因甲基化程度存在明顯差異,因此G0S2基因的表達水平亦存在明顯差異[11]。近年來研究發現,G0S2基因的啟動子區因發生高甲基化而沉默,呈低表達,從而導致癌癥的發生,在頭頸部癌、肺癌、乳腺癌等多種癌癥中均已被發現并證實[12]。最近在皮膚鱗癌組織中也發現G0S2基因因甲基化而沉默的現象[13]。研究發現,人慢性髓系白血病細胞的G0S2基因調控序列和外顯子區因處于高甲基化的狀態而沉默,使用特定的去甲基化試劑后發現,細胞增殖活性降低[14];相反利用特定技術使G0S2基因沉默,則促進癌細胞增殖。有研究用shRNA使大腸癌細胞的G0S2基因沉默,發現大腸癌細胞增殖活力明顯提高[15]。由此可見,一方面甲基化現象在癌癥中廣泛存在,如何消除甲基化使G0S2基因正常、穩定地表達從而發揮抑癌作用,是癌癥高效治療的關鍵所在。另一方面說明G0S2基因高表達治療食管癌具有一定的理論依據;且食管癌的傳統治療方案效果欠佳,食管癌患者5年生存率較低,生活質量差。目前對G0S2基因在食管癌治療中作用的研究較少,以此為研究方向可能成為食管癌高效治療的突破口。本研究結果顯示,食管癌組織中G0S2基因呈低表達,證明食管癌的發生可能與G0S2基因低表達有密切關系;通過轉染及甲基化轉移酶抑制劑5-氮雜-2-脫氧胞苷使G0S2基因過表達后兩種方法,G0S2基因能夠抑制食管癌KYSE-70細胞的增殖,促進其凋亡。
G0S2基因正常表達是抑制食管癌細胞增殖、促進其凋亡的重要因素;如何消除甲基化從而使G0S2基因正常、穩定地表達可能是預防和治療食管癌的研究熱點。G0S2基因的甲基化修飾及其在食管癌發生、發展中如何發揮作用有待進一步的研究。
[1] Siderovski DP, Blum S, Forsdyke RE, et al. A set of human putative lymphocyte G0/G1 switch genes includes genes homologous to rodent cytokine and zinc finger protein-encoding genes[J]. DNA Cell Biol, 1990,9(8):579.
[2] Russell L, Forsdyke DR. A human putative lymphocyte G0/G1 switch gene containing a CpG-rich island encodes a small basic protein with the potential to be phosphorylated[J]. DNA Cell Biol, 1991,10(8):581-591.
[3] Oh SA, Suh Y, Pang MG, et al. Cloning of avian G0/G1 switch gene 2 genes and developmental and nutritional regulation of G0/G1 switch gene 2 in chicken adipose tissue[J]. J Anim Sci, 2011,89(2):367-375.
[4] Wan SG, Doong TJ, Chen H, et al. Zinc deficiency and G0S2DNA methylation in rat esophageal carcinogenesis[J]. Cancer Res, 2010,70(8s):146.
[5] Heckmann BL, Zhang X, Xie X, et al. The G0/G1 switch gene 2 (G0S2): regulating metabolism and beyond[J]. Mol Cell Biol L, 2013,1831(2):276-281.
[6] Choi H, Lee H, Kim TH, et al. G0/G1 switch gene 2 has a critical role in adipocyte differentiation[J]. Cell Death Differ, 2014,21(7):1071-1080.
[7] Verner J, Kabathova J, Tomancova A, et al. Gene expression profiling of acute graft-vs-host disease after hematopoietic stem cell transplantation[J]. Exp Hematol, 2012,40(11):899.
[8] Yim CY, Sekula DJ, Freemantle SJ, et al. G0S2functions as a tumor suppressor gene through inhibition of c-Myc[J]. Cancer Res, 2015,75(15 s):2026.
[9] Barreau O, Assié G, Wilmot-Roussel H, et al. Identification of a CpG island methylator phenotype in adrenocortical carcinomas[J]. J Clin Endocr Metab, 2013,98(1):174-184.
[10] Filiz O, Julide A, Ates K, et al. Methylation of tumor suppressor genes in ovarian cancer[J]. Exp Ther Med, 2012,4(6):1092-1096.
[11] Huang WY, Hsu SD, Huang HY, et al. Meth HC: a database of DNA methylation and gene expression in human cancer[J]. Nucleic Acids Res, 2015,43:D856-D861.
[12] Kusakabe M, Watanabe K, Emoto N, et al. Impact of DNA demethylation of the G0S2gene on the transcription of G0S2in squamous lung cancer cell lines with or without nuclear receptor agonists[J]. Biochem Bioph Res Co, 2009,390(4):1283-1287.
[13] Nobeyama Y, Watanabe Y, Nakagawa H. Silencing of G0/G1 switch gene 2 in cutaneous squamous cell carcinoma[J]. PLoS One, 2017,12(10):e0187047.
[14] Yamada T, Park CS, Ye S, et al. G0S2inhibits the proliferation of K562 cells by interacting with nucleolin in the cytosol[J]. Leukemia Res, 2014,38(2):210-217.
[15] Rachid Z, Wissal EA, Isabelle G, et al. Inhibition of adipose triglyceride lipase (ATGL) by the putative tumor suppressor G0S2or a small molecule inhibitor attenuates the growth of cancer cells[J]. Oncotarget, 2015,6(29):28282-28295.

