DKK1基因過表達慢病毒載體構建及其在大鼠腎上腺嗜鉻細胞瘤細胞PC12中的表達
李慧華,仝書嚴,陳銳,張才溢,耿德勤
(徐州醫科大學,江蘇徐州221004)
Dickkop-1(DKK1)是DKK蛋白家族成員之一。DKK1基因是經典Wnt/β-catenin信號通路的抑制劑。DKK1基因可參與誘導頭部的產生,在胚胎發育、神經再生、突觸形成等體內多種病理生理過程中發揮作用[1,2]。研究發現,機體內DKK1基因表達異常,可引起認知障礙、情緒異常等神經精神疾病[3,4]。近年尸檢發現阿爾茨海默病(AD)患者腦組織DKK1基因表達增加。小鼠海馬組織DKK1表達隨年齡增加而增加,并伴有空間工作記憶障礙。DKK1基因在AD中的作用引起了越來越多的關注[5,6]。此外,DKK1基因還在腫瘤及腎臟、肝臟、骨疾病中發揮重要作用[7,8]。大鼠腎上腺嗜鉻細胞瘤PC12細胞作為類神經元細胞,在結構、功能上與神經元有很多相似之處,但較神經元容易培養,常用于神經精神系統疾病的體外研究[9]。2016年6月~2017年6月,本研究選用PC12細胞為研究對象,建立穩定細胞系,為進一步探討DKK1基因在神經精神疾病中的作用及分子生物學研究奠定基礎。
1 材料與方法
1.1 材料 目的基因DKK1 (NM_001106350)、慢病毒載體質粒GV358(Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin)、慢病毒包裝質粒pHelper1.0、pHelper2.0和E.coli DH5α感受態細菌、293T細胞(上海吉凱基因化學技術有限公司);PC12細胞為本實驗室保存。RPMI1640培養基(Cyclone),胎牛血清(Gemini),嘌呤霉素(Selleck),蛋白裂解液 (上海吉凱基因化學技術有限公司),DKK1抗體(Abcam),β-actin抗體(Santa Cruz),限制性內切酶AgeI(NEB)、Taq DNA聚合酶(SinoBio),dNTP(Takara),Primer(捷瑞生物),In-FusionTMPCR Cloning Kit(clontech),質粒抽提試劑盒(Promega),瓊脂糖凝膠DNA回收試劑盒(天根生化),Lipofectmine 2000(invitrogen),SYBR?qPCR Mix(Roche)。
1.2 DKK1基因擴增 采用RT-PCR法。參考GenBank中DKK1的cDNA編碼序列(NM_001106350),使用Primer5軟件設計引物,交由上海吉凱基因化學技術有限公司合成引物序列。DKK1基因上游引物序列:5′-GAGGATCCCCGGGTACCGGTCGCCACCATGACGGTTGTGCGTGCAGTGGCAG-3′,下游引物序列:5′-TCCTTGTAGTCCATACCGTGTCTCTGGCAGGTGTGGAGCCTG-3′(在上下游引物5端分別加入限制性內切酶AgeI/AgeI酶切位點及保護堿基)。以含有DKK1基因的cDNA庫為模板,擴增DKK1基因序列。PCR反應體系:98 ℃預變性5 min、98 ℃變性10 s、55 ℃退火10 s、72 ℃延伸90 s,共30個循環;72 ℃保溫8 min,4 ℃保存。PCR產物大小854 bp。擴增產物行1%瓊脂糖凝膠電泳,用DNA凝膠回收試劑盒切膠回收RT-PCR產物。
1.3 DKK1基因慢病毒表達載體的構建與鑒定 用限制性內切酶AgeI/AgeI對GV358載體進行酶切,使其線性化。瓊脂糖凝膠電泳回收酶切產物。將線性化的GV358載體DNA和DKK1基因酶切產物進行連接反應,于冰水浴中配制如下反應體系:ddH2O 2.5 μL,5×CE Ⅱ Buffer 2 μL,酶切后的載體DNA 2.5 μL,純化后的PCR產物片段2 μL,ExnaseTMⅡ 1 μL;于37 ℃反應30 min,隨后置于冰水浴中冷卻5 min后立即轉化至大腸桿菌DH5a感受態細菌。將細菌接種于含有氨芐青霉素的平板上,在恒溫培養箱中倒置培養12~16 h。挑取重組陽性克隆行PCR初步鑒定后及送測序。PCR鑒定上游引物:5′-GGGTCAATATGTAATTTTCAGTG-3′,下游引物:5′-CCTTATAGTCCTTATCATCGTC-3′,產物1 005 bp。反應體系包括:ddH2O 9.2 μL,2× Taq Plus Master Mix 10 μL,上下游引物各0.4 μL,單個菌落,總體積20 μL。反應條件:94 ℃預變性3 min,94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸30 s,30個循環,72 ℃延伸5 min,保存。采用空載體質粒為陰性對照組,有GAPDH的載體為陽性對照組,排除假陰性和假陽性結果。對PCR陽性克隆片段進行測序。
1.4 重組慢病毒的包裝及滴度測定 GV358-DKK1基因慢病毒載體系統包裝:取對數生長期的293T細胞,調整細胞密度為5×106/mL,胰酶消化后接種于直徑10 cm細胞培養皿中,37 ℃、5% CO2培養箱內培養24 h,細胞長至70%~80%融合時進行轉染。將GV358-DKK1質粒和兩種病毒包裝輔助質粒pHelper1.0、pHelper2.0分別進行高純度無內毒素質粒抽提,采用Lipofectamine2000脂質體介導的瞬時轉染法進行共轉染,包裝293T細胞。培養6 h后更換為完全培養基,繼續培養48 h收集上清,離心去除細胞碎片;0.45 μm濾器過濾,超速離心濃縮后收集病毒濃縮液,-80 ℃保存。將293T細胞按4×104/孔接種96孔板,分別加入逐孔稀釋法稀釋的病毒液,48 h后觀察熒光表達情況,估計慢病毒轉染目的細胞的效率。同時設立空載體對照組。收取細胞抽取基因組DNA并做定量PCR檢測,計算滴度,公式:qPCR滴度=N×C/V。N為感染時24孔板中對應孔的細胞數量,C(每個細胞中含有的慢病毒個數)=(A拷貝數/B拷貝數)×2,V為對應孔中感染的慢病毒體積。
1.5 PC12細胞感染及穩轉細胞株篩選 PC12細胞培養于含10% FBS的1640培養基中,取對數生長期的PC12細胞接種于6孔板中,第2天細胞密度50%左右進行病毒感染。將細胞隨機分為三組,空白對照組、空載體陰性對照組、PC12-DKK1組,空載體陰性對照組、PC12-DKK1組分別用制備的空載體慢病毒(GV358-Vector)及GV358-DKK1顆粒進行感染,24 h后更換為正常培養基繼續培養;空白對照組常規培養。經嘌呤霉素(終濃度1.5 μg/mL)篩選2周后獲得穩定感染的細胞株。
1.6 PC12細胞中DKK1 mRNA表達檢測 采用qRT-RCR技術。收集三組細胞,分別加入TRIzol等提取總RNA,瓊脂糖凝膠電泳確定RNA完整性,紫外分光光度計檢測RNA的濃度和純度;RNA逆轉錄獲得cDNA,再以適量cDNA為模板進行PCR擴增。內參GAPDH引物序列:上游5′-TCCCTCAAGATTGTCAGCA-3′、下游5′-AGATCCACAACGGATACATT-3′;DKK1引物序列上游5′-TTGACAACTACCAGCCCTACCC-3′、下游5′-CTCGAGGTAAATGGCTGTGGTC-3′。擴增條件:95 ℃預變性5 min,95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸30 s,循環35次,72 ℃ 10 min,4 ℃保存。采用2-ΔΔCt法計算基因相對表達量。
1.7 PC12細胞內DKK1蛋白表達檢測 采用Western blotting法。收集三組細胞,用細胞裂解液進行裂解,提取總蛋白,BCA法測定蛋白濃度,計算上樣量,配制10% SDS-PAGE凝膠,常規電泳、轉膜、封閉,隨后分別用一抗DKK1(1∶1 000)和β-actin(1∶1 000)4 ℃孵育過夜,室溫孵育二抗2 h,Odyssey雙色紅外激光成像系統進行條帶掃描。采用Image J軟件分析條帶灰度值,用DKK1灰度值比內參灰度值作為DKK1蛋白的相對表達量。
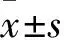
2 結果
2.1 GV358-DKK1慢病毒載體的構建結果 用設計的DKK1引物進行PCR擴增,瓊脂糖凝膠電泳圖譜可見大小約為854 bp的特異性條帶。抗生素篩選菌落,PCR對重組子進行鑒定,擴增出大小為1 005 bp的陽性克隆片段,對陽性克隆菌進行測序,測序結果與目標序列完全一致。證明GV358-DKK1慢病毒載體構建成功。
2.2 慢病毒包裝及病毒滴度測定結果 三質粒(GV358-DKK1/GV358-vector、Helper1.0、Helper2.0)共同轉染293T細胞48 h后熒光顯微鏡下見大量綠色熒光,約95%以上且熒光強度高,293T細胞生長狀態好,表明慢病毒包裝成功且轉染效率高。收集、濃縮病毒后逐孔稀釋滴度測定法測定GV358-vector和GV358-DKK1的滴度分別為6×108、2×108TU/mL。
2.3 PC12細胞慢病毒感染結果 慢病毒感染PC12細胞72 h后可見少許熒光。用嘌呤霉素連續篩選2周后,熒光顯微鏡下所有細胞可見綠色熒光,感染效率大于95%。
2.4 感染后各組細胞內DKK1 mRNA及蛋白表達比較 空白對照組、空載體陰性對照組、PC12-DKK1組細胞DKK1 mRNA相對表達量分別為1.02±0.27、0.97±0.24、133.74±0.93,DKK1蛋白相對表達量分別為1.02±0.14、1.06±0.12、1.48±0.21。PC12-DKK1組DKK1 mRNA及蛋白相對表達量均較空載體陰性對照組和空白對照組高(P均<0.05)。
3 討論
DKK家族由4個成員(DDK-1、DDK-2、DDK-3、DDK-4)組成[10,11]。1998年,Glinka等首次在兩棲動物非洲蟾蜍胚胎頭部發育的誘導機制中發現、克隆并定義了DKK1及其家族。DKK1是DKK家族中被研究最多的成員。研究發現,人類DKK1基因位于10號染色體10q11,約3.5 kb,由266個氨基酸組成的分泌型糖蛋白[12]。DKK1結構包含兩個保守的半胱氨酸區域,輔脂肪酶折疊區域可與膜受體LRP5/6及另一類穿膜蛋白Kremen1/2結合形成三聚體、內吞,阻斷Wnt-Frizzled-LRP5/6復合物形成,進而促進胞內信號分子β-catenin磷酸化,使其泛素化,在胞質內被水解,阻斷β-catenin進入細胞核與轉錄因子TCF、LCF結合,起到負性調節Wnt信號通路的作用[13]。Wnt信號通路在神經發生、神經可塑性中起重要作用,并且與記憶學習功能關系密切,Wnt通路的異常可能是認知損傷的潛在發生機制[14,15]。研究發現,DKK1基因可能作為各種刺激誘導細胞凋亡的重要介質,參與該機制的調控[16]。DKK1基因啟動子包含1個p53應答元件,誘導DKK1基因的表達[17]。此外,紫外線和化學治療劑引起的基因毒性增強了DKK1基因表達,DKK1基因使神經膠質瘤細胞對神經酰胺誘導的細胞凋亡敏感。本課題組前期亦發現DKK1基因可降低PC12細胞活性、促進PC12細胞凋亡[18]。目前未見類似DKK1過表達重組慢病毒轉染PC12細胞的研究報道。
近期研究發現,DKK1基因與許多中樞神經系統疾病的神經退化有關,包括AD、腦缺血和顳葉癲癇等。在細胞和動物的興奮毒性、β淀粉樣毒性、短暫性腦缺血和誘發癲癇的動物模型中DKK1基因的產生早于神經元退化[19]。隨著人們對DKK1基因在神經精神疾病中所起作用認識的深入,以DKK1基因為靶點的機制研究不斷增加。使用慢病毒作為載體可以提高病毒轉染效率,具有獲得病毒周期短、滴度高的優點,實現了在細胞中長期穩定表達。本實驗通過三質粒系統構建高表達GV358-DKK1的慢病毒載體,用適當濃度病毒液感染PC12細胞,嘌呤霉素連篩2周后熒光顯微鏡下均見綠色熒光,說明GV358-DKK1成功感染PC12細胞。隨后證實DKK1 mRNA及蛋白相對表達量均提高,進一步說明本實驗成功獲得DKK1基因高表達PC12細胞株。為后續探討DKK1基因的功能、特性及在神經精神疾病中的作用提供理想的細胞模型。
[1] De Robertis EM, Kuroda H. Dorsal-ventral patterning and neural induction in Xenopus embryos[J]. Annu Rev Cell Dev Biol, 2004,20:285-308.
[2] Choi HJ, Park H, Lee HW, et al. The Wnt pathway and the roles for its antagonists, DKKS, in angiogenesis[J]. IUBMB Life, 2012,64(9):724-731.
[3] Seib DR, Corsini NS, Ellwanger K, et al. Loss of Dickkopf-1 restores neurogenesis in old age and counteracts cognitive decline[J]. Cell Stem Cell, 2013,12(2):204-214.
[4] Gould TD, Dow ER, O′Donnell KC, et al. Targeting signal transduction pathways in the treatment of mood disorders: recent insights into the relevance of the Wnt pathway[J]. CNS Neurol Disord Drug Targets, 2007,6(3):193-204.
[5] Vallee A, Lecarpentier Y. Alzheimer disease: crosstalk between the canonical Wnt/Beta-Catenin pathway and PPARs alpha and gamma[J]. Front Neurosci, 2016,10:459.
[6] Wan W, Xia S, Kalionis B, et al. The role of Wnt signaling in the development of Alzheimer′s disease: a potential therapeutic target[J]. Biomed Res Int, 2014,2014:301575.
[7] Wang X, Luo E, Bi R, et al. Wnt/beta-catenin signaling is required for distraction osteogenesis in rats[J]. Connect Tissue Res, 2017,1:1-10.
[8] Mazon M, Masi D, Carreau M. Modulating dickkopf-1: a strategy to monitor or treat cancer[J]. Cancers(Basel), 2016,8(7):62.
[9] Mao QQ, Zhong XM, Li ZY, et al. Paeoniflorin protects against NMDA-induced neurotoxicity in PC12 cells via Ca2+antagonism[J]. Phytother Res, 2011,25(5):681-685.
[10] Glinka A, Wu W, Delius H, et al. Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction[J]. Nature, 1998,391(6665):357-362.
[11] Krupnik VE, Sharp JD, Jiang C, et al. Functional and structural diversity of the human Dickkopf gene family[J]. Gene, 1999,238(2):301-313.
[12] Fedi P, Bafico A, Nieto Soria A, et al. Isolation and biochemical characterization of the human Dkk-1 homologue, a novel inhibitor of mammalian Wnt signaling[J]. J Biol Chem, 1999,274(27):19465-19472.
[13] Menezes ME, Devine DJ, Shevde LA, et al. Dickkopf1: a tumor suppressor or metastasis promoter[J]. Int J Cancer, 2012,130(7):1477-1483.
[14] Cerpa W, Gambrill A, Inestrosa NC, et al. Regulation of NMDA-receptor synaptic transmission by Wnt signaling[J]. J Neurosci, 2011,31(26):9466-9471.
[15] Pan YY, Deng Y, Xie S, et al. Altered Wnt signaling pathway in cognitive impairment caused by chronic intermittent hypoxia: focus on glycogen synthase Kinase-3beta and beta-catenin[J]. Chin Med J(Engl), 2016,129(7):838-845.
[16] Kawano Y, Kypta R. Secreted antagonists of the Wnt signalling pathway[J]. J Cell Sci, 2003,116(Pt 13):2627-2634.
[17] Wang J, Shou J, Chen X. Dickkopf-1, an inhibitor of the Wnt signaling pathway, is induced by p53[J]. Oncogene, 2000,19(14):1843-1848.
[18] Zhang CY, Chen R, Wang F, et al. EGb-761 attenuates the anti-proliferative activity of fluoride via DDK1 in PC-12 cells[J]. Neurochem Res, 2017,42(2):606-614.
[19] Caraci F, Busceti C, Biagioni F, et al. The Wnt antagonist, Dickkopf-1, as a target for the treatment of neurodegenerative disorders[J]. Neurochem Res, 2008,33(12):2401-2406.

