EI注射液對鵝膏蕈氨酸基底核微量注射癡呆模型大鼠ATP/AMP及PI3K/AKT信號通路的影響*
夏 鵬,鄭 航,秦莉霞,魏江平,高麗娟,申重陽,徐世軍**
(1.成都中醫藥大學藥學院 成都 611137;2.成都中醫藥大學中醫腦病藥物整合轉化研究所成都 611137;3.成都中醫藥大學基礎醫學院 成都 611137)
阿爾茨海默病(Alzheimer's Disease,AD)是老年癡呆的主要類型,其發病機制復雜、病理進程多變,面臨著治療和診斷的雙重挑戰。大量研究顯示AD發病過程中伴隨著明顯的葡萄糖利用率降低和胰島素抵抗,故本病有3型糖尿病之稱[1,2]。胰島素信號級聯參與AD病程多種病理過程[3],磷脂酰基醇3激酶/蛋白激酶B(Phosphatidyl alcohol kinase/protein kinase B,PI3K/AKT)信號通路作為胰島素代謝的關鍵信號通路,參與調節葡萄糖攝取[4]。大腦是人體的高耗能器官[5,6],基于其對能量的高需求及高敏感性,使得大腦很易受到缺血等外部損傷的危害[7]。葡萄糖是大腦重要的能量物質,主要通過三羧酸循環(Tricarboxylic Aic Cycle,TCA)等氧化分解代謝過程釋放三磷酸腺苷(Adenosine Triphosphate,ATP),為維持神經細胞、神經膠質細胞功能及腦穩態提供能量[6,8]。研究表明AD病理進程中伴隨著明顯的能量代謝障礙[9,10]。二磷酸腺苷(Adenosine Diphosphate,ADP)和 一 磷 酸 腺 苷(Adenosine Monophosphate,AMP)是ATP的代謝產物。ATP含量[11]、ADP/ATP 比值[12]、ATP/AMP[13]比值與葡萄糖代謝、AD病程密切相關[14]。EI注射液是一溫里藥活性成分制備而成的注射劑,前期預實驗顯示有一定的抗AD作用,但其對AD模型大鼠腦能量代謝的影響還未涉及。
1 材料
1.1 藥物與試劑
EI注射液活性成分,成都瑞特恩科技有限公司,批號:RL20140828;鵝膏蕈氨酸(IBO),Cayman,批號:14584;安理申,衛材(中國)藥業有限公司,批號:1511049;三磷酸腺苷二鈉(ATP),Sigma,批號:1001665433;二磷酸腺苷二鈉(ADP),Sigma,批號:1001726877;單磷酸腺苷二鈉(AMP),Sigma,批號:101606467;Rat Insulin 試劑盒,ExCell Bio,批號:21G286;PI3K 一抗,Cell Signaling Technology,批號:4257S;AKT一抗,Cell Signaling Technology批號:4685S;p-PI3K一抗,Cell Signaling Technology批號:4228S;p-AKT一抗,批號:4060S。
1.2 動物
SPF級,SD大鼠65只,雄性,體質量240-300 g,由成都達碩生物科技有限公司提供,許可證號:SCXK(川)2015-030,合格證號:51203500001591。
1.3 儀器
DW-5大鼠腦立體定位儀(成都泰盟);Etho Vision Morris水迷宮分析系統(荷蘭,Noldus);ODSHYPERSIL C18色譜柱(thermo);1260高效液相色譜儀(Agilent);3001酶標儀(thermo electron corporation);Champchemi 610Plus全自動多色熒光及化學發光凝膠成像系統(北京賽智創業科技有限公司)。
2 方法
2.1 動物造模與分組
根據文獻制備雙側基底核注射IBO擬癡呆模型[15]。假手術組除基底核注射無菌生理鹽水外,其他操作同造模。取造模大鼠32只,隨機分為模型組、安理申組(1.4 mg·kg-1)、EI高劑量組(2 mg·kg-1)、EI低劑量組(1 mg·kg-1),每組8只,取假手術大鼠8只為對照組。各組動物尾靜脈注射等體積相應藥物(2 mL·kg-1),假手術組和模型組動物給予等體積生理鹽水(2 mL·kg-1)。每天一次,連續8周。
2.2 學習記憶功能測定
給藥50天開始,進行Morris水迷宮檢測[16],期間繼續給藥。連續訓練5天,記錄各組動物逃避潛伏期,定向航行實驗結束24 h后撤去平臺,進行空間探索實驗,記錄各動物穿越平臺目標象限的時間、穿越平臺目標象限的次數、穿越平臺次數及穿越平臺區域次數。
2.3 海馬及大腦皮層剛果紅染色檢測
Morris水迷宮檢測后,處死大鼠。分離腦組織,10%多聚甲醛固定、脫水、包埋、5μm切片、染色,鏡下觀察海馬及皮層的神經細胞形態及Aβ沉積。
2.4 大鼠腦能量檢測
冰上分離腦組織,制樣、檢測腦組織ATP、ADP、AMP含量[17]。
2.5 腦組織胰島素含量的測定
胰島素檢測嚴格按照ELISA試劑盒說明書進行。
2.6 大鼠腦組織PI3K和AKT蛋白表達
取腦組織,制樣、凝膠電泳分離、轉膜、封閉、一抗4℃孵育過夜,TBST洗膜,二抗室溫孵育90 min,TBST洗膜。ECL化學發光顯色后分析各蛋白相對表達量。
2.7 統計學方法
數據以均數±標準差(xˉ±s)表示,Morris水迷宮逃避潛伏期用雙因素方差分析,其余符合正太分布數據采用單因素方差分析(one-way ANOVA),不符合正態分布的數據采用兩個獨立樣本t檢驗進行分析。
3 結果
3.1 EI注射液對IBO擬癡呆模型大鼠學習記憶功能的影響
隨著訓練天數的增加,各組動物逃避潛伏期均有不同程度的縮短(圖1)。與空白組相比,模型組動物逃避潛伏期明顯延長(F=32.92;P=0.0012),穿越平臺象限時間明顯縮短(P<0.05)、穿越平臺次數、穿越平臺區域次數明顯縮短(P<0.05);與模型組相比,EI注射液高劑量組逃避潛伏期明顯縮短(F=9.812;P=0.0203),EI注射液低劑量組逃避潛伏期明顯縮短(F=20.61;P=0.0039),穿越平臺象限時間顯著延長(P<0.05),穿越平臺次數和穿越平臺區域次數有增加趨勢但無統計學差異(P>0.05)。
3.2 EI注射液對IBO擬癡呆模型大鼠海馬組織病理學及Aβ斑塊沉積的影響
模型組動物海馬CA1區及皮質區均可見磚紅色染色深,β淀粉樣蛋白沉積分布廣泛,錐體細胞排列紊亂稀疏、細胞數量減少并伴隨細胞固縮;與模型組相比,EI注射液各劑量組海馬CA1區和皮質區磚紅色染色減輕,β淀粉樣蛋白沉積減少,錐體細胞排列整齊、細胞數量增加(圖2,圖3)。

圖1 EI注射液對IBO模型大鼠Morris水迷宮的影響
3.3 EI注射液對IBO擬癡呆模型大鼠腦ADP/ATP和ATP/AMP的影響
由圖4可知,與空白組比較,模型組動物腦組織ATP/AMP明顯降低(P<0.05);ADP/ATP無明顯趨勢;與模型組相比,EI注射液各劑量組ATP/AMP明顯升高(P<0.05),ADP/ATP無明顯趨勢。
3.4 EI注射液對IBO擬癡呆模型大鼠腦胰島素含量的影響
與空白組比較,模型組腦組織內胰島素含量明顯降低(P<0.05);與模型組相比,EI注射液各劑量組胰島素含量明顯增高(P<0.05)(圖5)。
3.5 EI注射液對IBO擬癡呆模型大鼠腦PI3K、AKT的影響
由圖5可知,與空白組比較,模型組腦PI3K和AKT蛋白呈低表達(P> 0.05);與模型組相比,EI注射液干預組腦組織內PI3K和AKT蛋白表達有激活趨勢(P>0.05)。
4 討論
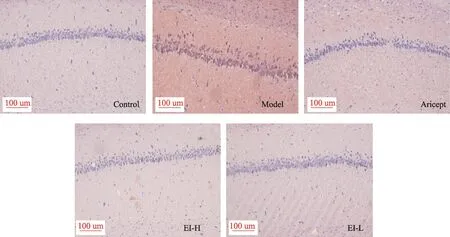
圖2 EI注射液對IBO模型大鼠海馬CA1區病理形態學的影響
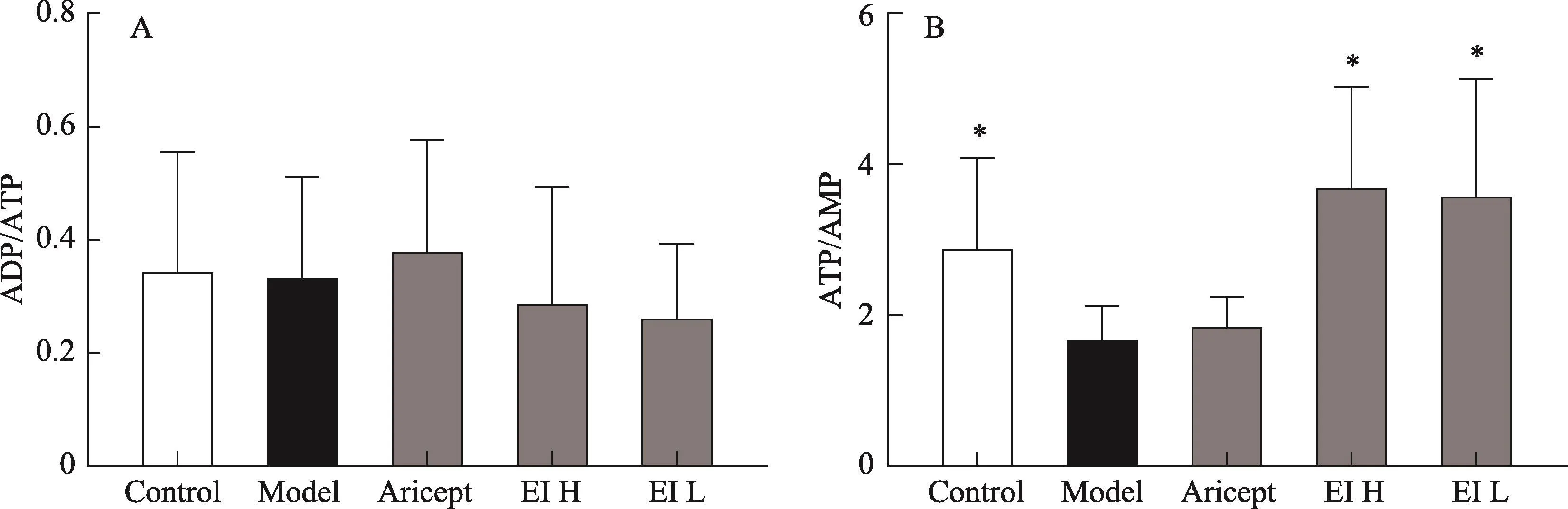
圖4 EI注射液對IBO模型大鼠腦ADP/ATP、ATP/AMP的影響
AD是主要的老年癡呆病癥,其發病機制除Aβ級聯假說、Tau蛋白假說、氧化應激等外,能量代謝障礙也扮演著重要角色。EI注射液是從某溫中中藥中提取的活性成分制備而成的注射劑。部分溫熱性中藥及其活性成分被報道可顯著改善多種疾病模型動物能量代謝障礙[18-21]。IBO是一種強烈的神經毒素,腦內注射可對大鼠造成嚴重的認知功能障礙等一系列擬AD病變[22],從而被應用于AD造模,本實驗結果也顯示該模型大鼠出現明顯的記憶障礙,而經EI注射液干預后其認知記憶障礙得到明顯改善。ATP是大腦的主要能量來源,主要由葡萄糖經TCA代謝提供[23]。胰島素是葡萄糖代謝的重要把控因子,研究發現AD病程中出現明顯的葡萄糖利用率降低和胰島素抵抗[24]。本實驗顯示IBO模型大鼠腦內胰島素含量、ATP/AMP比值顯著降低,提示能量代謝不足,經EI注射液干預后,該模型大鼠腦內胰島素、ATP/AMP比值顯著上調,提示EI注射液可調節該模型大鼠腦內能量代謝。PI3K/AKT信號通路是調節胰島素代謝的重要信號因子[4],同時研究顯示該信號通路參與調節認知功能障礙和突觸功能障礙等AD相關病程[25]。本實驗結果顯示IBO模型大鼠腦內PI3K/AKT蛋白表達呈抑制趨勢,但未見顯著統計學差異,提示EI注射液調節AD模型大鼠腦能量代謝可能與胰島素代謝其他機制相關,。綜上,本實驗結果顯示,EI注射液可改善IBO模型大鼠認知功能障礙,其可能機制與調節該模型大鼠腦內胰島素能量代謝有關,但其如何調節該AD模型大鼠腦能量代謝還有待后續進一步研究。
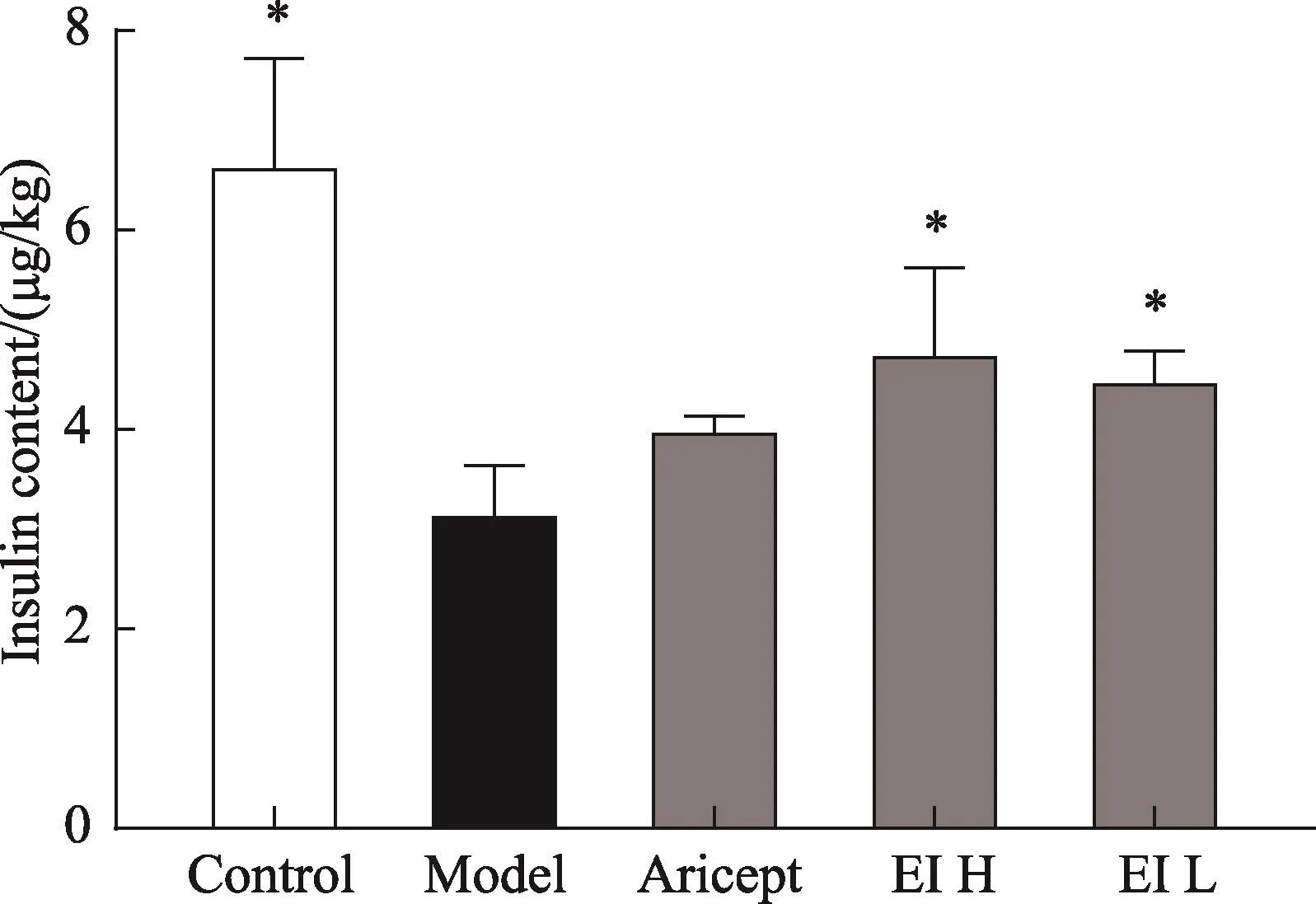
圖5 EI注射液對IBO模型大鼠腦胰島素含量的影響
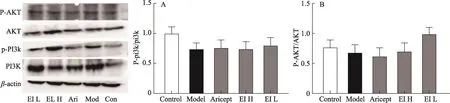
圖6 EI注射液對IBO模型大鼠腦PI3K/AKT信號通路的影響

