自主神經調節、血管舒張功能對高血壓患者血壓晝夜節律的影響
高珊,張樹龍,陳秀雯
(1大連醫科大學附屬第一醫院,遼寧大連116011;2大連大學附屬中山醫院)
隨著對高血壓研究的不斷深入,高血壓的防治已由原來的單純對血壓目標值的控制轉變為對高血壓患者血壓正常晝夜節律的調控,恢復正常的血壓節律已經成為評估高血壓降壓藥物的新指標。正常生理狀態下人體24 h血壓改變有明顯的晝夜節律性,呈勺型;但在一些病理條件下,高血壓患者血壓晝夜節律會發生異常改變,血壓晝夜呈非勺型。高血壓患者血壓節律紊亂會導致心臟、腦、腎臟等重要靶器官的損害,故控制血壓晝夜節律對高血壓治療、預后極其重要。高血壓患者血壓晝夜節律改變的影響因素較多,其中神經調節及血管舒張功能改變是兩個重要因素。本研究觀察了自主神經功能、血管舒張功能對高血壓患者血壓晝夜節律的影響,探討二者在高血壓患者血壓晝夜節律變化中的作用,為高血壓患者的血壓防治提供新方向。
1 資料與方法
1.1 臨床資料 選取高血壓患者220例,其中非勺型高血壓110例(夜間血壓下降<10%)、勺型高血壓110例(夜間血壓下降≥10%)。非勺型高血壓男59例、女51例,年齡(57.10±13.87)歲,血壓分級1級1例、2級9例、3級100例;勺型高血壓男61例、女49例,年齡(52.71±14.01)歲,血壓分級1級1例、2級7例、3級102例;兩者年齡相比P<0.05,血壓、血脂水平比較見表1。排除繼發性高血壓、急性心腦血管疾病、糖尿病慢性腎功能衰竭、慢性肝臟疾病、慢性肺病、中度或嚴重瓣膜疾病、先天性心臟病、起搏器置入、持續性房顫、左心室收縮功能障礙(射血分數<50%)的心力衰竭、急性冠脈綜合征、阻塞性睡眠呼吸暫停綜合征、甲狀腺功能嚴重障礙者。本研究經本院醫學倫理委員會批準,所有患者知情同意。

表1 非勺型、勺型高血壓患者血壓、血脂水平比較
注:SBP為收縮壓;DBP為舒張壓;TC為總膽固醇;TG為甘油三酯;LDL-C為低密度脂蛋白膽固醇。
1.2 自主神經調節功能測定 采用博英BI-9800型動態心電圖監測儀,監測指標包括24 h平均心率、24 h最快和最慢心率、24 h室性及室上性心律失常情況,在此基礎上進行心率變異指標分析。①時域指標:24 h竇性R-R間期的標準差(SDNN)、24 h內每5分時段竇性R-R間期標準差(SDANN)、24 h內全部竇性R-R間期差值的均方根值(RMSSD)、24 h內相鄰R-R間期相差>50 ms的心搏次數占所有總心搏次數的百分比(PNN50);②頻域指標:0.15~0.30 Hz的高頻功率譜(HF)、0.03~0.15 Hz的低頻功率譜(LF)、極低頻譜(VLF),以及LF/HF。佩戴及分析工作均由同一醫務工作者完成,囑咐受試者進行日常生活,避免劇烈運動,遠離磁場及電池輻射,監測時間不得少于24 h,有效記錄時間不少于90%。
1.3 血管內皮功能評價 應用日本UNEX EF38G檢測儀測定肱動脈血流介導的血管內皮舒張功能(FMD)。受試者在進食4 h后,安靜狀態避免情緒激動,在每天8:00~9:00同一固定時間測量,整個檢查過程受試者均應保持頭部和身體靜止。FMD=(最大擴張直徑-安靜直徑)/安靜直徑×100%。

2 結果
2.1 非勺型、勺型高血壓患者自主神經調節功能比較 見表2。
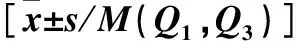
表2 非勺型、勺型高血壓患者自主神經調節功能比較
注:校正年齡。
2.2 非勺型、勺型高血壓患者血管舒張功能比較 非勺型、勺型高血壓患者FMD值分別為4.24%±1.57%、4.97%±1.95%,校正年齡后,兩者相比P<0.05。
2.3 自主神經調節、血管舒張功能與高血壓患者血壓晝夜節律的關系 以高血壓晝夜節律為反應變量,將單因素分析顯示有統計學意義的指標(SDNN、SDANN、FMD)為自變量進行多因素logistic回歸分析,自變量選擇采用向后逐步回歸分析方法。結果顯示,年齡(OR=1.023,95%CI:1.002~1.043,P<0.05)、SDANN(OR=1.990,95%CI:1.983~1.996,P<0.05)為非勺型高血壓獨立危險因素。
3 討論
高血壓晝夜節律受多種因素影響,年齡是不可抗拒的影響因素之一,年齡越大高血壓晝夜節律呈非勺型的概率越大[3]。研究[4]顯示,老年高血壓患者的自主神經調節功能存在一定程度的障礙,交感神經活性異常,去甲腎上腺素水平在血液中釋放增加,進而引起血壓晝夜節律的改變。本研究對比高血壓患者臨床資料發現,非勺型高血壓患者年齡明顯高于勺型高血壓患者,回歸分析也顯示年齡增長是非勺型血壓晝夜節律形成的獨立危險因素。這說明高血壓患者年齡越高,血壓呈非勺型節律的概率越大,心血管事件意外風險也進一步增加。其機制為高血壓患者的內分泌腺功能隨著年齡增加而逐漸衰弱,交感神經與副交感神經活性平衡也隨之發生紊亂;當壓力受體敏感性和副交感神經活性減弱時,血壓受自身機體調節能力就會下降,從而引起血壓進一步升高而導致血壓晝夜節律改變。近年來相關研究[5]發現,年齡是老年高血壓患者血壓晝夜節律紊亂甚至消失的重要影響因素,這與老年人睡眠時間減少、夜間多種體液神經調節機制紊亂有關,本研究與之相符。
心臟自主神經功能紊亂在原發性高血壓的發病過程中起著重要作用[6]。Montano等[7]的研究提示,交感神經張力過高可能參與高血壓發病的始動機制。自主神經調節異常不僅參與高血壓的發生發展,還可以影響血壓晝夜節律的改變。有研究[8]表明,高血壓非勺型組心率變異性指標低于勺型組,說明心臟自主神經功能紊亂可以導致血壓晝夜節律異常。自主神經調節不僅影響初期高血壓患者的血壓節律,也是長期高血壓和難治性高血壓患者血壓節律改變的重要影響因素。Salles等[9]將424例難治性高血壓患者進行了24 h動態血壓和動態心電圖監測,分析難治性高血壓患者不同血壓節律類型與心率變異指標的關系,結果顯示非勺型血壓者的心率變異性參數SDNN和SDANN較勺型者明顯降低,提示難治性高血壓患者心率變異指標下降,交感神經過度興奮導致夜間血壓下降減弱。本研究發現,非勺型高血壓患者心率變異性指標SDNN和SDANN較勺型高血壓患者降低,提示高血壓患者自主神經調節紊亂可能導致血壓節律異常改變。其原因是自主神經變化主要表現在交感神經和副交感神經的平衡調節,正常條件下,白天精神活動和體力活動增加引起交感神經興奮,血壓也較高;夜間睡眠時副交感神經興奮性增強,交感神經的張力下降,夜間血壓也會下降,血壓節律呈長柄勺型。但某些病理情況下,夜間交感神經興奮性增強,夜間血壓下降就會減弱,血壓節律呈非勺型改變[10,11]。這與上述結論相符合。梁薇芬等[12]對104例正常高值血壓者和40例健康者的血壓節律和FMD進行分析,發現正常高值血壓者FMD明顯小于對照組,提示其內皮功能減退;并且FMD分別與診室收縮壓、診室舒張壓呈負相關,說明血壓雖尚未達到高血壓診斷水平,但血壓水平增高將會導致血管內皮功能損害進一步加重。FMD正常值應>6,本研究顯示非勺型、勺型高血壓患者FMD降低,說明隨著血壓增加內皮功能損害增加,高血壓患者可能普遍存在血管內皮功能障礙,支持上述觀點。本研究發現,非勺型高血壓患者比勺型高血壓患者FMD明顯降低,說明血管內皮舒張功能影響高血壓晝夜節律改變,與上述觀點相符。
對于血壓晝夜節律的影響因素是獨立因素還是聯合因素的研究很少,本研究對影響高血壓血壓節律有統計學意義的指標進行分析,以高血壓晝夜節律為反應變量,以FMD、SDNN、SDANN為自變量進行多因素logistic回歸分析,結果表明SDNN是影響高血壓晝夜節律改變的獨立指標。表明血管內皮功能盡管在單因素分析中有統計學意義,但在多因素分析中無統計學意義,提示血管舒張功能可能受其他因素影響,共同影響高血壓晝夜節律,因而和自主神經調節不同,不是高血壓患者血壓晝夜節律改變的獨立危險因素。
[1] Salles GF, Ribeiro FM, Guimaraes GM, et al. A reduced heart rate variability is independently associated with a blunted nocturnal blood pressure fall in patients with resistant hypertension[J]. J Hypertens, 2014,32(3):644-651.
[2] Jelani QU, Norcliffe-Kaufman L, Kaufmann H, et al. Vascular endothelial function and blood pressure regulation in afferent autonomic failure[J]. Am J Hyperters, 2015,28(2):166-172.
[3] Minutolo R, Borrelli S, Chiodini P, et al. Effects of age on hypertensive status in patients with chronic kidney disease[J]. J Hypertens, 2007,25(11):2325-2333.
[4] Lee DH, Ihm SH, Youn HJ. Age is an independent risk factor fo rthe early morning blood pressure surge in patients never treated for hypension[J]. Korean Cire J, 2009,39(8):322-327.
[5] 彭軍,李娟.老年高血壓患者94例動態血壓的晝夜節律及變異性[J].中國老年學雜志,2011,31(12):4242-4243.
[6] Dauphinot V, Kossovsky MP, Gueyffier F. Impaired baroreflex sensitivity and the risks of new-onset ambulatory hypertension, in an elderly population-based study[J]. Int J Cardiol, 2013,168(4):4010-4014.
[7] Montano N, Porta A, Cogliati C. Heart rate variability explored in the frequency domain: a tool to investigate the link between heart and behavior[J]. Neurosci Biobehav Rev, 2009,33(2):71-80.
[8] Dauphinot V, Gosse P, Kossovsky MP. Autonomic nervous system activity is independently associated with the risk of shift in the non-dipper blood pressure pattern[J]. Hypertens Res, 2010,33(10):1032-1037.
[9] Salles GF, Ribeiro FM, Guimaraes GM, et al. A reduced heart rate variability is independently associated with a blunted nocturnal blood pressure fall in patients with resistant hypertension[J]. J Hypertens, 2014,32(3):644-651.
[10] Routlege FS, Hinderliter AL, McFetridge-Durdle J, et al. Endothelial functionin postmenopausal women with nighttime systole - lic hypertension[J]. Menopause, 2015,22(8):857-863.
[11] Zhang W, Wang Q, Wu Y, et al. Endothelial cell-specific liver kinase B1 deletion causes endothelial dysfunction and hypertension in mice in vivo[J]. J Circualtion, 2014,129(13):1428-1439.
[12] 梁薇芬,張賽丹.正常高值血壓者動脈血壓晝夜節律與血管內皮功能及頸動脈內膜中層厚度的關系[J].中華高血壓雜志,2012,20(2):167-170.

