胸腔鏡肺段切除及胸腔鏡輔助小切口、胸腔鏡肺葉切除治療早期肺癌的臨床觀察
程 鵬,于在誠△,謝琳琳
(1.安徽醫科大學第一附屬醫院普胸外科,合肥 230022;2.安徽醫學高等專科學校,合肥 230601)
目前肺癌已是發病率最高的惡性腫瘤[1]。因早期肺癌臨床癥狀較隱匿而容易延誤治療,預后5年生存率僅為16%[2]。得益于影像診療的不斷發展,臨床早期肺癌診斷率不斷提高,尤其是肺小結節及磨玻璃樣影的小病灶能被更早發現。手術對于肺癌仍然是治療首要選擇[3]。隨著微創理念的不斷推廣和腔鏡手術技巧不斷提高,胸腔鏡肺葉切除術已列入美國國立綜合癌癥網絡(NCCN)早期肺癌手術治療指南[4]。腔鏡手術本身具備小創傷、出血少、快恢復等優點,而且術中對淋巴結清掃亦符合規范化要求,治療效果等同于開胸手術[5]。對于肺癌合并長期煙齡及慢性基礎疾病的人群,術前心肺功能欠佳,肺葉切除術式會增加術后心肺并發癥風險。而早期肺癌肺段切除能否取得與肺葉切除一致的臨床療效尚存在爭議[6]。結合安徽醫科大學第一附屬醫院胸腔鏡肺癌手術的發展歷程,本次研究選取2013年1月至2016年6月120例早期肺癌手術治療患者作為研究對象,比較分析在早期肺癌患者中應用胸腔鏡輔助小切口、胸腔鏡肺葉切除及胸腔鏡肺段切除3種不同術式的圍術期指標和治療效果。
1 資料與方法
1.1一般資料 選取2013年1月至2016年6月120例早期肺癌手術治療患者作為研究對象,根據手術方法分為胸腔鏡輔助小切口肺葉切除術(A組)38例,男女比例為18∶20,平均年齡(69.1±3.9)歲;胸腔鏡下肺葉切除術(B組)42例,男女比例為22∶20,平均年齡(70.8±3.5)歲;全胸腔鏡下肺段切除術(C組)40例,男女比例為19∶21,平均年齡(70.1±3.2)歲;病變部位中,右肺63例,其中上中下肺葉分別為23例、15例、25例,左肺57例,其中上下肺葉分別為21例、26例;病理資料中,浸潤腺癌72例,鱗癌7例,腺鱗癌5例,非典型腺瘤樣增生7例,原位腺癌16例,微侵潤腺癌13例。三組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。本次研究經醫院倫理委員會批準并獲得患者知情同意。
1.2納入與排除標準
1.2.1納入標準 (1)依據NCCN肺癌的TNM分期標準,臨床分期為Ⅰa期患者;(2)患者術前評估無手術禁忌證;(3)所有患者術前未接受放化療等抗腫瘤措施;
1.2.2排除標準 (1)嚴重臟器功能異常或障礙者;(2)小細胞肺癌患者。
1.3方法 患者入手術室后均行雙腔氣管插管靜吸復合全身麻醉,健側臥位,肋部墊高,進胸后阻斷患側肺通氣。對于一些微小病灶進胸后結合術前高分辨CT及手指觸摸定位,三組病灶行術中冰凍病理檢查明確肺癌,術中均常規清掃淋巴結,右側清掃組數為2~4、 7~9、10~12組,左側清掃組數為4~9、10~12組。
A組患者在手術側腋中線第7肋間切開一長約2.0 cm切口,置入戳卡,作為腔鏡觀察孔,腔鏡探查胸膜腔,確定腫瘤組織的大小、位置及胸腔粘連情況,在同側腋前線第4肋間切開一長5~7 cm小切口,逐層進胸,小號撐開器固定拉大切口,腔鏡器械及常規器械在該切口一并使用。電刀與電鉤相結合游離粘連帶,將含有癌組織肺葉的肺靜脈、肺動脈和支氣管依次分離,采用傳統結扎及閉合器結合的方法予以切斷,常規清掃淋巴結;注水鼓肺檢查支氣管殘端無漏氣后,在腔鏡孔置入胸管關胸。
B組患者在手術側腋中線第7肋間切開一長約2.0 cm切口,置入戳卡,作為腔鏡觀察孔,腔鏡探查胸膜腔,確定腫瘤組織的大小、位置及胸腔粘連情況,分別在第4肋間和胸大肌后緣、背闊肌肌前緣做切口,直徑在4 cm,作為腔鏡主操作孔,在第7肋間做一個1.5 cm切口作為腔鏡副操作孔,顯露肺門組織結構,采用單一“由淺入深,由易至難,有粘連的結構最后處理”的解剖順序,游離顯露出肺葉血管及支氣管,使用Endo-GIA切割縫合器將其離斷。而對于一些肺裂發育不全的病例,術中肺血管的離斷順序可根據實際手術需要加以選擇,相關研究表明:肺血管處理順序不影響腫瘤復發、轉移和生存[7]。注水鼓肺檢查支氣管殘端無漏氣后,在退鏡前查看各切口有無出血,在腔鏡孔置入胸管關胸。
C組患者進胸過程及操作孔位置與B組相同,明確病灶所在肺段后,超聲刀與電鉤相結合解剖分離肺段動靜脈及段支氣管,細小血管推節器絲線結扎后離斷,段間動靜脈使用Endo-GIA 切割縫合器將其離斷。游離段支氣管后切割縫合器切斷,使用“膨肺萎陷法”用氬氣刀標注充氣無法萎陷的肺段界限,切割縫合器離斷其與余肺連接部,術中冰凍明確肺切緣距病灶大于或等于2 cm,注水鼓肺檢查支氣管殘端無漏氣后,在退鏡前查看各切口有無出血,在腔鏡孔置入胸管關胸。
1.4觀察指標 比較三組患者圍術期各項指標:手術時間、住院時間、術中出血量及術后胸腔引流量;記錄比較三組患者術后2個月肺功能各項指標:第1秒用力呼氣量(FEV1)、最大通氣量(MVV)、用力肺活量(FVC);比較三組患者術后并發癥:肺不張、肺部感染、心律失常、支氣管胸膜瘺的發生情況;比較三組患者15個月的中位隨訪期有無腫瘤復發和轉移情況。

2 結 果
2.1圍術期各項指標比較 B、C組在手術時間、住院時間、術中出血量及術后胸腔引流量較A組均降低(P<0.05),C組術后胸腔引流量低于B組(P<0.05)。見表1。

表1 三組患者手術觀察指標比較
*:P<0.05,與A組比較;#:P<0.05,與B組比較
2.2術前、術后3個月肺功能指標比較 A組術后3個月的MVV、FVC及FEV1低于B組和C組(P<0.05),而C組各項肺功能指標又高于B組(P<0.05)。見表2。
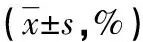
表2 三組患者術前、術后3個月肺功能指標比較
△:P<0.05,與同組術前比較;*:P<0.05,與A組術后3個月比較;#:與B組術后3個月比較,P<0.05
2.3術后并發癥發生情況比較 三組術后均未出現支氣管胸膜瘺,B、C組在術后肺部感染、肺不張及心律失常發生率低于A組(P<0.05),而C組并發癥發生率與B組差異無統計學意義(P>0.05)。見表3。
2.4預后情況比較 三組患者術后均定期復查,中位隨訪時間為15個月(12~18個月),均未發現復發和淋巴結及遠處血型轉移情況。

表3 三組術后并發癥發生情況比較[n(%)]
*:P<0.05,與A組比較;#:P>0.05,與B組比較;-:無數據
3 討 論
胸腔鏡因其切口對胸壁損傷小,恢復快,使得術后疼痛明顯減輕,對于心肺功能的保護優勢明顯[8]。目前胸腔鏡手術在臨床肺癌治療領域已廣為普及,而在術式方面,肺葉切除+系統性淋巴結清掃仍然被認為是肺癌的標準治療方案[9]。但對于臟器功能儲備減退的高齡早期肺癌患者,其術后并發癥發生率仍較高,胸腔鏡下肺段切除自1993年首次報道以來[10],采用該術式的肺癌治療相關研究不斷增多。有研究對85例Ⅰ期肺腺癌患者的研究報道亦表明肺段切除與肺葉切除在圍術期指標、術后并發癥發生率方面差異無統計學意義(P>0.05)[11]。本研究結果表明,肺段切除與肺葉切除在圍術期如手術時間、住院時間、術中出血量方面差異無統計學意義(P>0.05),肺段切除術后胸腔引流更少,可能與殘腔縮小滲出減少有關,提示手術安全性方面兩組一致,肺段切除組術后肺部并發癥發生率與肺葉切除組方面差異無統計學意義(P>0.05),但其單組發生率較肺葉切除組有下降趨勢,其差異不明顯,可能與樣本量有關,需進一步收集病例加以研究。
因肺葉切除降低了患者有效通氣量及氣體彌散面積,對于肺癌合并肺部基礎疾病的高齡患者胸腔鏡肺葉切除會增加術后心肺并發癥風險[12]。而肺段切除能最大限度地保留健康肺組織,對于術后降低肺功能的減損優勢明顯,對預防術后肺部并發癥如肺炎、肺不張等有積極意義,同時提高了術前肺功能欠佳患者的手術適應癥。本次研究中,肺段切除組術后肺功能各項指標FVC、MVV、FEV1均優于肺葉切除組,差異有統計學意義(P<0.05),說明肺段切除肺功能恢復更為迅速,大大改善了患者術后生活質量。
相較于肺葉切除,肺段切除對術者的解剖認知及手術技巧要求更高。因肺段內血管位置深且變異大,尤其是肺段內靜脈顯露不清時,可參照變異較少的段支氣管加以明確,而對于肺段血管的處理,尤其是注意避免誤傷其他肺段靜脈而引起的血液回流障礙,導致術后肺實變及咳血情況。明確切除肺段的界限也是術中關鍵,目前國內大部分相關病例報道采用夾閉段支氣管后膨肺,通過肺段間的充氣與萎陷來判斷切除范圍,但在膨肺過程中氣體仍可通過段間細支氣管及肺泡小孔將目標肺段膨起,而通過“膨肺萎陷法”即膨肺后再阻斷通氣,目標肺段因支氣管閉塞后無法像正常肺段塌陷,從而切除充氣的肺段提高目標肺段的精確性。
隨著人們對日常體檢的重視及影像診療技術的發展,以肺磨玻璃樣結節(GGO)代表的早期肺癌診斷率不斷提高。但對于肺段切除適應癥目前尚有爭議,主要分歧是對肺癌治療的預后判斷。參照2015年NCCN肺癌治療指南中的肺段切除適用標準[13],筆者認為肺段切除適用于浸潤性肺腺癌(T1N0M0)的非小細胞肺癌且直徑小于或等于2 cm,術中冰凍腫瘤切緣大于或等于2 cm,其段間、葉間淋巴結陰性及無法耐受肺葉切除的患者。其中肺癌切緣距離及淋巴結轉移情況直接影響其預后,而對于微小早期肺癌病理研究表明無明顯淋巴結轉移[14],使得早期肺癌肺段切除有著不亞于肺葉切除的生存預后,與本研究早期肺癌肺段切除療效相同。而受限于本次隨訪時間較短,肺段切除方式對于其術后腫瘤轉移及遠期生存率等臨床治療效果有待進一步研究探討。
綜上所述,對早期肺癌治療中,胸腔鏡肺段切除較肺葉切除能減少術后胸腔滲出,更好地保護肺功能,且生存預后無明顯差異,臨床療效值得肯定。
[1]黃佳,趙曉菁,林皓,等.單向四孔法全胸腔鏡肺葉切除術治療非小細胞肺癌的臨床研究[J].中國胸心血管外科臨床雜志,2012,19(2):125-129.
[2]焦鵬,李簡,佟宏峰,等.兩孔與三孔胸腔鏡肺葉切除、淋巴結清掃術治療肺癌的對比研究[J].腔鏡外科雜志,2015,20(9):684-688.
[3]LANG-LAZDUNSKI L.Surgery for non-small cell lung cancer[J].Eur Respir Rev,2013,129(22):382-404.
[4]丁仁泉,童向東,許世廣,等.達芬奇機器人手術系統與電視胸腔鏡手術與開胸手術治療縱膈腫瘤的臨床療效比較分析[J].中國肺癌雜志,2014,19(7):557-562.
[5]呂賓,胡德宏,盧恒孝,等.全胸腔鏡單向式肺葉切除在Ⅰ/Ⅱ期非小細胞肺癌治療中的臨床應用[J].中華腔鏡外科雜志,2012,5(1):46-49.
[6]VILLAMIZAR N,SWANSON S J.Lobectomy vs.segmentectomy for NSCLC(T<2 cm)[J].Ann Cardiothorac Surg,2014,3(2):160-166.
[7]姜冠潮,李鳳衛,李曉,等.全胸腔鏡肺葉切除術中肺動、靜脈切斷順序對早期非小細胞肺癌療效的影響[J].中華胸心血管外科雜志,2014,30(9):513-516.
[8]張艷嬌,高禹舜.肺癌胸腔鏡肺葉切除、胸腔鏡肺段切除與開胸肺葉切除術后對肺功能影響的研究[J].中國肺癌雜志,2016,19(10):700-704.
[9]韋詩友,趙珂嘉,郭成林,等.肺磨玻璃結節的外科診斷和治療分析——附663例報告[J].四川大學學報(醫學版),2017,48(3):359-362.
[10]胡牧,張毅,許慶生,等.早期非小細胞肺癌切除范圍的臨床研究[J].首都醫科大學學報,2016,37(6):763-766.
[11]TSUTANI Y,MIYATA Y,NAKAYAMA H,et al.Oncologic outcomes of segmentectomy compared with lobectomy for clinical stage IA lung adenocarcinoma:propensity score-matched analysis in a multicenter study[J] Thorac Cardiovasc Surg,2013,146(2):358-364.
[12]毛宇,郭偉,黎明,等.計劃性亞肺葉切除
術的肺功能的影響[J/CD].中華胸部外科電子雜志,2017,4(2):101-106.
[13]劉世學,王君,徐美清,等.全胸腔鏡下解剖學肺段切除41例臨床分析[J].中國微創外科雜志,2016,16(12):1127-1130.
[14]柴振達,陳志軍,竺王玉,等.原發性周圍型微小肺癌臨床特征及預后分析[J].浙江醫學雜志,2017,39(5):332-335.

