S100A6基因作用對宮頸癌細胞增殖遷移能力的影響及其機制
姚月榮,劉富群
(1盤錦職業(yè)技術(shù)學(xué)院,遼寧盤錦124010;2盤錦市中心醫(yī)院)
S100蛋白家族屬于鈣結(jié)合蛋白超家族,與鈣離子結(jié)合發(fā)生構(gòu)象改變暴露結(jié)合位點后,與靶蛋白結(jié)合并相互作用,在多種生理病理過程中發(fā)揮作用[1~4]。S100A6蛋白屬于S100蛋白家族的A家族,作為細胞內(nèi)蛋白,S100A6參與細胞內(nèi)多種生理病理過程,如增殖、凋亡以及細胞對各種細胞因子的應(yīng)答等。S100A6在不同腫瘤細胞中的表達水平并不一致,在胃癌、胰腺癌、結(jié)腸癌和黑色素瘤中,S100A6的表達是升高的,而在前列腺癌和口腔癌中S100A6的表達是降低的[5]。譚媛等[6]研究發(fā)現(xiàn),宮頸癌組織中S100A6表達上調(diào),且表達量與宮頸癌惡性程度、淋巴結(jié)轉(zhuǎn)移有關(guān)。但關(guān)于S100A6在宮頸癌細胞增殖、遷移過程中發(fā)揮的作用及其機制,目前少有報道。本研究用轉(zhuǎn)染S100A6真核表達載體的方法上調(diào)宮頸癌Hela細胞S100A6表達,用轉(zhuǎn)染S100A6小干擾RNA(siRNA)的方法下調(diào)宮頸癌CaSki細胞S100A6表達,觀察轉(zhuǎn)染后宮頸癌細胞增殖和遷移能力的變化,以及上皮間質(zhì)轉(zhuǎn)化(EMT)、PI3K-Akt信號通路相關(guān)蛋白表達的變化,探討上調(diào)或者下調(diào)宮頸癌細胞S100A6表達對宮頸癌細胞增殖和遷移能力產(chǎn)生影響的機制。現(xiàn)報告如下。
1 材料與方法
1.1 細胞來源及培養(yǎng) 人宮頸癌細胞系Hela、CaSki購自上海科學(xué)院細胞庫,培養(yǎng)于DMEM高糖培養(yǎng)基中(含10% FBS、10×104U/L青霉素、100 mg/L鏈霉素),37 ℃、5%CO2條件下培養(yǎng)。3~4 d傳代一次,傳代比例為1∶3;取復(fù)蘇后第4~10代的細胞進行相關(guān)實驗。
1.2 細胞分組及S100A6過表達載體、S100A6 siRNA轉(zhuǎn)染 從GeneBank中調(diào)取S100A6基因的編碼區(qū)(CDS)堿基序列(NM_014624.3),PCR擴增,經(jīng)BamH I和EcoR I酶切后,插入pcDNA3.0真核表達載體,經(jīng)酶切、PCR和測序鑒定,構(gòu)建pcDNA3.0-S100A6真核表達載體。將Hela細胞接種于6孔板,設(shè)觀察1組、對照1組及空白1組。觀察1組轉(zhuǎn)染pcDNA3.0-S100A6真核表達載體,對照1組轉(zhuǎn)染pcDNA3.0空載體質(zhì)粒,轉(zhuǎn)染試劑均為脂質(zhì)體Lipofectamine 3000(美國Thermo公司),空白1組不轉(zhuǎn)染。轉(zhuǎn)染時間為24 h。將CaSki細胞分為觀察2組、對照2組及空白2組。觀察2組轉(zhuǎn)染S100A6 siRNA,序列5′-GUGGCCAUCUUCCACAAGUTT-3′,對照2組轉(zhuǎn)染無關(guān)序列,轉(zhuǎn)染試劑均為脂質(zhì)體Lipofectamine 3000(美國Thermo公司),空白2組不轉(zhuǎn)染。轉(zhuǎn)染時間為24 h。
1.3 各組細胞S100A6 mRNA檢測 采用實時熒光定量PCR法。收集各組細胞并用胰酶消化,加入1 mL Trizol(美國Invitrogen公司)抽提細胞總RNA,按照試劑盒說明書操作。用紫外分光光度計(美國Thermo公司)檢測總RNA濃度及純度,逆轉(zhuǎn)錄試劑盒(大連寶生物工程有限公司)進行逆轉(zhuǎn)錄,cDNA產(chǎn)物置于-20oC保存?zhèn)溆谩100A6、內(nèi)參GAPDH的實時熒光定量PCR引物序列由南京金斯瑞生物科技公司合成。S100A6正向序列5′-ATGGCATGCCCCTGGATCAGG-3′,反向序列5′-TCAGCCCTTGAGGGCTTCAT-3′;GAPDH正向序列5′-CAGCGACACCCACTCCTC-3′,反向序列5′-TGAGGTCCACCACCCTGT-3′。用定量PCR擴增儀(ABI 7500,美國ABI公司)進行擴增并定量檢測S100A6mRNA表達量。實時熒光定量PCR擴增體系為10 μL,反應(yīng)條件:50 ℃ 2min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,進行35個循環(huán)。采用2-ΔΔCt表示S100A6 mRNA相對表達量。實驗重復(fù)3次,取平均值。
1.4 各組細胞穿膜細胞數(shù)檢測 于24孔板中放置Transwell小室,在24孔板下室中加入500 μL含10%FBS的DMEM高糖培養(yǎng)液,Transwell小室中加入100 μL各組細胞懸液(細胞總數(shù)約1×105個);48 h后去除24孔板下室中的培養(yǎng)液,棉簽擦去Transwell小室內(nèi)室膜上的細胞,0.1%結(jié)晶紫溶液染色,室溫放置5 min后顯微鏡下觀察,每孔隨機選取3個視野拍照,記錄每個視野的穿膜細胞數(shù)。實驗重復(fù)3次,取平均值。
1.5 各組細胞EMT、PI3K-Akt信號通路相關(guān)蛋白檢測 采用Western blotting法。收集各組轉(zhuǎn)染24 h的細胞2~5×105個,加入RIPA蛋白裂解液(上海碧云天生物技術(shù)有限公司)抽提細胞全蛋白,BCA蛋白定量試劑盒(美國Thermo公司)檢測蛋白濃度。10% SDS-PAGE膠電泳分加入一抗4 ℃孵育過夜。TBS-T洗膜后,分別加入相應(yīng)的HRP標記的羊抗兔或者兔抗鼠二抗(上海玉博生物科技有限公司,1∶10 000稀釋),室溫孵育1 h,加ECL發(fā)光液(美國Millipore公司)進行化學(xué)發(fā)光顯影,用凝膠成像儀(GelDoc-It,美國UVP公司)對蛋白條帶進行觀察獲取圖像,并對圖像進行灰度分析(Image Lab軟件)。EMT相關(guān)蛋白檢測E-cadherin蛋白和N-cadherin蛋白。PI3K-Akt信號通路相關(guān)蛋白檢測p-AKT、t-AKT及下游Snail、Twist蛋白。實驗重復(fù)3次,取平均值。
1.6 各組細胞增殖情況觀察 將轉(zhuǎn)染后細胞接種于96孔板中,每孔接種(0.8~1.0)×104個細胞,每組3個孔,繼續(xù)培養(yǎng)24、48、72 h。棄去上清,加入細胞計數(shù)試劑盒CCK-8試劑繼續(xù)培養(yǎng)4 h,測定450 nm波長處吸光度值(OD450)。實驗重復(fù)3次,取平均值。
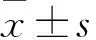
2 結(jié)果
2.1 各組細胞S100A6 mRNA相對表達量比較 轉(zhuǎn)染24 h觀察1組、對照1組、空白1組Hela細胞S100A6 mRNA相對表達量分別為3.87±0.86、1.04±0.08、0.97±0.11,觀察1組Hela細胞S100A6 mRNA相對表達量與對照1組和空白1組相比,P均<0.05;觀察2組、對照2組、空白2組CaSki細胞S100A6 mRNA相對表達量分別為0.43±0.07、1.12±0.09、0.98±0.12,觀察2組CaSki細胞S100A6 mRNA相對表達量與對照2組和空白2組相比,P均<0.05。
2.2 各組穿膜細胞數(shù)比較 轉(zhuǎn)染24 h行細胞遷移實驗,觀察1組、對照1組、空白1組穿膜細胞數(shù)分別為(48.26±4.89)、(21.31±4.27)、(20.12±6.23)個,觀察1組穿膜細胞數(shù)與對照1組和空白1組相比,P均<0.05;觀察2組、對照2組、空白2組穿膜細胞數(shù)分別為(81.36±8.33)、(147.49±6.98)、(142.23±9.16)個,觀察2組穿膜細胞數(shù)與對照2組和空白2組相比,P均<0.05。
2.3 各組細胞E-cadherin、N-cadherin、p-AKT、t-AKT、Snail、Twist蛋白表達量比較 觀察1組、對照1組、空白1組細胞E-cadherin、N-cadherin、p-AKT、t-AKT、Snail、Twist蛋白表達量見表1,觀察2組、對照2組、空白2組細胞E-cadherin、N-cadherin、p-AKT、t-AKT、Snail、Twist蛋白表達量見表2。與對照1組和空白1組相比,觀察1組Hela細胞E-cadherin蛋白表達量較低(P均<0.05),N-cadherin、p-AKT、Snail、Twist蛋白表達量較高(P均<0.05),但三組t-AKT蛋白表達量相比P均>0.05;與對照2組和空白2組相比,觀察2組CaSki細胞E-cadherin蛋白表達量較高(P均<0.05),N-cadherin、p-AKT、Snail、Twist蛋白表達量較低(P均<0.05),但三組t-AKT蛋白表達量相比P均>0.05。

表1 轉(zhuǎn)染24 h后觀察1組、對照1組、空白1組細胞E-cadherin、N-cadherin、p-AKT、t-AKT、Snail、Twist蛋白表達量比較
注:與對照1組和空白1組相比,*P<0.05。

表2 轉(zhuǎn)染24 h后觀察2組、對照2組、空白2組細胞E-cadherin、N-cadherin、p-AKT、t-AKT、Snail、Twist蛋白表達量比較
注:與對照2組和空白2組相比,*P<0.05。
2.4 各組細胞繼續(xù)培養(yǎng)24、48、72 h后OD450比較 轉(zhuǎn)染24 h后繼續(xù)培養(yǎng)24、48 h,觀察1組、對照1組、空白1組Hela細胞OD450相比P均>0.05;繼續(xù)培養(yǎng)72 h,觀察1組Hela細胞OD450高于空載體組和空白對照組(P均<0.05)。詳見表3。轉(zhuǎn)染24 h后繼續(xù)培養(yǎng)24、48 h,觀察2組、對照2組、空白2組CaSki細胞OD450相比,P均>0.05。繼續(xù)培養(yǎng)72 h,觀察2組CaSki細胞OD450低于對照2組和空白2組(P均<0.05)。詳見表4。

表3 繼續(xù)培養(yǎng)24、48、72 h觀察1組、對照1組、空白1組OD450比較
注:與對照1組、空白1組相比,*P<0.05。

表4 繼續(xù)培養(yǎng)24、48、72 h觀察2組、對照2組、空白2組OD450比較
注:與對照2組、空白2組相比,*P<0.05。
3 討論
S100A6基因定位于染色體1q21,是腫瘤細胞中頻繁出現(xiàn)染色質(zhì)重組的位點。S100A6基因最早發(fā)現(xiàn)于嚙齒類動物的成纖維細胞中,發(fā)揮多種生物學(xué)功能,如參與細胞增殖凋亡調(diào)控、調(diào)節(jié)酶活性、調(diào)控蛋白質(zhì)磷酸化和維持細胞內(nèi)鈣穩(wěn)態(tài)等[7]。
在心肌疾病[8]和多種腫瘤細胞中,S100A6表達是升高的,但是導(dǎo)致S100A6升高的原因并沒有被完全闡明。多種轉(zhuǎn)錄調(diào)節(jié)因子參與調(diào)節(jié)S100A6基因啟動子活性[9, 10]。在胰腺癌、胃癌、前列腺癌、黑色素瘤、非小細胞肺癌和肝癌中,S100A6常常被用作診斷和預(yù)后的生物學(xué)分子。在甲狀腺癌中,S100A6表達增加并且在乳突型甲狀腺癌的發(fā)生和發(fā)展過程中發(fā)揮關(guān)鍵性作用[11]。宮頸癌細胞中S100A6在Hela細胞中低表達,而在CaSki細胞中高表達。故本研究選用Hela細胞觀察過表達S100A6對宮頸癌細胞的影響,選用CaSki細胞細胞觀察沉默S100A6對宮頸癌細胞的影響。結(jié)果顯示,在Hela細胞中過量S100A6蛋白后,能夠增強Hela細胞的增殖和遷移能力;采用siRNA片段干擾CaSki細胞中S100A6基因表達,可以使細胞的增殖能力和遷移能力均下降。表明S100A6蛋白參與了宮頸癌細胞增殖和遷移的調(diào)控。
近年來的研究證實,EMT是腫瘤轉(zhuǎn)移的關(guān)鍵步驟,涉及多個信號轉(zhuǎn)導(dǎo)通路和分子機制,包括鈣連接素、轉(zhuǎn)錄調(diào)節(jié)因子、生長因子、微環(huán)境等。腫瘤細胞發(fā)生EMT的典型特點是上皮細胞表型缺失,其上皮標志蛋白E-cadherin的表達降低,失去極性,并且表現(xiàn)出間質(zhì)細胞的特性,同時間質(zhì)標志蛋白N-cadherin表達增加。本研究中結(jié)果顯示,使用S100A6真核表達質(zhì)粒使Hela細胞中S100A6蛋白表達增加后,細胞內(nèi)EMT相關(guān)蛋白E-cadherin表達下降、N-cadherin表達增加。通過轉(zhuǎn)染S100A6 siRNA降低CaSki細胞中S100A6基因表達后,細胞中E-cadherin表達增加、N-cadherin表達下降,以上實驗結(jié)果表明,在宮頸癌細胞中S100A6基因表達能夠促進細胞EMT,進而促進腫瘤轉(zhuǎn)移。
有關(guān)S100A6參與腫瘤細胞增殖、遷移調(diào)控機制的相關(guān)研究較多。在胃癌細胞中,S100A6能夠通過干擾β-catenin的蛋白降解過程,負調(diào)控CacyBP/SIP介導(dǎo)的抑制細胞增殖和腫瘤形成作用,進而促進胃癌發(fā)生發(fā)展[13],此外,S100A6能夠促進胰腺導(dǎo)管腺癌細胞遷移和侵襲,并且通過激活β-catenin促進EMT[14]。在腎臟細胞癌中,S100A6表達增加后能夠抑制抗腫瘤趨化因子CXCL14的表達以及CXCL14誘導(dǎo)的細胞凋亡,從而促進細胞存活[15]。陸文銓等[16]采用基因沉默技術(shù)干擾食管癌細胞Eca109中S100A6基因表達后,細胞的增殖活性和遷移能力均明顯被抑制。在人骨肉瘤細胞143B中,有學(xué)者用重組人S100A6蛋白(rhS100A6)與PI3K抑制劑(LY294002和wortmannin)單獨或者同時培養(yǎng)細胞后,發(fā)現(xiàn)rhS100A6能顯著增強143B細胞的增殖和遷移能力,而PI3K抑制劑則能夠部分逆轉(zhuǎn)此效果,證實S100A6促進人骨肉瘤細胞143B增殖和遷移的作用,至少部分是通過激活PI3K/Akt信號通路實現(xiàn)的。本研究結(jié)果顯示,在Hela細胞中增加S100A6蛋白表達后,細胞中的p-Akt蛋白表達量也顯著增加。Akt磷酸化是激活PI3K/Akt信號通路的關(guān)鍵步驟。這說明S100A6能夠激活宮頸癌細胞中的PI3K/Akt信號通路。本研究還發(fā)現(xiàn)PI3K/Akt信號通路的下游靶基因Snail和Twist的蛋白表達水平也有不同程度的升高;下調(diào)CaSki細胞中S100A6表達后,各蛋白表達量變化向相反方向進行。這進一步證實了PI3K/Akt信號通路在S100A6過量表達后被激活。。
綜上所述,S100A6能夠促進宮頸癌細胞的增殖和遷移過程,這可能是可能是通過激活細胞PI3K/Akt信號通路進而促進細胞EMT實現(xiàn)的。這為進一步闡明S100A6在宮頸癌發(fā)生發(fā)展中的機制提供了實驗依據(jù)。S100A6有可能是宮頸癌診斷和治療的潛在靶標。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Wardak S. Human Papillomavirus (HPV) and cervical cancer[J]. Med Dosw Mikrobiol, 2016,68(1):73-84.
[3] Luvero D, Plotti F, Lopez S, et al. Antiangiogenics and immunotherapies in cervical cancer: an update and future′s view[J]. Med Oncol, 2017,34(6):115.
[4] Donato R, Cannon BR, Sorci G, et al. Functions of S100 proteins[J]. Curr Mol Med, 2013,13(1):24-57.
[5] Chen H, Xu C, Jin Q, et al. S100 protein family in human cancer[J]. Am J Cancer Res, 2014,4(2):89-115.
[6] 譚媛, 姚德生. S100A6在宮頸癌組織中的表達及其意義[J].中國現(xiàn)代醫(yī)生,2010,48(11):9-10.
[7] Leoniak W, Suomnicki P, Filipek A. S100A6 - new facts and features[J]. Biochem Biophys Res Commun, 2009,390(4):1087-1092.
[8] Tsoporis JN, Marks A, Haddad A, et al. S100A6 is a negative regulator of the induction of cardiac genes by trophic stimuli in cultured rat myocytes[J]. Exp Cell Res, 2005,303(2):471-481.
[9] Thaisuchat H, Baumann M, Pontiller J, et al. Identification of a novel temperature sensitive promoter in CHO cells[J]. BMC Biotechnol, 2011,11(7):51.
[10] Króliczak W, Pietrzak M, Puzianowska-Kuznicka M. P53-dependent suppression of the human calcyclin gene (S100A6): the role of Sp1 and of NFkappaB[J]. Acta Biochim Pol, 2008,55(3):559-570.
[11] Zhao M, Wang KJ, Tan Z, et al. Identification of potential therapeutic targets for papillary thyroid carcinoma by bioinformatics analysis[J]. Oncol Lett, 2016,11(1):51-58.
[12] Duan L, Wu R, Zou Z, et al. S100A6 stimulates proliferation and migration of colorectal carcinoma cells through activation of the MAPK pathways[J]. Int J Oncol, 2014,44(3):781-790.
[13] Ning X, Sun S, Zhang K, et al. S100A6 protein negatively regulates CacyBP/SIP-mediated inhibition of gastric cancer cell proliferation and tumorigenesis[J]. PLoS One, 2012,7(1):30185.
[14] Chen X, Liu X, Lang H, et al. S100 calcium-binding protein A6 promotes epithelial-mesenchymal transition through β-catenin in pancreatic cancer cell line[J].PLoS One,2015,10(3):0121319.
[15] Lyu XJ, Li HZ, Ma X, et al. Elevated S100A6 (Calcyclin) enhances tumorigenesis and suppresses CXCL14-induced apoptosis in clear cell renal cell carcinoma[J]. Oncotarget, 2015,6(9):6656-6669.
[16] 陸文銓, 邱彥, 龐濤, 等. S100A6基因沉默對人食管癌Eca109細胞增殖活性和遷移能力的影響[J].第二軍醫(yī)大學(xué)學(xué)報,2014,35(1):49-54.
[17] Yu JS, Cui W. Proliferation, survival and metabolism: the role of PI3K/AKT/mTOR signalling in pluripotency and cell fate determination[J]. Development, 2016,143(17):3050-3060.

