醛酮還原酶家族1成員B10過表達的宮頸癌細胞株Hela增殖、周期、侵襲和遷移觀察
曾元清,李佳,胡政,羅偉濠,王晴美,羅迪賢,
(1南方醫(yī)科大學,廣州510515;2郴州市第一人民醫(yī)院)
宮頸癌的擴散和轉移是宮頸癌致死的主要原因之一,在宮頸癌的轉移侵襲中,許多蛋白起重要作用[1,2]。醛酮還原酶家族1成員B10(AKR1B10)通過抑制乙酰輔酶A羧化酶α(ACCα)降解調(diào)控細胞脂質(zhì)代謝,進而調(diào)控乳腺癌細胞增殖[3, 4]。宮頸癌 Hela細胞正常情況不表達AKR1B10,AKR1B10過表達對宮頸癌細胞增殖、周期、侵襲和遷移的影響尚不明確。本研究觀察了AKR1B10過表達對宮頸癌 Hela細胞增殖、周期、侵襲和遷移的影響,探討將AKR1B10作為預防宮頸癌發(fā)生、侵襲和轉移靶標的可能性。現(xiàn)報告如下。
1 資料與方法
1.1 材料 Hela細胞株(中南大學湘雅醫(yī)學院饋贈),CO2培養(yǎng)箱(Thermo Scientific美國);倒置顯微鏡(Leica美國);流式細胞儀(Beckman Coulter 美國);酶標儀(Thermo Scientific 美國);Transwell(Corning 美國);MTT試劑盒(碧云天公司);凋亡試劑盒(碧云天公司);HRP標記山羊抗兔IgG(北京中杉金橋);HRP標記山羊抗鼠IgG(北京中杉金橋);MMP-2抗體(Abcam美國)、Vimentin抗體(Abcam美國)、β-actin(Abcam美國)、AKR1B10抗體(實驗室制備)。
1.2 細胞分組及AKR1B10過表達質(zhì)粒轉染 將AKR1B10 cDNA序列克隆到慢病毒表達載體pSIN-EF2-Sox2-Pur(以下簡稱pSIN-EF2)中,構建慢病毒載體pSIN-EF2/AKR1B10。用LipofectamineTM2000將表達載體pSIN-EF2/AKR1B10、包裝質(zhì)粒psPAX2和包膜質(zhì)粒pMD2.G共轉染到293T細胞進行病毒包裝,制備高滴度慢病毒載體系統(tǒng)。用pSIN-EF2/AKR1B10慢病毒載體系統(tǒng)感染Hela細胞,用嘌呤霉素篩選穩(wěn)定表達AKR1B10的細胞株Hela/AKR1B10,為觀察組。將pcDNA3.1(-)克隆到慢病毒表達載體pSIN-EF2-Sox2-Pur中,構建慢病毒載體pSIN-EF2/Vector,用LipofectamineTM2000將表達載體pSIN-EF2/Vector、包裝質(zhì)粒psPAX2和包膜質(zhì)粒pMD2.G共轉染到293T細胞進行病毒包裝,制備高滴度慢病毒載體系統(tǒng)。用pSIN-EF2/Vector慢病毒載體系統(tǒng)感染Hela細胞,用嘌呤霉素篩選穩(wěn)定的細胞株Hela/Vector,取Hela/Vector細胞為對照組。
1.3 兩組細胞增殖情況觀察
1.3.1 MTT法 接種兩組各5×103個對數(shù)期細胞于96孔板中,37 ℃、5% CO2培養(yǎng)24、48、72 h,然后每孔加入10 μL的MTT 溶液(5 mg/mL)避光繼續(xù)培養(yǎng)4 h。吸掉上清,每孔加150 μL DMSO,震蕩10 min,溶解結晶。用酶標儀在570 nm波長下測定吸光值(OD570),每組細胞設平行孔6個,取平均值。
1.3.2 克隆形成實驗 取對數(shù)期兩組細胞以每孔200個細胞密度分別接種于6孔板中,每隔3天換培養(yǎng)基,37℃、5% CO2培養(yǎng)2周。棄培養(yǎng)基,用PBS洗2次,用1 mL 4%多聚甲醛固定,然后用PBS洗2次,加1 mL的 0.1%結晶紫染色15 min,洗去染液,空氣干燥。觀察兩組細胞集落的大小和數(shù)量。
1.4 兩組細胞周期分別檢測 采用流式細胞術。取對數(shù)期兩組細胞接種于6 cm細胞培養(yǎng)皿中,37 ℃、5% CO2培養(yǎng)24 h,收集細胞,棄上清,用預冷的PBS洗細胞兩次,加入預冷的70%乙醇,4 ℃過夜,離心收集細胞,以1 mL的PBS洗一次,加入500 μL的PBS洗細胞一次,加入含50 μg/mL溴化乙錠(PI)、100 μg/mL RNase A的PBS共500 μL,4 ℃孵育30 min,用流式細胞儀和Modfit軟件測算細胞周期分布。
1.5 兩組細胞遷移情況觀察 接種兩組細胞各1×105個于24孔板中,37 ℃、5% CO2培養(yǎng)24 h,用200 μL移液槍頭劃痕,PBS洗細胞3次洗去劃下的細胞,加入無血清培養(yǎng)基,拍照,37 ℃、5% CO2培養(yǎng)24 h后再拍照1次。計算劃痕愈合百分比。劃痕愈合百分比=1-培養(yǎng)24小時劃痕面積/開始的劃痕面積×100%。
1.6 兩組細胞侵襲情況觀察 將Matrigel膠以無血清的DMEM培養(yǎng)基按1∶8稀釋,每個Transwell上室加入100 μL。取對數(shù)期兩組細胞按每孔100 μL無血清細胞懸液(1×105個)加入Transwell上室,同時在Transwell下室加入500 μL含10%FBS培養(yǎng)基,37℃、5% CO2培養(yǎng)48 h后取出,吸去Transwell上室多余液體,用PBS清洗兩次,用棉簽在上室中輕輕轉動,吸干水分并擦去膜內(nèi)側的細胞。在上室加入500 μL 4%多聚甲醛固定15 min,在上室加入500 μL的0.1%結晶紫染色15 min,吸去染色液,PBS洗3次,晾干后用顯微鏡觀察、拍照,并計數(shù)穿膜細胞數(shù)。
1.7 兩組AKR1B10、p53、基質(zhì)金屬蛋白酶2(MMP-2)、波形蛋白(Vimentin)檢測 采用Western blotting法。取對數(shù)期兩組細胞接種于6孔板中,培養(yǎng)到細胞密度80%左右,提取總蛋白,用BCA法測定蛋白濃度。取40 μg蛋白進行SDS-PAGE電泳,轉膜1.5 h,然后用5%脫脂牛奶封閉1 h,加一抗在4 ℃孵育過夜,第二天加二抗在室溫孵育1.5 h,顯影拍照。以β-actin為內(nèi)參照。目的蛋白表達量以目的蛋白條帶灰度值與β-actin條帶灰度值之比表示。
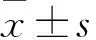
2 結果
2.1 兩組細胞AKR1B10蛋白表達量比較 觀察組、對照組細胞AKR1B10蛋白相對表達量分別為0.82±0.04、0,兩組相比,P<0.05。
2.2 兩組細胞增殖情況比較 MTT法測得繼續(xù)培養(yǎng)24、48、72 h各組細胞OD570見表1。由表1可見,繼續(xù)培養(yǎng)24、48、72 h觀察組細胞OD570均低于對照組(P均<0.05)。克隆形成實驗測得觀察組、對照組形成克隆個數(shù)分別為(125.2±5.3)、(174.7±6.0)個,兩組相比,P<0.05。

表1 繼續(xù)培養(yǎng)24、48、72 h兩組細胞OD570比較
注:與對照組相比,*P<0.05。
2.3 各組細胞周期分布比較 各組細胞周期分布見表2。由表2可見,與對照組相比,觀察組G0~G1期細胞比例上升(P<0.05),G2~M期和S期細胞比例下降(P均<0.05)。
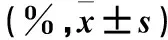
表2 兩組細胞周期分布比較
注:與對照組相比,*P<0.05。
2.4 兩組劃痕愈合百分比比較 觀察組、對照組劃痕愈合百分比為8.94%±2.09%、21.62%±1.44%,兩組相比,P<0.05。
2.5 兩組穿膜細胞數(shù)比較 觀察組、對照組穿膜細胞數(shù)分別為(29.2±2.0)、(57.0±3.2)個,兩組相比,P<0.05。
2.6 兩組細胞p53、MMP-2、Vimentin蛋白相對表達量比較 兩組細胞p53、MMP-2、Vimentin蛋白相對表達量見表3。觀察組p53蛋白相對表達量高于對照組(P<0.05),MMP-2、Vimentin蛋白相對表達量低于對照組(P均<0.05)。

表3 兩組細胞p53、MMP-2、Vimentin蛋白相對表達量比較
注:與對照組相比,*P<0.05。
3 討論
AKR1B10又叫醛糖還原酶相似蛋白(aARL-1),其編碼基因定位于染色體7q33區(qū)域,編碼一個由316個氨基酸殘基組成的蛋白質(zhì)[5]。AKR1B10不僅通過穩(wěn)定乙酰輔酶A羧化酶α,抑制其降解,調(diào)控細胞脂質(zhì)代謝和腫瘤細胞增殖,也可以通過還原羰基化合物,減少細胞變性,抑制腫瘤的發(fā)生,延緩腫瘤的發(fā)展[6]。AKR1B10在正常胃腸道上皮組織中高表達,其他正常組織低表達或者不表達;在乳腺癌、肝癌、非小細胞肺癌等腫瘤組織中高表達,但在胃腸道腫瘤如胃癌、食管癌、結腸癌等腫瘤組織中低表達或者不表達[6~11]。因此,AKR1B10是潛在的腫瘤診斷標志物和治療靶點。
Hela細胞系是被人乳頭瘤病毒(HPV)18型轉化的。本研究結果顯示,與對照組相比,觀察組過表達AKR1B10的Hela細胞OD570較低,克隆形成實驗克隆形成數(shù)量較少,說明細胞增殖受到明顯抑制。觀察組過表達AKR1B10的Hela細胞中G0~G1期細胞比例高于對照組,說明觀察組Hela細胞被阻滯于G0~G1期,這可能是觀察組細胞增殖活性低于對照組的直接原因。
HPV感染是導致女性宮頸癌發(fā)生的主要原因,超過 80% 的宮頸癌與 HPV 感染密切相關。HPV早期基因編碼的產(chǎn)物中,E6 蛋白具有高度致癌性[12, 13]。 正常情況下,p53 蛋白經(jīng)泛素化降解途徑進行降解。HPV 感染導致的宮頸癌細胞中,野生型p53 蛋白的降解主要由 E6 蛋白介導,E6 蛋白與 E6-AP 結合形成復合體( E6 /E6-AP) ,通過該復合體,p53 與活化的泛素連接,從而被降解[14~18]。p53快速降解而失去對細胞生長周期的正常調(diào)控,導致細胞無限增殖的惡性行為[16]。本研究結果顯示,觀察組過表達AKR1B10的Hela細胞中p53水平高于對照組,表明過表達AKR1B10可以提高宮頸癌Hela細胞中p53水平,恢復p53對細胞生長周期的正常調(diào)控,抑制宮頸癌Hela細胞的惡性增殖,這可能是觀察組細胞增殖活性低于對照組的原因之一。
本研究結果顯示,觀察組過表達AKR1B10的Hela細胞劃痕實驗劃痕愈合百分比低于對照組,侵襲實驗穿膜細胞數(shù)低于對照組,表明觀察組過表達AKR1B10的Hela細胞遷移和侵襲能力低于對照組。為探究其機制,本研究檢測了兩組細胞中MMP-2、Vimentin蛋白的表達。Vimentin調(diào)節(jié)蛋白骨架蛋白、細胞黏附分子等蛋白間的相互作用,參與腫瘤細胞、腫瘤相關內(nèi)皮細胞、巨噬細胞的黏附、遷移、侵襲和細胞信號傳導[19, 20]。MMP-2能降解細胞外基質(zhì)中的各種蛋白成分,破壞腫瘤細胞侵襲的組織學屏障,在腫瘤侵襲轉移中起關鍵性作用。本研究結果顯示,觀察組MMP-2、Vimentin蛋白相對表達量均低于對照組,表明AKR1B10可能通過MMP-2和Vimentin途徑調(diào)控宮頸癌Hela細胞的侵襲和遷移。綜上所述,AKR1B10在宮頸癌HeLa細胞異常增殖的過程當中扮演著負相調(diào)控作用。AKR1B10過表達可抑制宮頸癌Hela細胞增殖、侵襲和遷移,阻滯細胞周期于G0、G1期。AKR1B10可能是預防宮頸癌發(fā)生及侵襲轉移的作用靶標。
[1] Gialeli C, Theocharis AD, Karamanos NK. Roles of matrix metalloproteinases in cancer progression and their pharmacological targeting[J]. FEBS, 2011,278(1):16-27.
[2] Zhou JY, Zheng SR, Liu J, et al. MiR-519d facilitates the progression and metastasis of cervical cancer through direct targeting Smad7[J].Cancer Cell Int, 2016,16(1):21.
[3] Hara A, Endo S, Matsunaga T, et al. Inhibition of aldo-keto reductase family 1 member B10 by unsaturated fatty acids[J]. Archi Biochem Biophys,2016,(609):69-76.
[4] Ma J, Yan R, Zu X, et al. Aldo-keto reductase family 1 B10 affects fatty acid synthesis by regulating the stability of acetyl-CoA carboxylase-alpha in breast cancer cells[J]. J Biol Chem,2008,283(6):3418-3423.
[5] Cao D, Fan ST, Chung SS. Identification and characterization of a novel human aldose reductase-like gene[J].J Biol Chem , 1998,273(19):11429-11435.
[6] Zhong L, Liu Z, Yan R, et al. Aldo-keto reductase family 1 B10 protein detoxifies dietary and lipid-derived alpha, beta-unsaturated carbonyls at physiological levels[J]. Biochem Biophys Res Commun,2009,387(2):245-250.
[7] Fukumoto S, Yamauchi N, Moriguchi H, et al. Overexpression of the aldo-keto reductase family protein AKR1B10 is highly correlated with smokers' non-small cell lung carcinomas[J]. Clin Cancer Res, 2005,11(5):1776-1785.
[8] He YC, Shen Y, Cao Y, et al. Overexpression of AKR1B10 in nasopharyngeal carcinoma as a potential biomarker[J]. Cancer Biomarkers,2016,16(1):127-135.
[9] Ma J, Luo DX, Huang C, et al. AKR1B10 overexpression in breast cancer: association with tumor size, lymph node metastasis and patient survival and its potential as a novel serum marker[J]. Int J Cancer,2012,131(6):862-871.
[10] Sato S, Genda T, Ichida T, et al. Impact of aldo-keto reductase family 1 member B10 on the risk of hepatitis C virus-related hepatocellular carcinoma[J]. J Gastroentero Hepatol,2016,31(7):1315-1322.
[11] Zu X, Yan R, Pan J, et al. Aldo-keto reductase 1B10 protects human colon cells from DNA damage induced by electrophilic carbonyl compounds[J]. Mol Carcinog,2017,56(1):118-129.
[12] Cherry JJ, Rietz A, Malinkevich A, et al. Structure based identification and characterization of flavonoids that disrupt human papillomavirus-16 E6 function[J]. PLoS One, 2013,8(12):84506.
[13] Conesa-Zamora P, Domenech-Peris A, Orantes-Casado FJ, et al. Effect of human papillomavirus on cell cycle-related proteins p16, Ki-67, Cyclin D1, p53, and ProEx C in precursor lesions of cervical carcinoma: a tissue microarray study[J]. Am J Clin Pathol,2009,132(3):378-390.
[14] Kim JW, Cho YH, Lee CG, et al. Human papillomavirus infection and TP53 gene mutation in primary cervical carcinoma[J]. Acta Oncol, 1997,36(3):295-300.
[15] Hengstermann A, Linares LK, Ciechanover A, et al. Complete switch from Mdm2 to human papillomavirus E6-mediated degradation of p53 in cervical cancer cells[J]. Proc Natil Acad Sci USA, 2001,98(3):1218-1223.
[16] Sun L, Shen X, Liu Y, et al. The location of endogenous wild-type p53 protein in 293T and HEK293 cells expressing low-risk HPV-6E6 fusion protein with GFP[J]. Acta Biochim Biophys Sin,2010,42(3):230-235.
[17] Sima N, Wang W, Xu Q, et al. [Reversal effect of antisense RNA targeting human papillomavirus 16 (HPV16) E6E7 on malignancy of human cervical cancer cell line SiHa[J]. Aizheng,2007,26(7):26-31.
[18] Zhang R, Su J, Xue SL, et al. HPV E6/p53 mediated down-regulation of miR-34a inhibits Warburg effect through targeting LDHA in cervical cancer[J]. Am J cancer Res,2016,6(2):312-320.
[19] Maji D, Barnawal D, Gupta A, et al. A natural plant growth promoter calliterpenone from a plant Callicarpa macrophylla Vahl improves the plant growth promoting effects of plant growth promoting rhizobacteria (PGPRs)[J]. World J Biotechol, 2013,29(5):833-839.

