甘草酸二胺對腹膜透析患者腹膜功能及TGF-β1、VEGF、CTGF水平的影響
衛志鋒,王琳琳,馮季,楊文,王俊麗,賈倩,郝秀輕,劉圣君
(河北北方學院附屬第一醫院,河北張家口075000)
研究結果顯示,全球約有13萬腎病患者需行腹膜透析(PD)治療[1]。盡管PD可作為終末期腎病的重要治療手段,但近5年內臨床仍有超過50%的患者退出PD治療[2]。其主要原因為長期進行PD治療往往引起腹膜纖維化,而腹膜纖維化后易引發腹膜超濾衰竭[3]。研究發現,PD液與機體組織的相容性較差、治療過程中反復發作的腹膜炎是導致腹膜纖維化的主要原因[4]。研究發現,PD患者發生腹膜纖維化的關鍵介質主要包括轉化生長因子β1(TGF-β1)、血管內皮生長因子(VEGF)和結締組織生長因子(CTGF)[5]。PD患者腹腔中TGF-β1、VEGF和CTGF水平升高。甘草酸二胺是中藥甘草有效成分的第三代提取物,在結構上類似于醛固酮的類固醇環,可阻止可的松與醛固酮的滅活,發揮類固醇樣作用,且無皮質激素的不良反應,同時具有抗炎、保護細胞膜及抗纖維化的作用[6]。本研究以規律行PD的終末期腎病患者為研究對象,探討甘草酸二胺對PD患者腹膜功能及TGF-β1、VEGF、CTGF水平的影響,以期為臨床防治提供參考。
1 資料與方法
1.1 臨床資料 選取2009年6月~2016年6月本院腎內科收治的非糖尿病慢性腎病終末期患者96例,男47例、女49例,年齡33~70(54.31±7.16)歲,入院血尿素氮15.49~27.15(22.07±3.51)mmol/L、血肌酐426.07~764.57(588.50±64.16)μmol/L,透析年限(2.52±0.52)年;慢性腎小球腎炎33例,高血壓腎損傷26例,慢性間質性腎炎22例,其他13例。患者納入標準:年齡30~80歲;透析前符合2012年改善全球腎臟病預后組織制定的尿毒癥標準[7];行PD方案穩定3個月以上。排除標準:合并急性并發癥或其他嚴重疾病;紐約心臟病協會心功能分級Ⅲ~Ⅳ級;正在使用或停用激素不到1個月;嚴重感染未得到有效控制;腹部皮膚感染未愈。按照隨機數字表法將患者分為觀察組和對照組各48例,兩組臨床資料具有可比性。本研究患者和家屬知情并簽字,經本院倫理委員會批準通過。
1.2 PD方法 透析導管為百特公司Tenckhoff導管,PD液為Baxter公司產品。對照組給予規律持續性不臥床PD(CAPD),常規PD液2 000 mL保留腹腔4~6 h/次,4次/d;根據患者容量負荷調整PD方案,積極控制血壓、糾正貧血(補充鐵劑、葉酸及皮下注射促紅素)。觀察組CAPD方法同對照組,在此基礎上口服甘草酸二胺膠囊(正大天晴藥業集團股份有限公司)150 mg/次,3次/d。兩組均治療6個月。
1.3 腹膜功能檢測 采用腹膜平衡試驗(PET)。兩組治療6個月行PET[8]:PET前夜行CAPD治療,并使夜間PD液停留于腹腔中達8 h;患者取坐位,20 min內引流腹腔內的透析液,并檢測其容量;患者轉換體位為仰臥位,以200 mL/min的速度將37 ℃、2.5%葡萄糖透析液2 000 mL于10 min內注入腹腔,每注入400 mL,患者配合變換體位;分別于PD液滯留于腹腔內的第0、4小時收集PD液標本。于PD液滯留于腹腔內的第4小時采集兩組肘靜脈血5 mL,檢測透析液和血液中的尿素及透析液中的葡萄糖。患者于坐位20 min內排空PD液,并測定引流量,計算超濾量,超濾量=引流量-灌注量。計算PD 4 h PD液尿素濃度(Durea)與血漿尿素濃度(Purea)比值、PD 4 h PD液葡萄糖濃度(D4)與初始PD液葡萄糖濃度(D0)比值。
1.4 血漿及PD液中TGF-β1、VEGF及CTGF水平檢測 治療前及治療6個月采集兩組靜脈血標本及PD液標本(采集方法同1.3),分別以5 000 r/min離心10 min、以1 500 r/min離心5 min,留取血漿及PD液上清液。用ELISA試劑盒(武漢博士德生物科技有限公司)按其操作說明分別測定血漿及PD液中TGF-β1、VEGF、CTGF。
2 結果
2.1 兩組治療后腹膜功能比較 治療后觀察組超濾量、Durea/Purea高于對照組(P均<0.05),D4/D0低于對照組(P<0.05)。見表1。

表1 兩組治療后腹膜功能檢測指標比較
注:與對照組比較,*P<0.05。
2.2 兩組治療前后血漿與PD液中TGF-β1、VEGF、CTGF水平比較 治療前兩組血漿與PD液中TGF-β1、VEGF、CTGF水平比較差異無統計學意義(P均>0.05);治療后兩組血漿與PD液中TGF-β1、VEGF、CTGF水平均升高(P均<0.05),但對照組升高更明顯(P均<0.05)。見表2。
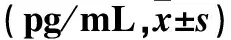
表2 兩組治療前后血漿與PD液中TGF-β1、VEGF、CTGF比較
注:與對照組治療后比較,*P<0.05。
3 討論
目前,PD是臨床慢性腎衰竭患者血液凈化的主要方式之一,其效果依賴于腹膜結構和功能的完整[9]。終末期腎病患者在長期的PD過程中往往發生腹膜進行性纖維化,從而影響腹膜功能,導致透析失敗。腹膜硬化的主要始動原因為高糖、高滲、酸性的透析液及糖基化產物造成的間皮細胞微炎癥反應,防治腹膜纖維化的關鍵是減輕腹膜微炎癥狀態。
甘草酸二銨是一種藥理活性較強的治療慢性肝炎的藥物。甘草酸二銨具有較強的抗炎、護肝及改善肝功能的作用[10]。本研究對照組給予CAPD,觀察組在此基礎上口服甘草酸二胺膠囊,治療6個月后,觀察組超濾量、Durea/Purea高于對照組,D4/D0低于對照組。腹膜微炎癥反應的結果是炎癥物質損傷腹膜毛細血管,升高了腹膜對葡萄糖等小分子物質的轉運率,加快了葡萄糖吸收的速度,無法長時間維持透析液的滲透壓濃度[11]。本研究觀察組D4/D0低于對照組,Durea/Purea高于對照組,可見觀察組腹膜對小分子物質轉運率降低,提示甘草酸二銨可使腹膜對小分子的通透性降低。透析6個月腹膜發生纖維化,濾過降低,但甘草酸二銨減緩了腹膜纖維化。
TGF-β1是近年來發現的一種具有多種生物學功能的細胞因子,具有免疫調節及促纖維化作用;與其受體結合,可促進纖維母細胞和平滑肌細胞的增殖,也可抑制上皮細胞的生長[12,13]。VEGF是血管內皮因子,可促進內皮細胞的增殖和遷移,增加腹膜新生血管的形成,使腹膜通透性增加和超濾功能衰竭,導致腹膜纖維化。CTGF作為前纖維化的標志,可誘導膠原沉積、促進細胞黏附及成纖維細胞增殖,從而引起腹膜纖維化[14,15]。研究表明,TGF-β1水平升高與腹膜纖維化的程度呈正相關,與腹膜功能呈負相關[16]。還有學者發現,在腹膜間皮細胞中,TGF-β1能誘導VEGF的表達,且VEGF的表達量與TGF-β1呈正相關,因而認為VEGF為TGF-β1的下游因子,但具體的分子調控機制有待于進一步研究[17]。此外,在原代培養的人腹膜間皮細胞、大鼠腹膜間皮細胞及人腹膜間皮細胞株中,TGF-β1可促進轉錄因子Smad 2和Smad 3磷酸化從而激活Smad信號通路調控CTGF的表達使CTGF的表達增加[18],繼而參與介導TGF-β1對間質細胞的作用,促進細胞外基質合成。總之,在腹膜慢性纖維化過程中,TGF-β1、VEGF、CTGF相互作用,互為因果。VEGF、CTGF受TGF-β1的正相調控,同時二者過表達又可增強TGF-β1傳導信號,形成復雜的網絡促進腹膜纖維化的發生發展,最終導致腹膜功能減弱甚至喪失。
本研究將甘草酸二銨應用于終末期腎病,結果發現,觀察組血漿與PD液上清中的TGF-β1、VEGF以及CTGF的升高幅度均較對照組小。說明甘草酸二銨可能抑制了TGF-β1的調控過程。
[1] Yu X, Yang X. Peritoneal dialysis in china: meeting the challenge of chronic kidney failure[J]. Am J Kidney Dis, 2015,65(1):147-151.
[2] 陳旭嬌,庹素馨,陶煜,等.終末期腎病腹膜透析患者退出治療危險因素分析[J].第二軍醫大學學報,2016,37(1):27-33.
[3] Kong YY, Xue ZQ, Yan GH. Dyslipidemia impact on ultrafiltration failure in peritoneal dialysis patients[J]. Med Innovation Chin, 2015,11(11):1295-1301.
[4] 吳旭.腹膜透析液對腹膜纖維化的影響[J].國際泌尿系統雜志,2012,32(3):400-403.
[5] 熊蘊珠,黃建鳴,張國楠.卵巢癌相關細胞因子的過表達及其在腫瘤微環境中作用的研究進展[J].腫瘤預防與治療,2014,27(1):39-42.
[6] 張英博,孟凡謀,張英慧,等.甘草酸二銨對肝纖維化實驗大鼠TGF-β/Smad信號轉導通路相關因子的影響[J].齊齊哈爾醫學院學報,2016,37(12):1509-1511.
[7] Danilo F, Maurice L, Adrian C, et al. A European Renal Best Practice (ERBP) position statement on the Kidney Disease Improving Global Outcomes (KDIGO) clinical practice guidelines on acute kidney injury: part 1: definitions, conservative management and contrast-induced nephropathy[J]. Nephrol Dial Transplant, 2012,27(12):4263-4272.
[8] 李俊英.簡化的腹膜平衡試驗在腹膜透析患者中的應用[J].護理實踐與研究,2016,13(6):49-50.
[9] 尹飛挺,俞雨生.腹膜透析治療的現狀及挑戰[J].腎臟病與透析腎移植雜志,2015,24(2):186-189.
[10] 劉艷麗,艾迎春.醛固酮受體拮抗劑聯合甘草酸二銨對大鼠肝纖維化進程的影響[J].黑龍江醫藥科學,2016, 39(4):22-25.
[11] 黃云劍,梁莉,王梓華,等.肝細胞生長因子對維持性腹膜透析患者腹膜微炎癥狀態及超濾量的影響[J].中國中西醫結合腎病雜志,2009,10(5):416-418.
[12] Sheppard D. Transforming growth factor β: a central modulator of pulmonary and airway inflammation and fibrosis[J]. Proc Am Thorac Soc, 2006,3(5): 413-417.
[13] Breitkopf K, Godoy P, Ciuclan L, et al. TGF-β/Smad signaling in the injured liver[J]. Z Gastroenterol, 2006,44(1):57-66.
[14] Tomino Y. Mechanisms and interventions in peritoneal fibrosis[J]. Clin Exp Nephrol, 2012,16(1):109-114.
[15] Sakai N, Nakamura M, Lipson KE, et al. Inhibition of CTGF ameliorates peritoneal fibrosis through suppression of fibroblast and myofibroblast accumulation and angiogenesis[J]. Sci Rep, 2017,7(1):5392.
[16] 張紅利,郝麗榮.TGF-β/Smad信號通路在腹膜纖維化發生、防治中的作用[J].醫學綜述,2013,19(7):1173-1175.
[17] 薛增奇,陳金春,虞旭光,等.阿托伐他汀鈣對維持腹膜透析患者腹膜功能、透析液VEGF、TGF-β1及血脂的影響[J].現代實用醫學,2014,26(6):740-742.
[18] 熊燕移,李敏芝,史偉文,等.烏司他丁對腹膜透析相關性腹膜纖維化大鼠細胞因子表達的影響[J].中華實用診斷與治療雜志,2016,30(8):747-749.

