LX007減少脂多糖介導的小膠質細胞內活性氧生成的機制研究
曹 翔, 金岳心子, 李 飛, 徐 運
小膠質細胞是腦組織中固有的巨噬細胞,對環(huán)境的變化十分敏感,在中樞神經系統(tǒng)的免疫反應中發(fā)揮重要作用[1,2]。生理條件下,小膠質細胞行使保護、支持、營養(yǎng)和修復等功能;而在病理條件下,小膠質細胞過度活化,通過釋放多種細胞因子如一氧化氮(nitric oxide,NO)、白細胞介素(interleukin,IL)、腫瘤壞死因子(tumor necrosis factor-α,TNF-α)和活性氧(reactive oxygen species,ROS)來發(fā)揮細胞毒效應,這些都是導致神經退行性疾病如阿爾茨海默病(Alzheimers disease,AD)、帕金森綜合征(Parkinson disease,PD)、多發(fā)性硬化(multiple sclerosis,MS)以及缺血性腦卒中(Cerebral ischemic stroke)進展的重要原因[3]。因此,調節(jié)小膠質細胞的功能狀態(tài)、抑制異常的激活,對于這類疾病的轉歸具有積極的作用。
我們的團隊在以往的研究中合成了一類N-芐基苯胺衍生物,通過一系列的體內、外實驗證實其具有腦缺血再灌注損傷的保護作用[4]。機制上是通過選擇性阻斷神經型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)與突觸后膜致密物-95(postsynaptic density protein 95,PSD-95)的偶聯(lián),抑制缺血后NO的病理性釋放,對缺血損傷相關疾病的治療具有重要意義。但這類化合物對小膠質細胞的激活是否具有直接的抑制效果還不清楚。在本研究中,我們利用原代小膠質細胞,探究此類化合物的一個新成員——4-[(5-溴-3-氯-2-羥基苯基)氨基]-2-羥基苯甲酸(命名為LX007,見圖1)對脂多糖(Lipopolysaccharide,LPS)誘導ROS生成的抑制作用,并初步探討其潛在機制。

圖1 LX007化學結構
1 材料和方法
1.1 試劑 LPS購自美國Sigma公司,DMEM培養(yǎng)基、青霉素-鏈霉素溶液購自Gibco公司,南美胎牛血清來自BI公司,CCK-8、活性氧檢測試劑盒購自碧云天公司,HO-1和Nrf2抗體購于Abcam公司,GAPDH抗體和細胞核質分離試劑盒購于巴傲得生物科技有限公司。
1.2 LX007的合成 反應釜內加入乙醇25 ml、5-溴-3-氯-2-羥基苯基 2.35 g和4-氨基-2-羥基苯甲酸1.53 g,攪拌并加熱回流30 min,之后停止反應,冷卻至室溫(22~25 ℃)析出紅色固體。于茄形瓶內加入乙醇25 ml,硼氫化鈉0.8 g以及制得的紅色固體,攪拌反應待溶液澄清后滴加水25 ml,有類白色物質析出,過濾后干燥得白色粉末LX007(2.8 g)。1HNMR (300 MHz,DMSO-d6):9.73(s,1H),8.92(s,1H),7.46(d,1H,J = 2.1 Hz),7.26(d,1H,J=2.1 Hz),6.83(t,1H,J=7.8 H),6.03~5.94(m,3 H),4.20(s,2 H)。IR (KBr,cm-1):3336,1597,1497,1461,838,728,684,541。MS(ESI):m/z=371.9[M+H]+。
1.3 細胞培養(yǎng) 實驗方法參考之前研究[5],簡述如下:將剛剛出生1~2 d的乳小鼠(北京維通利華實驗動物技術有限公司)在無菌條件下處死,取腦組織,剝離軟腦膜和血管后加入適量胰酶(10個腦子加入6 ml左右),置于37 ℃細胞培養(yǎng)箱內10 min消化。過75 μm濾器后離心,用完全培養(yǎng)基重懸細胞后計數(shù),分種在75 cm2培養(yǎng)瓶中。36~48 h待細胞貼壁后第一次全換液,6~7 d待星形膠質細胞鋪滿瓶底后第二次換液,繼續(xù)培養(yǎng)至10 d后搖板分離收集原代小膠質細胞。利用特異性抗體Ibal-1檢測,陽性率大于95%后可用于后續(xù)實驗。
1.4 CCK-8法檢測細胞活性 將原代小膠質細胞以每孔4×103個細胞的密度接種于96孔板,待細胞生長過夜貼壁后,與不同濃度LX007(0~50 μmol/L)共孵育24 h,然后每孔加入10 μl CCK-8工作液,37 ℃孵育2 h后置于Bio-Rad iMark酶標儀(美國伯樂公司)中,在450 nm波長下檢測吸光度值。
1.5 ROS水平檢測 不同濃度的LX007預處理原代小膠質細胞1 h后,加入0.1 ng/ml LPS刺激12 h,去除上清液后利用PBS潤洗細胞3次,加入DCFH-DA(終濃度為10 μmol/L),在37 ℃避光孵育30 min。孵育結束后再利用PBS潤洗細胞3次,采用Accuri C6流式細胞儀(BD公司)在激發(fā)光488 nm和發(fā)射光525 nm下檢測ROS的表達,最后利用FlowJo 10.0軟件進行分析。
1.6 細胞核質分離與免疫印跡 將藥物處理完畢的細胞用PBS潤洗3次,加入細胞質裂解液置于冰上孵育20 min,3000 rpm/min離心15 min,上清即為細胞質蛋白。沉淀部分加入和裂解液再在冰上孵育20 min,12500 rpm/min離心15 min,上清液為核蛋白。每組樣品取等量的蛋白進行SDS-聚丙烯酰胺凝膠電泳(SDS-PAGE),電泳1.5~2 h后100 V恒壓轉膜2 h。接著利用含有5%脫脂奶粉的TBS溶液封閉1 h,4 ℃一抗孵育過夜。次日用相應種屬來源的二抗室溫孵育1 h,ECL發(fā)光試劑進行顯色反應,用Image J圖像分析系統(tǒng)分析實驗結果。
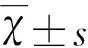
2 結 果
2.1 低濃度的LX007對原代小膠質細胞活性無顯著影響 用0~50 μmol/L濃度的LX007作用于原代小膠質細胞24 h后,cck-8試劑盒檢測細胞活力,結果如表1所示,30 μmol/L及以下濃度的LX007對細胞沒有毒性,不會影響細胞的活力,但是高于等于40 μmol/L濃度后,LX007顯著降低了原代小膠質細胞的活力。因此,本實驗所用LX007的劑量在30 μmol/L范圍內。

表1 LX007對原代小膠質細胞活性的影響
與對照組相比*P<0.05 and **P<0.01
2.2 LX007減少LPS引起的細胞內ROS表達 不同濃度的LX007預處理成熟的原代小膠質細胞1 h,接著加入LPS共同刺激12 h,流式細胞儀檢測細胞ROS的表達后發(fā)現(xiàn),空白對照組原代小膠質細胞ROS含量很低,單獨使用30 μmol/L的LX007刺激的細胞ROS含量與對照組沒有顯著性差異。而LPS刺激組,ROS含量顯著增加,但隨著LX007預處理劑量的增加,原代小膠質細胞ROS的表達水平逐漸降低,差異具有統(tǒng)計學意義(見圖2)。
2.3 LX007增加HO-1的表達 血紅素氧合酶1(heme oxygenase 1,HO-1)是公認的具有抗氧化功能的分子,在許多疾病中起著重要的保護作用。因此,我們進一步觀察LX007減少ROS表達是否通過影響HO-1的表達。同樣,我們利用不同濃度的LX007預處理原代小膠質細胞1 h,緊接著用LPS共刺激24 h,Western blot檢測各組中HO-1的表達。結果發(fā)現(xiàn),HO-1的表達隨著LX007預處理濃度的增加而增加(見圖3),說明LX007具有提高HO-1表達的能力。
2.4 LX007抑制LPS誘導的原代小膠質細胞Nrf2的核/質轉位 HO-1的表達通常是由核因子E2相關因子(nuclear factor erythroid 2-related factor 2,Nrf2)誘導的,我們接下來的研究發(fā)現(xiàn),對照組原代小膠質細胞內的Nrf2主要在核內表達,而LPS刺激后,Nrf2從胞核轉位到胞漿。LX007的預處理顯著的抑制這一現(xiàn)象的產生(見圖4),使得更多的Nrf2在核內行使轉錄功能。

圖2 LX007減少LPS引起的細胞內ROS表達。與對照組比較**P<0.01;與LPS組比較#P<0.05,##P<0.01

圖3 LX007增加HO-1蛋白的表達。與對照組比較*P<0.05,**P<0.01

圖4 LX007抑制LPS誘導的原代小膠質細胞Nrf2的核/質轉位。與對照組比較,*P<0.05,**P<0.01;與LPS組比較,#P<0.05,##P<0.01
3 討 論
氧對于活細胞而言是必不可少的,但過量又很危險。腦組織是體內氧負荷最大的器官之一,細胞過氧化能力增強時會引起ROS的大量積累,過多的ROS能通過激活一系列的信號傳導通路,引發(fā)許多病理學改變,是引發(fā)多種神經系統(tǒng)疾病的重要原因[6,7]。早期對小膠質細胞的研究發(fā)現(xiàn),其異常的活化會導致ROS的生成,持續(xù)的ROS釋放介導脂質和其它大分子過氧化,進而誘導神經元凋亡程序啟動[8]。
在正常生理狀態(tài)下,Nrf2與Keap1(Kelch-like ECH-associated protein-1)蛋白結合處于非活化的狀態(tài),當細胞受到外界刺激,Nrf2會與Keap1解離并與ARE(antioxidant response element)結合,啟動下游抗氧化蛋白等基因轉錄和表達,從而抵御外來的有害刺激[9,10]。在AD患者中,Nrf2的表達顯著低于正常人[10]。同樣在APP/PS1轉基因小鼠體內,伴隨著Aβ沉積的出現(xiàn),Nrf2總蛋白降低,Nrf2-ARE通路受到抑制,但是運用Nrf2的激活劑之后能夠減少Aβ的毒作用[11,12]。這些說明Nrf2的表達和功能在AD的病理和生理過程中起著重要的作用。HO-1是受到Nrf2信號通路調控的下游靶基因之一,其功能是作為抗氧化蛋白酶參與維持機體的氧化還原平衡[13,14]。過表達HO-1發(fā)現(xiàn)可以保護多巴胺神經元對抗MPTP(1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine,1-甲基-4-苯基-1,2,3,6-四氫吡啶)介導的神經毒性[15]。雙氧水的刺激可以誘導小膠質細胞產生大量的ROS,當細胞預先用腺苷處理后,ROS的表達顯著降低。進一步實驗解釋了這一現(xiàn)象,腺苷的預處理能通過磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和Nrf2信號通路增加了HO-1的表達,進而改善超氧化與炎癥反應[16]。
我們的研究團隊合成了一類N-芐基苯胺衍生物,這類化合物是由一個疏水性A環(huán)和一個具有羧基的親水性B環(huán)連接而成。既往的研究著重關注ZL006號化合物,發(fā)現(xiàn)其具有腦缺血再灌注損傷的保護作用,主要是通過直接干預nNOS與PSD-95的偶聯(lián),但化合物對小膠質細胞的作用卻沒有報道。本研究選用另一個類似結構的化合物—4-[(5-溴-3-氯-2-羥基苯基)氨基]-2-羥基苯甲酸(LX007),探究其對LPS刺激引起的小膠質細胞活性氧生成的抑制作用。實驗利用DCFH-DA熒光探針進行檢測,發(fā)現(xiàn)LPS刺激組小膠質細胞內ROS含量明顯升高,LX007預處理后能顯著減少ROS的生成,并且具有劑量依賴性。我們推測LX007降低細胞內LPS誘導的ROS水平可能與LX007促進了抗氧化通路有關。于是,在接下來的實驗中,我們檢測了HO-1蛋白的表達,發(fā)現(xiàn)隨著LX007預處理濃度的增加,HO-1的表達量也隨之增多。與此同時,研究還發(fā)現(xiàn)調控HO-1表達的Nrf2蛋白核質轉移也受到影響,LX007處理后更多的Nrf2進入核內,具有表達更多抗氧化物質的潛力。綜上所述,化合物LX007預處理具有減少LPS刺激引起的小膠質細胞活性氧生成的能力,可能與LX007通過影響Nrf2/HO-1信號通路調控氧化應激有關。本研究豐富了該類化合物在神經退行性疾病防治和治療方面運用的實驗依據(jù)。
[1]Arcuri C,Mecca C,Bianchi R,et al. The pathophysiological role of microglia in dynamic surveillance,phagocytosis and structural remodeling of the developing CNS[J]. Front Mol Neurosci,2017,10:191.
[2]Aguzzi A,Barres BA,Bennett ML. Microglia:scapegoat,saboteur,or something else[J]? Science,2013,339(6116):156-161.
[3]Perry VH,Holmes C. Microglial priming in neurodegenerative disease[J]. Nat Rev Neurol,2014,10(4):217-224.
[4]Zhou L,Li F,Xu HB,et al. Treatment of cerebral ischemia by disrupting ischemia-induced interaction of nNOS with PSD-95[J]. Nat Med,2010,16(12):1439-1443.
[5]Weng L,Zhang H,Li X,et al. Ampelopsin attenuates lipopolysaccharide-induced inflammatory response through the inhibition of the NF-kappaB and JAK2/STAT3 signaling pathways in microglia[J]. Int Immunopharmacol,2017,44:1-8.
[6]Lan AP,Chen J,Chai ZF,et al. The neurotoxicity of iron,copper and cobalt in Parkinson’s disease through ROS-mediated mechanisms[J]. Biometals,2016,29(4):665-678.
[7]Deshmukh P,Unni S,Krishnappa G,et al. The Keap1-Nrf2 pathway:promising therapeutic target to counteract ROS-mediated damage in cancers and neurodegenerative diseases[J]. Biophys Rev,2017,9(1):41-56.
[8]Block ML,Zecca L,Hong JS. Microglia-mediated neurotoxicity:uncovering the molecular mechanisms[J]. Nat Rev Neurosci,2007,8(1):57-69.
[9]Seo JY,Pyo E,Park J,et al. Nrf2-mediated HO-1 induction and antineuroinflammatory activities of halleridone[J]. J Med Food,2017,20(11):1091-1099.
[10]Ramsey C,Glass CM,Lindl K,et al. Expression of Nrf2 in neurodegenerative diseases[J]. J Neuropathol Exp Neurol,2007,66(1):75-85.
[11]Kanninen K,Malm TM,Jyrkk?nen HK,et al. Nuclear factor erythroid 2-related factor 2 protects against beta amyloid[J]. Mol Cell Neurosci,2008,39(3):302-313.
[12]Branca C,F(xiàn)erreira E,Nguyen TV,et al. Genetic reduction of Nrf2 exacerbates cognitive deficits in a mouse model of Alzheimer’s disease[J]. Hum Mol Genet,2017,26(24):4823-4835.
[13]De-Vries H,Witte MD,Rozemuller A,et al. Nrf2-induced antioxidant protection:a promising target to counteract ROS-mediated damage in neurodegenerative disease[J]. Free Radic Biol Med,2008,45(10):1375-1383.
[14]Qiang W,Cahill JM,Liu J,et al. Activation of transcription factor Nrf-2 and its downstream targets in response to moloney murine leukemia virus ts1-induced thiol depletion and oxidative stress in astrocytes[J]. J Virol,2004,78(21):11926-11938.
[15]Hung SY,Liou HC,Kang KH,et al. Overexpression of heme oxygenase-1 protects dopaminergic neurons against 1-methyl-4-phenylpyridinium-induced neurotoxicity[J]. Mol Pharmacol,2008,74(6):1564-1575.
[16]Min KJ,Kim JH,Jou I,et al. Adenosine induces hemeoxygenase-1 expression in microglia through the activation of phosphatidylinositol 3-kinase and nuclear factor E2-related factor 2[J]. Glia,2008,56(9):1028-1037.

