老年原發性醛固酮增多癥高血壓患者的腦鈉肽前體水平及與LVMI和激活醛固酮水平的相關性
劉 寧,劉燕軍,趙有芳
原發性醛固酮增多癥作為一種常見性的繼發性高血壓,其在高血壓的占比約為10%,且35~50歲者為高發群體[1,2]。相對于原發性高血壓者,原發性醛固酮增多癥患者的左心室肥厚比例較高,容易引起患者心臟損傷[3,4]。B型腦鈉肽(B_type natriuretic peptide,BNP)作為心室分泌心臟神經激素之一,臨床中常對N末端B型腦鈉肽前體(N terminal pro_B_type natriuretic peptide,NT_proBNP)的水平變化情況進行檢測[5]。原發性醛固酮增多癥在老年群體中的發病率相對較低,且目前有關老年原發性醛固酮增多癥與原發性高血壓老年患者血漿NT_proBNP水平與左心室質量指數(left ventricular mass index,LVMI)和激活醛固酮水平相關性的研究報道較為少見。因此,現就本院46例原發性醛固酮增多癥與52例原發性高血壓老年患者進行探討,旨在分析其血漿NT_proBNP水平與LVMI和激活醛固酮水平相關性,進而探討其與早期心臟損傷的評估價值。
1 資料與方法
1.1 一般資料:選取本院2016年1月至2017年3月收治的原發性醛固酮增多癥46例為觀察組與原發性高血壓老年患者52例為對照組。診斷標準:(1)高血壓:收縮壓≥140mmHg和/或舒張壓≥90mmHg;(2)原發性醛固酮增多癥:血漿醛固酮/血漿腎素活性的比值在240及以上者為篩查陽性;采取靜脈生理鹽水負荷試驗,4h內采用生理鹽水進行靜脈滴注2L后血漿腎素活性低于1ng/(ml·h),血漿醛固酮水平在60ng/L及以上,即診斷為原發性醛固酮增多癥[6]。本研究已獲得本院醫學倫理委員會審核通過,且所有患者及家屬均自愿簽署知情同意書。入選標準:(1)患者未使用血管緊張素轉換酶抑制劑、β受體阻滯劑與血管緊張素Ⅰ受體拮抗劑等藥物的時間至少14d,且停用螺內酯至少42d,停用其他利尿劑至少30d;(2)患者具備醛固酮、血漿腎素活性與超聲心動圖等重要臨床資料。排除標準:(1)伴有腎血管性高血壓、腎實質性高血壓、庫欣綜合征、甲狀腺功能異常及嗜鉻細胞瘤等其他類型的繼發性高血壓;(2)伴有心房顫動、冠心病、心肌炎、心力衰竭、肺源性心臟病及心臟瓣膜病等器質性心臟病;(3)伴有精神性疾病,依從性較差的患者。
1.2 方法:于清晨取所有患者空腹靜脈血10ml用于血尿酸、空腹血糖、基礎醛固酮、血肌酐及基礎血漿腎素活性等水平的測定,另取5ml靜脈血用于血漿腎素活性與醛固酮激活的測定。通過抗凝真空采血管抽取兩組患者清晨空腹靜脈血3ml,用于血漿NT_proBNP水平的檢測,離心處理后取其血清上機,在全自動電子化學發光儀(型號UniCel DxI800,美國貝克曼庫爾特公司)上通過電化學發光法對其水平進行檢測。醛固酮的測定通過放射免疫法,其參考范圍為基礎醛固酮29.4~161.5ng/L,激活醛固酮38.1~313.3ng/L。而血漿腎素活性的測定亦通過放射免疫法,其參考范圍為基礎血漿腎素活性0.1~5.5ng/(ml·h),激活血漿腎素活性0.7~17.4ng/(ml·h)。
左心室肥厚的評定:采用彩色超聲多普勒診斷儀(型號LOGIQ_BOOK XP PRO,通用電氣醫療系統,中國有限公司)對兩組患者左心室舒張末內徑(left ventricular end diastolic diameter,LVEDD)、舒張期左心室后壁厚度(left ventricular posterior wall diastolic thickness,LVPWDT)及舒張期室間隔厚度(interventricular septal diastolic thickness,IVSDT)進行測定,且均記錄3個心動周期后取其均值作為最終測量結果。按照不同患者的體質量、身高情況,通過Devereux校正公式對患者左心室質量(left ventricular mass,LVM)與LVMI。其中,LVM=1.04×[(LVEDD+LVPWDT+IVSDT)3-LVEDD3]-13.6;體表面積=0.0061×身高+0.0128×體質量-0.1529;LVMI(g/m2)=LVM/體表面積。用LVMI水平對左心室肥厚進行評估,其中男性LVMI水平高于115g/m2,而女性LVMI水平高于95g/m2則判斷為左心室肥厚[7]。

2 結果
2.1 兩組患者臨床基線資料情況比較:兩組患者在年齡、性別比、體質量指數(body mass index,BMI)、高血壓病程、糖尿病病史、空腹血糖、舒張壓(DBP)、收縮壓(SBP)、總膽固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)等水平比較,均無統計學意義(均P>0.05),而觀察組血鈉、24h尿鈉、24h尿鉀、24h尿醛固酮、基礎醛固酮及激活醛固酮水平均較對照組高(均P<0.05),且血鉀、血尿酸、基礎血漿腎素活性及激活血漿腎素活性水平均較對照組低(均P<0.05),見表1。

表1 兩組患者臨床基線資料情況比較
注:與對照組比較*P<0.05,**P<0.01
2.2 兩組NT_proBNP水平與高血壓靶器官相關指標情況比較:觀察組log NT_proBNP、LVMI水平及左心室肥厚比例高于對照組(均P<0.05),而兩組24h尿蛋白、血肌酐(creatinine,Cr)、99Tcm腎小球濾過率、頸動脈內膜中層厚度(carotid artery intima_media thickness,cIMT)及尿白蛋白肌酐比值比較,差異均無統計意義(均P>0.05),見表2。
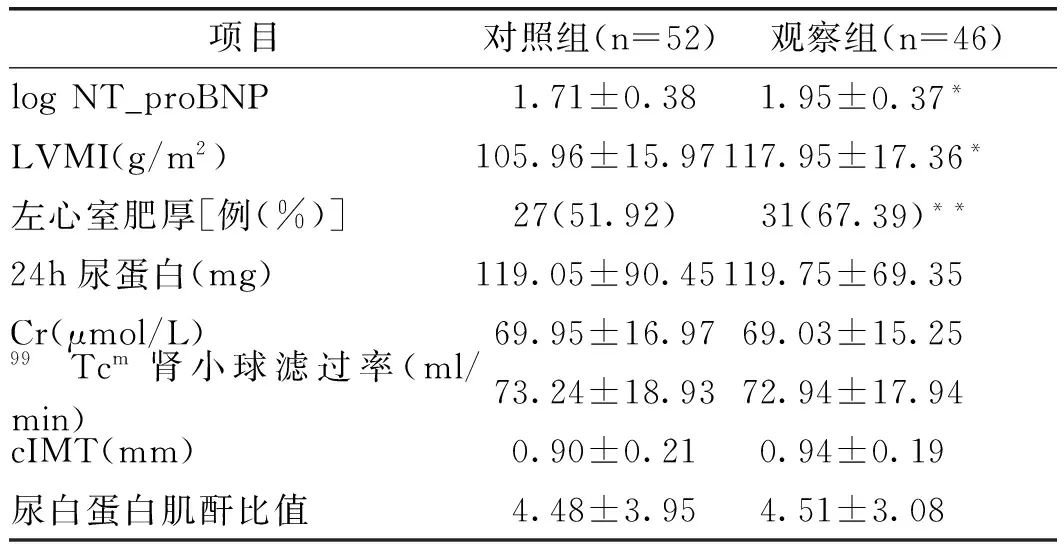
表2 兩組NT_proBNP水平與高血壓靶器官相關指標比較
注:與對照組比較*P<0.05,**P<0.01
2.3 兩組患者NT_proBNP多元線性逐步回歸分析:結果顯示,觀察組NT_proBNP水平與LVMI和激活醛固酮水平密切相關,而對照組NT_proBNP水平與SP水平密切相關,見表3。
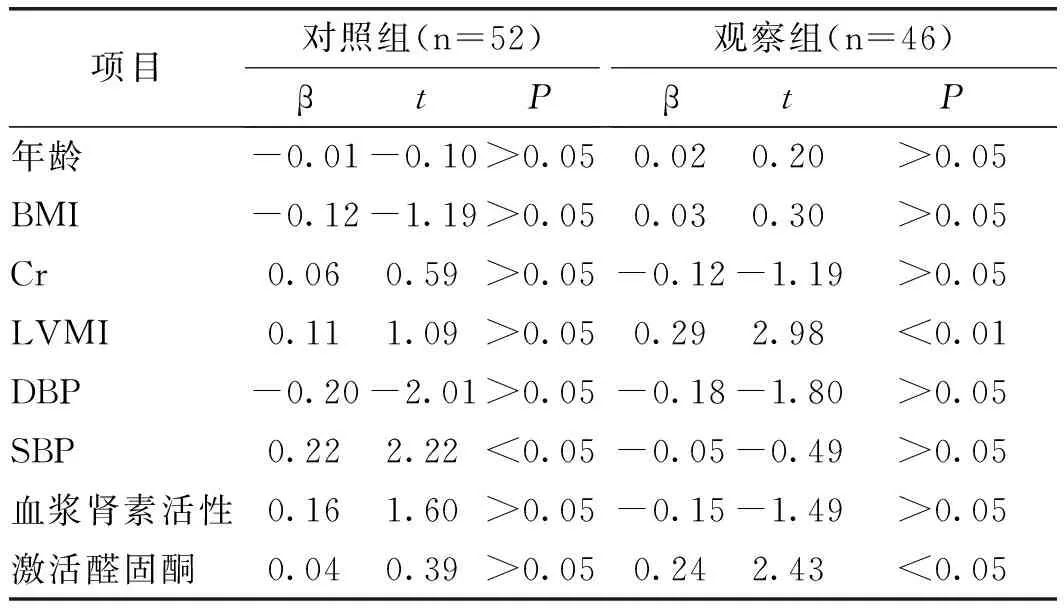
表3 兩組患者NT_proBNP多元線性逐步回歸分析
3 討論
研究指出[8],相比老年原發性高血壓者,老年原發性醛固酮增多癥者具有較多的早發心血管疾病家族史及更高的左心室肥厚發生率,同時指出左心室肥厚是老年原發性醛固酮增多癥者最為常見且重要的靶器官損害指標。本文發現,觀察組患者LVMI水平亦高于對照組,且其左心室肥厚比例亦高于對照組,與上述研究報道基本一致。結果表明,相對于老年原發性高血壓患者,老年原發性醛固酮增多癥者容易發生較早的心臟功能變化,其LVMI水平更高,且左心室肥厚發生的風險較高,而除LVMI與左心室肥厚的指標外,兩組老年患者的其他高血壓靶器官損害指標對比,并無統計學意義。
由于NT_proBNP具有良好的穩定性,其在診斷與評估心力衰竭預后情況中發揮著顯著作用。研究指出[9],相比常規心血管危險因素如左心室肥厚等,NT_proBNP在評估心力衰竭的預測價值更高。本研究發現,觀察組log NT_proBNP水平高于對照組。分析其原因,可能由于老年原發性醛固酮增多癥者分泌較多醛固酮而導致血容量提高、鈉潴留,進而加重心臟負荷,導致其心室受到機械牽張作用而分泌大量的BNP。研究認為[10],原發性醛固酮增多癥患者中的BNP水平與其血容量密切相關。此外,研究表明[11],由于腎上腺髓質能夠形成一定的BNP,且腎上腺髓質NT_proBNP的mRNA容易在老年原發性醛固酮增多癥者中進行合成,可進一步形成大量BNP,且BNP水平可于腎上腺切除術后恢復正常范圍。結果提示,老年原發性醛固酮增多癥者中的BNP水平可能與心臟外合成的BNP存在一定聯系。
研究指出[12],NT_proBNP在高血壓患者中的心臟結構變化的程度存在密切關系,是評估臨床早期心臟損害的重要標記物之一。研究報道[13],NT_proBNP是評估高血壓患者有無發生左心室肥厚的重要指標,因NT_proBNP水平的上升會提高患者發生左心室肥厚的風險。NT_proBNP能夠用于對近遠期左心室肥厚的評估,可作為高血壓患者預后情況的重要標記物,且能夠在抗高血壓治療及高血壓的危險分層中扮演著重要角色[14,15]。
本文發現,觀察組血鈉、24h尿鈉、24h尿鉀、24h尿醛固酮、基礎醛固酮及激活醛固酮水平均較對照組高,且血鉀、血尿酸、基礎血漿腎素活性及激活血漿腎素活性水平均較對照組低。結果表明,老年原發性醛固酮增多癥者較原發性高血壓者具有較早的心臟損害,預示著較早的心臟結構、功能改變。此外,本研究多元線性逐步回歸分析結果顯示,觀察組NT_proBNP水平與LVMI和激活醛固酮水平密切相關,而對照組NT_proBNP水平與SP水平密切相關。結果提示,LVMI和激活醛固酮是老年原發性醛固酮增多癥者的獨立危險因素,且患者心臟損害可能獨立于血壓外。
綜上所述,原發性醛固酮增多癥容易引起高血壓老年患者NT_proBNP水平上升,且NT_proBNP水平與LVMI和激活醛固酮水平密切相關,提示LVMI和激活醛固酮是老年原發性醛固酮增多癥者的獨立危險因素,且患者心臟損害可能獨立于血壓外。
[1]高興成,胡鵬,茹伯戰.原發性醛固酮增多癥臨床診療分析(附63例報告)[J].臨床泌尿外科雜志,2012,27(5):357-359+362.
[2]Chang CH, Hu YH, Tsai YC, et al. Arterial stiffness and blood pressure improvement in aldosterone_producing adenoma harboring KCNJ5 mutations after adrenalectomy[J]. Oncotarget,2017,8(18):29984-29995.
[3]Saint F, Prader R, Cordonnier C, et al. Long_term blood pressure outcome after unilateral adrenalectomy for primary hyperaldosteronism[J]. Prog Urol,2017,27(6):389-394.
[4]Maiolino G, Calo LA, Rossi GP. The Time has come for systematic screening for primary aldosteronism in all hypertensives[J]. J Am Coll Cardiol,2017,69 (14):1821-1823.
[5]黃偉.老年繼發性高血壓的臨床特點探討[J].實用心腦肺血管病雜志,2014,22(7):114-115.
[6]王方超,陳明.原發性醛固酮增多癥診療進展[J].臨床心血管病雜志,2014,30(5):374-376.
[7]Pizzolo F, Zorzi F, Chiecchi L, et al. NT_proBNP, a useful tool in hypertensive patients undergoing a diagnostic evaluation for primary aldosteronism[J]. Endocrine,2014,45(3):479-486.
[8]Monticone S, Burrello J, Tizzani D, et al. Prevalence and clinical manifestations of primary aldosteronism encountered in primary care practice[J]. J Am Coll Cardiol,2017,69(14):1811-1820.
[9]Willenberg HS. How to escape from primary aldosteronism news and views on an adrenal disorder of salt retention[J]. Horm Metab Res,2017,49(3):151-163.
[10]Ladurner R, Sommerey S, Buechner S, et al. Accuracy of adrenal imaging and adrenal venous sampling in diagnosing unilateral primary aldosteronism[J]. Eur J Clin Invest,2017,47(5):372-377.
[11]趙思鴻,陳之娟.血清D_二聚體水平與老年高血壓患者左心室肥厚的相關性分析[J].實用心腦肺血管病雜志,2016,24(9):155-157.
[12]尹曉燕,張錦.原發性醛固酮增多癥106例患者回顧性分析[J].山西醫藥雜志,2012, 41(5):486-488.
[13]郭媛博,閆朝麗,張麗娟,等.原發性醛固酮增多癥46例臨床分析[J].疑難病雜志,2014,13(3):256-258.
[14]Ito A, Yamazaki Y, Sasano H, et al. A case of primary aldosteronism caused by unilateral multiple adrenocortical micronodules presenting as muscle cramps at rest: The importance of functional histopathology for identifying a culprit lesion[J]. Pathol Int,2017,67(4):214-221.
[15]Freel EM. Primary Aldosteronism or not primary aldosteronism: Is this now the question in normotension[J]? Hypertension,2017,69(5):780-781.

