轉(zhuǎn)化生長因子β1在牽張應(yīng)力刺激促進(jìn)后縱韌帶細(xì)胞骨化中的作用
繆錦浩,郭海玲,房 雷,陳 羽,匡 勇
上海中醫(yī)藥大學(xué)附屬曙光醫(yī)院骨傷科,上海 201203
頸椎后縱韌帶骨化癥(OPLL)可產(chǎn)生對脊髓、神經(jīng)根的壓迫,并出現(xiàn)相應(yīng)的神經(jīng)功能障礙。其病理基礎(chǔ)是后縱韌帶的成纖維細(xì)胞出現(xiàn)骨向分化,并在患者的后縱韌帶組織內(nèi)出現(xiàn)異位骨化。牽張應(yīng)力刺激可使后縱韌帶成纖維細(xì)胞表現(xiàn)出一定的成骨細(xì)胞活性,被認(rèn)為是促進(jìn)頸椎OPLL進(jìn)展的重要因素,但其機(jī)制尚不明了[1-4]。轉(zhuǎn)化生長因子β1(TGF-β1)可增加成纖維細(xì)胞的膠原合成,促進(jìn)細(xì)胞外基質(zhì)沉積,而這也正是成纖維細(xì)胞出現(xiàn)骨向分化進(jìn)程中的表現(xiàn)[5-7]。因此,推測牽張應(yīng)力刺激可能對后縱韌帶細(xì)胞中的TGF-β1表達(dá)有所影響,并借此促進(jìn)其骨化。本研究通過對體外培養(yǎng)的頸椎OPLL患者的后縱韌帶成纖維細(xì)胞加載牽張應(yīng)力刺激,觀察其骨化指標(biāo)和TGF-β1基因的表達(dá)變化,研究TGF-β1在該進(jìn)程中的作用,從而證實(shí)以上推論。
1 材料與方法
1.1 材料和設(shè)備
收集本院12例接受頸前路手術(shù)的頸椎OPLL患者的后縱韌帶組織,其中男7例,女5例;平均年齡52.1(38 ~ 62)歲。實(shí)驗(yàn)所用主要試劑及設(shè)備如下。DMEM高糖培養(yǎng)基(Gibco公司,中國),TRIzol細(xì)胞RNA抽提用裂解液、大容量cDNA反轉(zhuǎn)錄試劑盒(Life Technologies公司,美國),SYBR Primix Ex Taq II PCR試劑盒(TaKaRa公司,日本),總RNA提取試劑盒(天根生化科技有限公司,北京),外源性TGF-β1(Humanzyme公司,美國),TGF-β1抗體、IgG(Epitomics公司,美國),ABI 7500 RT-PCR擴(kuò)增儀、ABI 2720 cDNA反轉(zhuǎn)錄儀(Life Technologies公司,美國),核酸蛋白測定儀(Eppendorf公司,美國),細(xì)胞牽張應(yīng)力加載儀(Flexercell公司,美國)。
1.2 細(xì)胞培養(yǎng)及鑒定
將所取標(biāo)本剪成小于0.5 cm×1.0 cm×1.0 cm的小塊組織,將其均勻鋪灑于50 mL細(xì)胞培養(yǎng)瓶中,靜置于細(xì)胞培養(yǎng)箱內(nèi),采用組織塊培養(yǎng)法進(jìn)行體外培養(yǎng)。待組織塊周圍細(xì)胞爬出后,每3 ~ 5 d更換一次培養(yǎng)液,待細(xì)胞鋪滿瓶底約80%后,加入0.5 ~ 1.0 mL 0.25%胰酶-EDTA液進(jìn)行消化傳代。取第3代細(xì)胞用于實(shí)驗(yàn)。將細(xì)胞接種在培養(yǎng)板內(nèi)的蓋玻片上,置入培養(yǎng)箱內(nèi)過夜,待細(xì)胞貼壁。次日對細(xì)胞進(jìn)行HE及免疫熒光染色鑒定,熒光倒置相差顯微鏡下觀察其形態(tài)學(xué)特點(diǎn)。
1.3 分組及對照設(shè)計
按照3×105/孔的密度將細(xì)胞接種在特制的Flexercell培養(yǎng)板內(nèi)。取2塊培養(yǎng)板分別加載牽張應(yīng)力刺激12 h及24 h,并分別設(shè)靜置相同時間的對照組。另取2塊培養(yǎng)板接種細(xì)胞,并在其中一塊的培養(yǎng)孔中分別依次加入濃度為0、0.1、1.0、10.0 ng/mL的外源性TGF-β1(濃度為0視為對照組),靜置24 h;在另一塊培養(yǎng)板的培養(yǎng)孔中接種細(xì)胞并加入濃度為2.0 μg/mL的TGF-β1抗體,并設(shè)空白對照組,同時選擇對TGF-β1表達(dá)沒有影響但結(jié)構(gòu)相似的IgG以相同濃度設(shè)為參照組,各組均加載牽張應(yīng)力刺激24 h。所有實(shí)驗(yàn)重復(fù)2次。
1.4 牽張應(yīng)力加載
確保培養(yǎng)板底部硅膠膜處于水平位置后,將其放入培養(yǎng)箱過夜待細(xì)胞貼壁。次日在電子顯微鏡下確認(rèn)細(xì)胞的貼壁及生長狀態(tài)良好后,更換培養(yǎng)液同步化24 h,以確保細(xì)胞的生長狀態(tài)一致。同步化完成后將培養(yǎng)板再次放入培養(yǎng)箱,開啟計算機(jī)控制中心,連接負(fù)壓抽吸泵,設(shè)置牽張應(yīng)力參數(shù),幅度10%、頻率0.5 Hz,作用時間為12 h及24 h。
1.5 骨化指標(biāo)和TGF-β1的檢測
按上述分組,采用TRIzol法收集各培養(yǎng)孔中細(xì)胞的總RNA,通過核酸蛋白光譜儀測定其純度和濃度。設(shè)計合成RNA引物,引物序列見表1。使用大容量cDNA反轉(zhuǎn)錄試劑盒對提取的RNA進(jìn)行反轉(zhuǎn)錄,隨后進(jìn)行熒光實(shí)時定量PCR,選擇相對定量分析法進(jìn)行分析,以β-actin作為內(nèi)標(biāo)基因,研究相關(guān)基因的相對表達(dá)差異。

表1 PCR引物序列Tab. 1 Primer sequences
1.6 統(tǒng)計學(xué)處理
2 結(jié) 果
2.1 后縱韌帶細(xì)胞的HE及免疫熒光染色鑒定
經(jīng)HE及免疫熒光染色后,在倒置相差顯微鏡下觀察,來源于頸椎OPLL患者的后縱韌帶成纖維細(xì)胞呈梭形、紡錘形及多角的星形,細(xì)胞核大、卵圓形,部分細(xì)胞處于有絲分裂期。細(xì)胞核經(jīng)DAPI染為藍(lán)色,細(xì)胞質(zhì)波形蛋白經(jīng)TRITC標(biāo)記后呈紅色陽性表達(dá),可證實(shí)其為成纖維細(xì)胞(圖1)。
2.2 牽張應(yīng)力刺激后COLⅠ、ALP和TGF-β1表達(dá)
來源于頸椎OPLL患者的后縱韌帶成纖維細(xì)胞經(jīng)牽張應(yīng)力刺激12 h及24 h后,細(xì)胞中COLⅠ、ALP和TGF-β1的mRNA表達(dá)與靜置相同時間的對照組相比均有所升高,在24 h時其差異具有統(tǒng)計學(xué)意義(P < 0.05,圖2)。
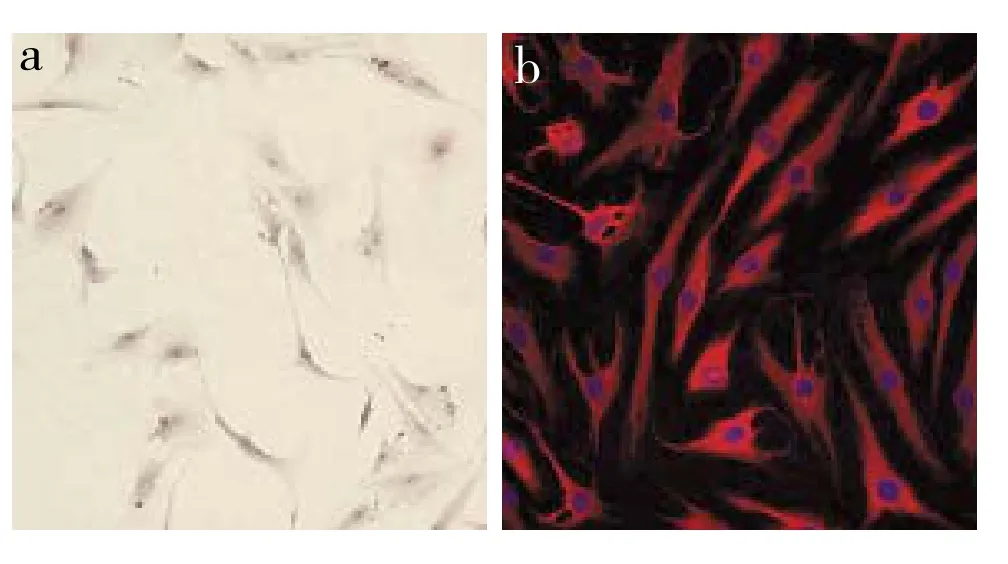
圖1 后縱韌帶成纖維細(xì)胞Fig. 1 Posterior longitudinal ligament fi broblasts
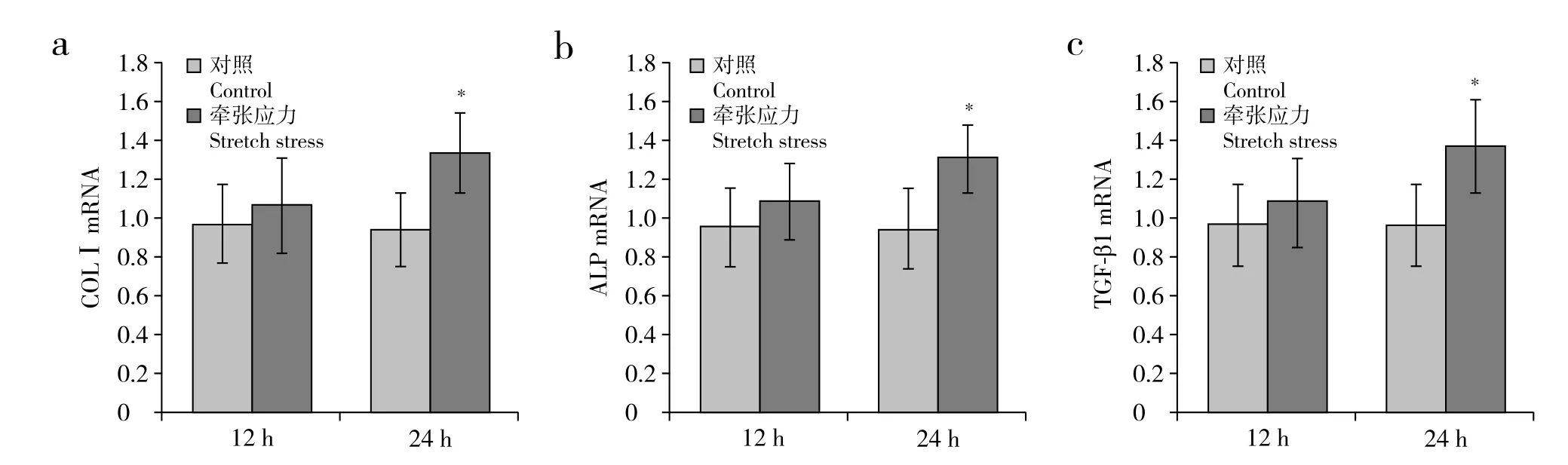
圖 2 牽張應(yīng)力刺激12 h及24 h后COLⅠ、ALP和TGF-β1的mRNA表達(dá)Fig. 2 mRNA expression of COLⅠ,ALP and TGF-β1 after 12 h and 24 h stress stimulation
2.3 TGF-β1在后縱韌帶成纖維細(xì)胞骨化進(jìn)程中的作用
在接種后縱韌帶細(xì)胞的培養(yǎng)孔中加入濃度分別為0、0.1、1.0、10.0 ng/mL的外源性TGF-β1,靜置24 h后,細(xì)胞中COLⅠ及ALP的mRNA表達(dá)量升高,其中10.0 ng/mL濃度組與0 ng/mL組相比差異具有統(tǒng)計學(xué)意義(P < 0.05,圖3)。而經(jīng)牽張應(yīng)力刺激24 h后,對照組及IgG組細(xì)胞中COLⅠ及ALP的mRNA表達(dá)量升高幅度均明顯大于TGF-β1組,差異有統(tǒng)計學(xué)意義(P < 0.05,圖4)。
3 討 論
OPLL的發(fā)生和發(fā)展被認(rèn)為與牽張應(yīng)力刺激關(guān)系密切。日本學(xué)者在分析了頸椎的活動度與骨化進(jìn)展快慢之間的關(guān)系后認(rèn)為,頸椎活動度較小的患者骨化進(jìn)展的速度相對較慢,反之則較快[8-9]。也有學(xué)者研究證實(shí),在頸椎OPLL患者中,頸椎活動度越大的節(jié)段韌帶骨化的程度往往越嚴(yán)重[10-11]。在臨床隨訪中,也發(fā)現(xiàn)接受頸椎后路椎板切除或椎管成形術(shù)等后路術(shù)式的患者由于頸椎后方結(jié)構(gòu)被破壞,可能產(chǎn)生頸椎不穩(wěn)而導(dǎo)致后縱韌帶的骨化灶進(jìn)展加速;而接受前路融合術(shù)的患者,因?yàn)槿诤虾笕コ祟i椎節(jié)段間的不穩(wěn)因素,其后縱韌帶的骨化灶進(jìn)展明顯減慢,甚至完全消失[12-14]。因此,牽張應(yīng)力刺激被認(rèn)為是促進(jìn)頸椎OPLL進(jìn)展的重要因素。
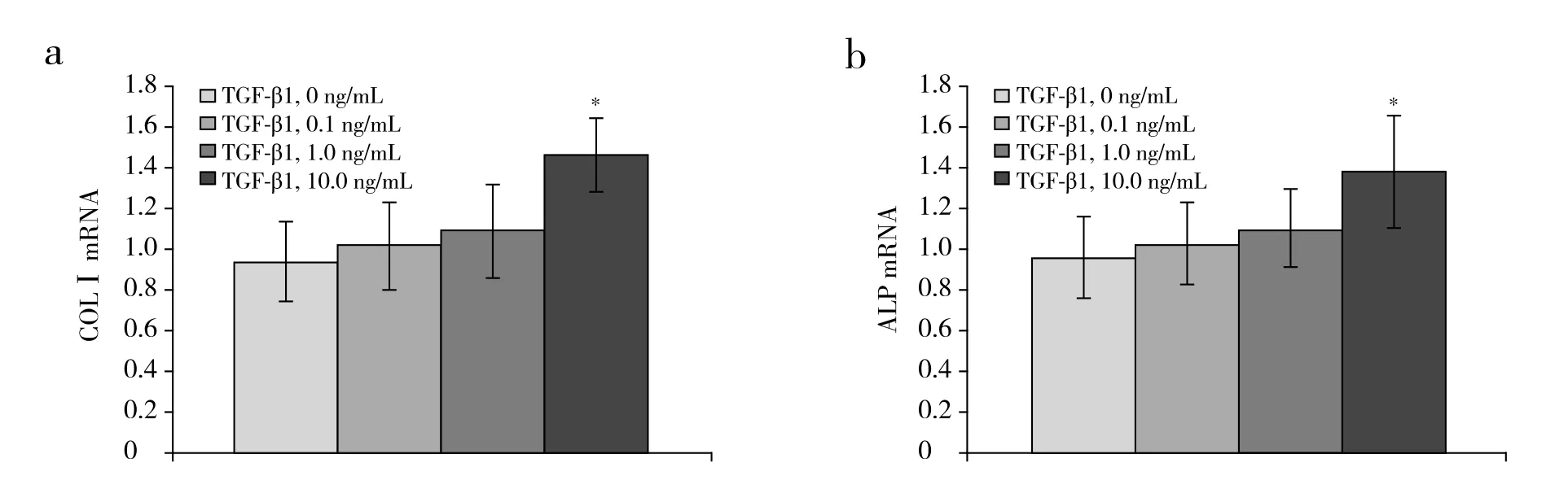
圖3 TGF-β1作用24 h 后COLⅠ和ALP的mRNA表達(dá)Fig. 3 mRNA expressions of COLⅠand ALP after stimulation with TGF-β1 for 24 h
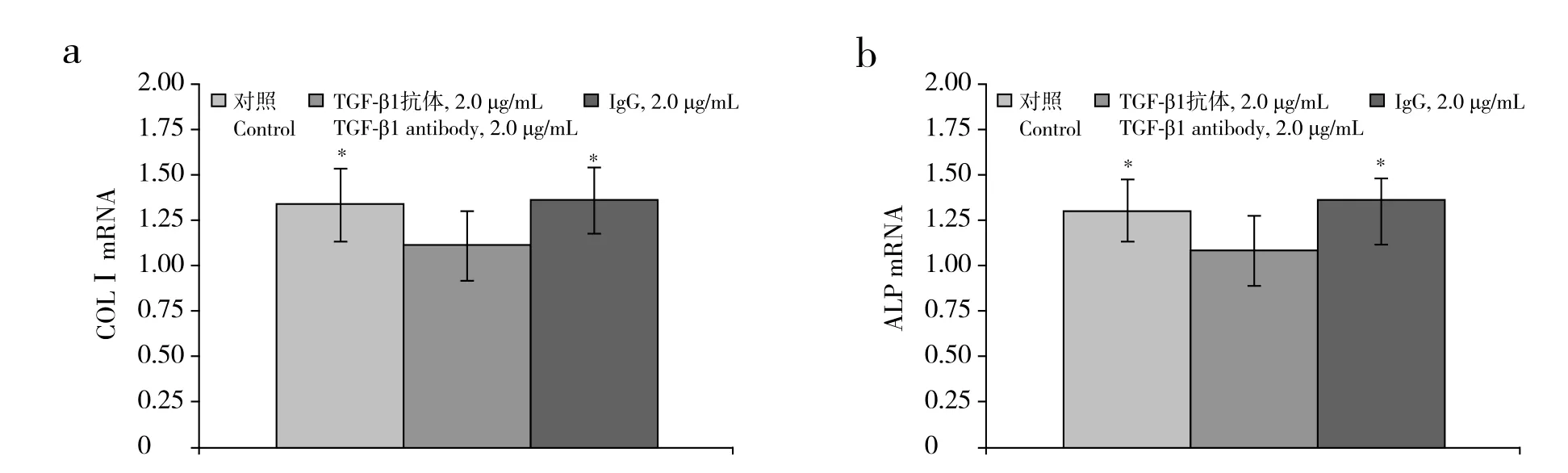
圖4 TGF-β1抗體作用并機(jī)械應(yīng)力刺激24 h后COLⅠ和ALP的mRNA表達(dá)Fig. 4 mRNA expressions of COLⅠand ALP after 2 μg/mL TGF-β1 antibody plus 24 h stress stimulation
由于OPLL起病過程緩慢,病因復(fù)雜,致病因素多,尚沒有建立理想的活體動物模型,多采用動物或者人體的后縱韌帶組織進(jìn)行體外研究。本研究通過頸前路手術(shù)獲取頸椎OPLL患者的后縱韌帶標(biāo)本,并采取組織塊培養(yǎng)法進(jìn)行細(xì)胞體外培養(yǎng)。對培養(yǎng)成功的細(xì)胞加載機(jī)械牽張應(yīng)力刺激的原理是利用真空泵抽吸特制的細(xì)胞培養(yǎng)板底部硅膠模,形成負(fù)壓,使細(xì)胞受到機(jī)械牽張,模擬體內(nèi)后縱韌帶承受的機(jī)械應(yīng)力刺激。針對人頸椎活動的特點(diǎn),本研究將牽張應(yīng)力刺激的參數(shù)設(shè)置在低頻率、低幅度狀態(tài),以更符合生理狀態(tài),而且也避免了過高頻率或過高幅度對體外培養(yǎng)的韌帶細(xì)胞可能造成的損傷。
選擇合適的成骨化指標(biāo)是觀察牽張應(yīng)力刺激對成纖維細(xì)胞骨化進(jìn)程的影響,并進(jìn)一步深入研究頸椎OPLL發(fā)生、發(fā)展過程的前提。COLⅠ是不溶性纖維型蛋白質(zhì),屬于一類細(xì)胞外基質(zhì),COLⅠ含量的增加會使韌帶纖維化的程度增高,其分泌增多是骨基質(zhì)形成的特征性表現(xiàn)[15]。ALP通過水解有機(jī)磷酸酯能為羥基磷灰石沉積提供必需的磷酸基團(tuán),利于細(xì)胞骨化,是骨形成過程中礦化階段的極好標(biāo)志物,定量ALP可作為成骨活性的可靠指標(biāo)[16]。因此本研究選擇了COLⅠ和ALP作為觀察成纖維細(xì)胞骨化進(jìn)程的特異性指標(biāo)。實(shí)驗(yàn)結(jié)果證實(shí)牽張應(yīng)力刺激可促進(jìn)頸椎OPLL患者后縱韌帶成纖維細(xì)胞的成骨化指標(biāo)升高,加速其骨向分化,同時亦發(fā)現(xiàn)在該進(jìn)程中TGF-β1的表達(dá)有明顯上調(diào)。TGF-β1與頸椎OPLL關(guān)系密切,可增加成纖維細(xì)胞膠原蛋白合成,促進(jìn)細(xì)胞外基質(zhì)沉積。Li等[17]通過實(shí)驗(yàn)發(fā)現(xiàn)高濃度葡萄糖可促進(jìn)大鼠后縱韌帶細(xì)胞分泌TGF-β1,并使膠原蛋白表達(dá)升高,促進(jìn)骨化,而采用抗體中和TGF-β1作用后,高濃度葡萄糖對大鼠后縱韌帶細(xì)胞骨化的促進(jìn)作用減弱,從而證實(shí)TGF-β1在高糖促進(jìn)OPLL進(jìn)程中的作用。在本實(shí)驗(yàn)中,加入外源性的TGF-β1作用后,頸椎OPLL患者的后縱韌帶成纖維細(xì)胞即使在無應(yīng)力刺激時其骨化指標(biāo)表達(dá)亦明顯升高,且呈現(xiàn)出一定的濃度依賴作用;同時,在加入TGF-β1抗體中和其作用后,應(yīng)力刺激對后縱韌帶成纖維細(xì)胞骨化指標(biāo)表達(dá)的促進(jìn)作用明顯減弱。因此可認(rèn)為TGF-β1在外界的牽張應(yīng)力刺激傳導(dǎo)至后縱韌帶成纖維細(xì)胞內(nèi)并促進(jìn)其骨向分化的過程中具有重要作用。
本研究克服了以往頸椎OPLL患者的后縱韌帶標(biāo)本為退變的病理組織、生長分化能力弱、體外培養(yǎng)成活率低的困難,采用組織塊培養(yǎng)法成功培養(yǎng)了頸椎OPLL患者的后縱韌帶成纖維細(xì)胞。證實(shí)了TGF-β1在牽張應(yīng)力刺激促進(jìn)頸椎OPLL患者后縱韌帶成纖維細(xì)胞骨向分化進(jìn)程中的作用。
[1]Chang H,Song KJ,Kim HY,et al. Factors related to the development of myelopathy in patients with cervical ossification of the posterior longitudinal ligament[J].J Bone Joint Surg Br,2012,94(7):946-949.
[2]Liu X,Kumagai G,Wada K,et al. Suppression of osteogenic differentiation in mesenchymal stem cells from patients with ossification of the posterior longitudinal ligament by a histamine-2-receptor antagonist[J]. Eur J Pharmacol,2017,810:156-162.
[3]Liu X,Kumagai G,Wada K,et al. High osteogenic potential of adipose- and muscle-derived mesenchymal stem cells in spinal-ossification model mice[J]. Spine(Phila Pa 1976),2017. [Epub ahead of print]
[4]Li H,Jiang LS,Dai LY. A review of prognos tic factors for surgical outcome of oss ification of the pos terior longitudinal ligament of cervical spine[J]. Eur Spine J,2008,17(10):1277-1288.
[5]Dang PN,Herberg S,Varghai D,et al. Endochondral ossification in critical-sized bone defects via readily implantable scaffold-free stem cell constructs[J]. Stem Cells Transl Med,2017,6(7):1644-1659.
[6]Bahney CS,Jacobs L,Tamai R,et al. Promoting endochondral bone repair us ing human osteoarthritic articular chondrocytes[J]. Tissue Eng Part A,2016,22(5/6):427-435.
[7]Dang PN,Dwivedi N,Phillips LM,et al. Controlled dual growth factor delivery from microparticles incorporated within human bone marrow-derived mesenchymal stem cell aggregates for enhanced bone tissue engineering via endochondral ossification[J]. Stem Cells Transl Med,2016,5(2):206-217.
[8]Agrawal D,Sharma BS,Gupta A,et al. Efficacy and results of expansive laminoplasty in patients with severe cervical myelopathy due to cervical canal s tenosis[J].Neurol India,2004,52(1):54-58.
[9]Cho WS,Chung CK,Jahng TA,et al. Post-laminectomy kyphosis in patients with cervical ossification of the posterior longitudinal ligament:does it cause neurological deterioration?[J]. J Korean Neurosurg Soc,2008,43(6):259-264.
[10]Fujimura Y,Nishi Y,Chiba K,et al. Multiple regression analysis of the factors influencing the results of expansive open-door laminoplasty for cervical myelopathy due to ossification of the posterior longitudinal ligament[J].Arch Orthop Trauma Surg,1998,117(8):471-274.
[11]Hou Y,Liang L,Shi GD,et al. Com paring effects of cervical anterior approach and laminoplasty in surgical management of cervical ossification of posterior longitudinal ligament by a pr ospective nonrandomized controlled study[J]. Orthop Traumatol Surg Res,2017,103(5):733-740.
[12]Chen Y,Chen D,Wang X,et al. Anterior corpectom y and fusion for severe ossification of posterior longitudinal ligament in the cervical spine[J]. Int Orthop,2009,33(2):477-482.
[13]Wang S,Xiang Y,Wang X,et al. Anterior corpectomy comparing to posterior decompression surgery for the treatment of multi-level ossification of posterior longitudinal ligament:a meta-analysis[J]. Int J Surg,2017,40:91-96.
[14]Chen Y,Guo Y,Chen D,et al. Long-term outcome of laminectomy and instrumented fusion for cervical ossification of the posterior longitudinal ligament[J]. Int Orthop,2009,33(4):1075-1080.
[15]Pavlin D,Dove SB,Zadro R,et al. Mechanical loading stimulates differentiation of periodontal osteoblasts in a mouse osteoinduction model:effect on typeⅠcollagen and alkaline phosphatase genes[J]. Calcif Tissue Int,2000,67(2):163-172.
[16]Wennberg C,Hessle L,Lundberg P,et al. Functional characterization of osteoblasts and osteoclasts from alkaline phosphatase knockout mice[J]. J Bone Miner Res,2000,15(10):1879-1888.
[17]Li H,Liu D,Zhao CQ,et al. High glucose promotes collagen synthesis by cultured cells from rat cervical posterior longitudinal ligament via transforming growth factor-beta1[J]. Eur Spine J,2008,17(6):873-881.

