煙草NtSYP121基因克隆、表達載體構建及表達分析
熊 雪,殷雙琴,陳 欣,王麗紅,宋文強,李立芹
(四川農業大學農學院 作物科學國家級實驗教學示范中心,四川 成都 611130)
植物本身無法主動逃避不利環境,為適應各種外來以及內在脅迫,植物細胞不斷調整并最終形成了特有的內膜系統和膜泡運輸機制以完成細胞內和細胞間的物質交流[1]。植物 SNARE (soluble N-ethylmaleimide-sensitive fusion protein attachment protein receptor)類蛋白是一類具有抗生物和非生物逆境功能的蛋白。目前已經發現許多植物SNARE蛋白可通過調節離子通道、控制蛋白質密度、直接與受體作用等方式來調節離子運輸,從而對刺激性反應作出應答[2]。SNAREs蛋白是可溶性NSF附著蛋白受體,是介導鈣離子依賴的囊泡膜與突觸膜融合的核心分子復合體[3]。SNARE蛋白的分類方法有兩種:根據膜融合過程中SNARE蛋白所處位置,可分為v-SNAREs和t-SNAREs[4];而根據SNAREs模體(motif)氨基酸的不同,又可將SNAREs分兩類:Q(谷氨酰胺)和R(精氨酸),Q-SNARE包括Syntaxin和SNAP25兩個亞家族;R-SNARE包括synaptobrivin/vamp亞家族。擬南芥基因組編碼24個syntaxin型Q-SNARE,3個SNAP25型Q-SNARE,14個VAMP型R-SNARE。Syntaxin型Q-SNARE又可細分為8個亞家族(Syp1-Syp8)[2]。
SYP121是亞家族蛋白Syntaxin中的一員。在擬南芥中,SYP121調控K+通道的亞基KC1,并與AKT1形成三元復合物SYP121-KCl-AKT1共同參與植物的鉀營養[5]。Grefen[6]發現SYP121和KC1互作是與一個FxRF模體相關聯的,而這個FxRF模體獨特地位于SNARE序列的前12個殘基。Geelen等[7]發現,SYP121介導了高爾基復合體和質膜之間的囊泡運輸。也有研究表明,SYP121的功能失活能改變KATI鉀通道的定位[8]。此外,AtSYP121還可以提高植物的抗病性。例如,Kwon等[9]研究發現,AtSYP121能與SNAP33和VAMP721/VAMP722形成復合體,共同調控病原體侵染時的細胞分泌。Maekawa等[10]發現SYP121參與擬南芥抵抗白粉病生理過程。Kiyono等[11]的研究結果表明過量表達SYP121和重金屬轉運體MerC融合蛋白能增加擬南芥中鎘積累和耐受性。在煙草中,Leyman等[12]研究發現SYP121在保衛細胞中調控K+和Cl-通道,推測在脫落酸信號中起作用。
綜上所述,Syntaxin家族蛋白對植物的抗逆性起重要作用,但是在煙草中的相關研究卻比較少。因此,本研究利用K326煙草克隆了NtSYP121基因對并對其序列進行生物信息學分析,同時,運用Real-time PCR分析了其在根、莖、葉、花及低鉀、高鹽、干旱和ABA處理下基因的表達水平,并成功構建NtSYP121-pBI121過表達載體,這對于NtSYP121響應逆境脅迫的功能研究具有重要意義。
1 材料與方法
1.1 材料與處理
實驗所用材料是K326煙草,由四川農業大學植物生理與生物技術系提供。首先進行漂浮育苗,待其生長到十字期,將其移栽到花盆中,每盆種植一株。對煙株正常生長的根、莖、葉和花進行取樣,然后在液氮中速凍,放置-80 ℃冰箱,以供后續試驗使用。
將煙草品種K326種子表面消毒后布種于MS培養基上,培養15 d后挑取長勢一致的幼苗分別進行ABA、PEG、高鹽和低鉀處理,每個處理設有3個重復。其中,ABA、PEG及高鹽處理培養基是在MS培養基的基礎上分別加入ABA(1 μmol·L-1)、PEG6000(5%)、NaCl(200 mmol·L-1)處理;低鉀處理時將待處理材料轉移到低鉀培養基上,低鉀培養基是將MS培養基中的KNO3去掉,并且將KH2PO4替換為NH4H2PO4,其余成分相同,經測定鉀離子濃度為10 μmol·L-1。所有處理在0、3、6、12、24 h后進行整株取樣。
通用型DNA純化回收試劑盒購自天根公司;DH5α大腸埃希菌菌株購于Vazyme Biotech公司;Trizol試劑、cDNA合成試劑盒、載體PMD19-T、高保真Pfu酶、PrimeScript RT reagent Kit、SYBR Green Master mix、限制性內切酶、DNA Ligation Kit 2.0等試劑購自TaKaRa生物公司,引物合成與測序由成都梓熙擎科公司完成。
1.2 實驗方法
1.2.1 克隆目的基因
取幼嫩的煙草葉片于液氮中速凍1 min后用Trizol試劑法提取其總RNA,再根據cDNA合成試劑盒的操作要求,將其反轉錄成cDNA。反轉錄體系為10 μL,在EP管中依次加入0.5 μL OligodT,5 μL RNA,0.5 μL無菌水,輕微搖勻后,在PCR儀上65 ℃變性5 min,再在冰上急冷2 min;然后再依次加入2 μL 5×Reaction Buffer,0.5 μL RNase Inhbitor,1 μL 10 mmol·L-1dNTP,0.5 μL Reverse Transcripase,在PCR儀上42 ℃反應60 min,72 ℃延伸10 min后終止反應,取出1 μL稀釋10倍備用,其余-20 ℃保存。
參考NCBI GenBank收錄的普通煙草NtSYP121序列(登錄號:NM_001325000),采用同源克隆的方法用DNAMAN設計引物NtSYP121-F和NtSYP121-R(表1),再以其稀釋過的cDNA為模板進行PCR擴增。反應體系為10 μL,分別加入5 μL 2×Perime STAR Mixture,0.2 μL 引物F (10 μmol·L-1),0.2 μL 引物R (10 μmol·L-1),1 μL cDNA,3.6 μL ddH2O。反應程序為:95 ℃預變性5 min,1個循環;95 ℃變性30 s,57 ℃退火30 s,72 ℃延伸2.5 min,35個循環;72 ℃ 8 min,1個循環;4 ℃永久保存。
1.2.2 PCR產物的回收、克隆與測序
PCR產物經1.2%瓊脂糖凝膠電泳檢測后,將目的條帶按照TIANGEN Universal DNA Purification Kit的說明操作進行純化回收,將目的片段與pMD19-T載體16 ℃連接過夜,連接產物轉化大腸埃希菌DH5α感受態,隨后在涂有含氨芐青霉素(Ampicillin)的LB平板上進行篩選,采用菌落PCR法檢測陽性克隆,然后送到成都梓熙擎科公司進行測序。
1.2.3 目的基因的生物信息學分析
使用ExPASyProtParam tool(http://web.expasy.org/protparam/)對NtSYP121基因編碼的蛋白質進行理化性質分析;利用 DNAMAN 軟件分析其編碼蛋白的疏水性,進行蛋白序列比對,并構建系統進化樹;運用(http://www.ncbi.nlm.nih.gov/struc-ture/cdd/wrpsb.cgi)進行保守功能域分析;采用PSORT (http://psort.hgc.jp/form.html)預測NtSYP121的亞細胞定位;采用IBCP(http://npsa-pbil.ibcp.fr)的在線工具SOPMA預測二級結構;使用SWISS-MODEL(http://swissmodel.expasy.org)在線預測三級結構。
1.2.4NtSYP121-pBI121過表達載體構建
采用全長含有酶切位點引物NtSYP121-pBI121-F和NtSYP121-pBI121-R擴增目的基因(表1),擴增結束后,將PCR產物和pBI121載體分別進行雙酶切,酶切體系10 μL:10×T Buffer 0.5 μL,BSA 1 μL,BamHⅠ 1 μL;SmaⅠ 1 μL;PCR產物/pBI121載體 4 μL; ddH2O 2.5 μL。酶切后回收目的片段和pBI121載體,于16 ℃連接過夜,轉化大腸埃希菌DH5α感受態,隨后在含有卡那霉素的LB平板上進行篩選,菌落PCR檢測篩選陽性克隆后,搖菌提取質粒,雙酶切后送至成都梓熙擎科公司進行測序。
1.2.5 基因的表達模式分析
根據目的基因的序列,使用DNAMAN軟件設計其熒光定量PCR的引物NtSYP121qF和NtSYP121qR(表1)。提取煙草總RNA后進行反轉錄,獲得cDNA,再以cDNA為模板進行熒光定量PCR反應,反應體系為25 μL,依次加入:SYBRⅡ 12.5 μL,引物F、R各1 μL,cDNA 1.5 μL,ddH2O 9 μL。反應程序為95 ℃預變性3 min,1個循環;95 ℃變性5 s,60 ℃延伸45 s,40個循環。所有樣品都設置3個重復來擴增目的基因,以煙草18S基因設計引物作為實驗的內標定量,擴增目的基因。擴增結束后,按2-△△Ct法計算相對表達量。

表1 各基因的引物序列
注:GGATCC為BamHⅠ;CCCGGG為SmaⅠ。
2 結果與分析
2.1 目的基因的克隆
以煙草葉片總RNA反轉錄合成的cDNA為模板進行PCR擴增,電泳結果顯示在1 000 bp左右的位置上有清晰的條帶(圖1)。采用切膠回收的方法對該條帶進行純化后,與pMD19-T載體16 ℃連接過夜,隨后對獲得陽性克隆隨機挑選3個進行測序。測序結果顯示:目的片段大小為903 bp。
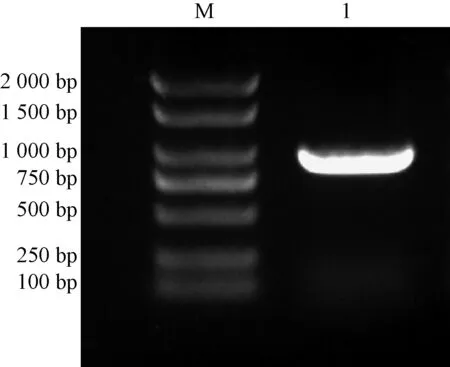
M為Marker 2 000 bp;1為NtSYP121圖1 NtSYP121的克隆
2.2 編碼蛋白質的理化性質及疏水性
使用ExPASyProtParam tool(http://web.expasy.org/protparam/)對NtSYP121基因編碼的蛋白質進行了理化性質分析,結果表明,該蛋白質的分子量為34 ku,理論等電點pI為7.76;帶正電荷的氨基酸殘基(精氨酸+賴氨酸)總數是43,帶負電荷的氨基酸殘基(天冬氨酸和谷氨酸)總數是42,該蛋白的不穩定系數是40.07,由此說明該蛋白可能是一個不穩定蛋白。該蛋白脂肪系數為85.13,總的平均疏水性為-0.551,用DNAMAN軟件進行的疏水性分析結果顯示(圖2),預測該蛋白屬于親水性蛋白。
2.3 二級結構及三級結構
使用IBCP(http://npsa-pbil.ibcp.fr)的在線工具SOPMA,對NtSYP121的二級結構進行預測,結果(圖3中A)表明:α-螺旋約占65.00%,無規則卷曲約占20.00%,延伸鏈占8.33%,β-轉角占6.67%,由此可見,該蛋白二級結構的最大元件為α-螺旋。使用SWISS-MODEL對NtSYP121的三級結構進行了預測,結果如圖3中B所示,并將結果與二級結構預測及跨膜結構預測比照,結果較為統一,所得三級結構預測結果較為可信。利用 Swiss-PdbViewer分析同源建模結果,表明其立體三維結果比較穩定,所以其同源建模的結果是相對可靠的。
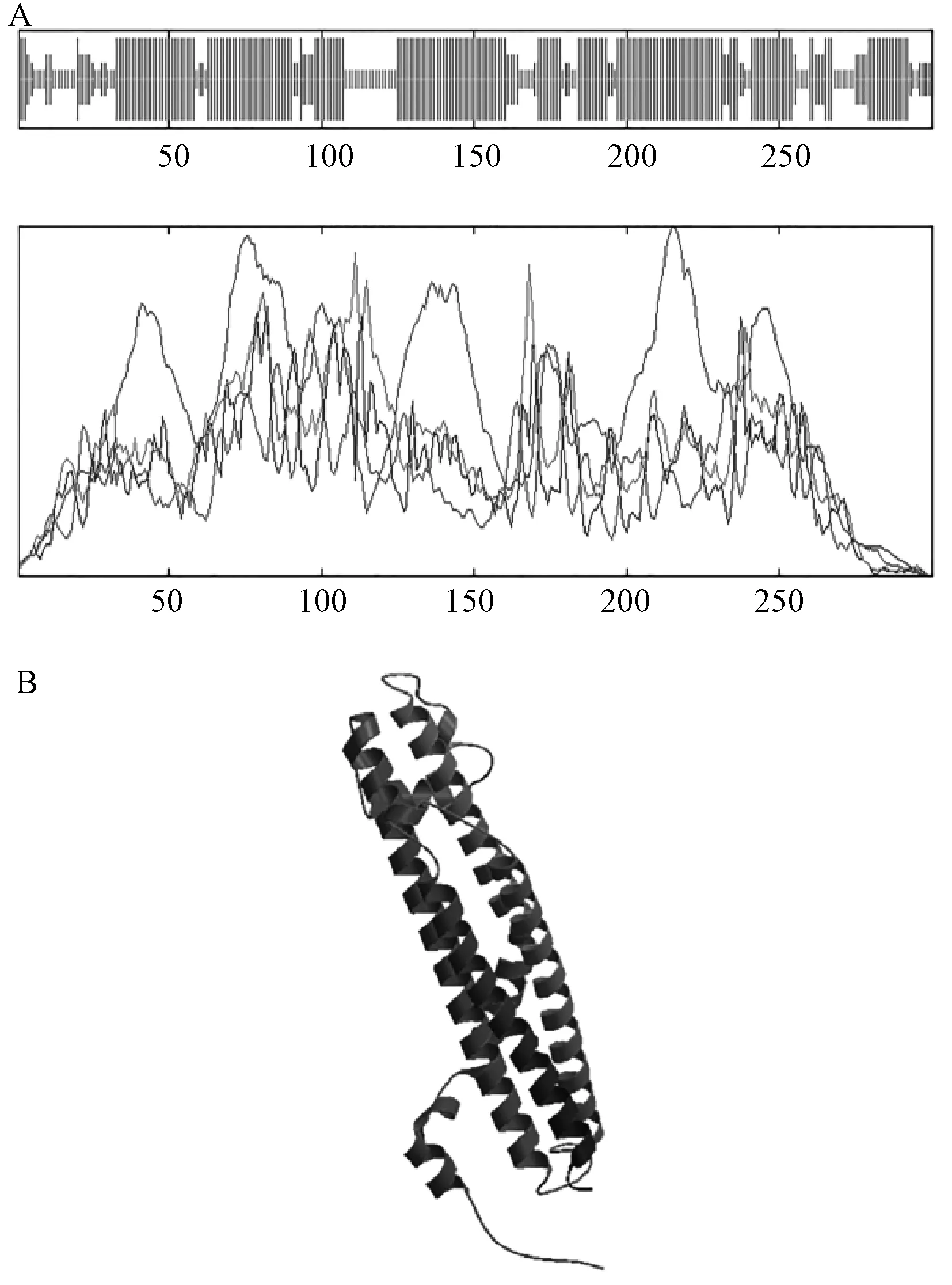
A,二級結構預測;B,三級結構預測圖3 NtSYP121的二級結構及三級結構預測
2.4 NtSYP121的同源性
為了探明NtSYP121與其他植物基因的同源性,把NtSYP121編碼的氨基酸序列在NCBI 數據庫中進行了BLAST比對,然后在DNAMAN進行多序列比對,結果(圖4中A)顯示,NtSYP121與各植物中的SYP121蛋白一級結構的氨基酸序列是高度保守的。將NtSYP121氨基酸序列與其他同源性比較近的植物SYP121序列進行聚類分析,結果表明,NtSYP121與漸窄葉煙草SYP121-like、絨毛狀煙草SYP121-like、番茄SYP121-like等具有較高的氨基酸序列同源性,分別為99%、98%、94%(圖4中B)。
2.5 編碼蛋白的功能保守域及亞細胞定位
利用NCBI數據庫的CDD軟件對目的基因所編碼蛋白的功能保守域進行了分析,結果(圖5)表明,該蛋白具有SNARE-Syntaxin家族典型的N端結構,且屬于t-SNARE蛋白,說明其是多功能蛋白家族SNARE的亞家族蛋白Syntaxin的一員。使用PSORT(http://psort.hgc.jp/form.html)在線預測亞細胞定位,根據預測的結果得知,在質膜上的可能性為0.440,在線粒體內膜上的可能性為0.100,在高爾基體上的可能性為0.100,在內質網膜上的可能性為0.850。根據以上結果預測該蛋白質定位在內質網膜上。
2.6 構建NtSYP121-pBI121過表達載體構建
將PCR擴增產物和pBI121載體分別進行雙酶切,回收后連接并轉化大腸埃希菌,培養陽性菌落進行質粒提取,然后進行雙酶切,電泳結果(表6)顯示,能夠酶切出目的基因的條帶,表明NtSYP121-pBI121過表達載體構建成功。
2.7 NtSYP121的組織表達分析
以普通煙草K326的根、莖、葉、花cDNA為

A:NtSYP121蛋白多重序列比對;B:NtSYP121蛋白系統進化樹圖4 NtSYP121同源性分析
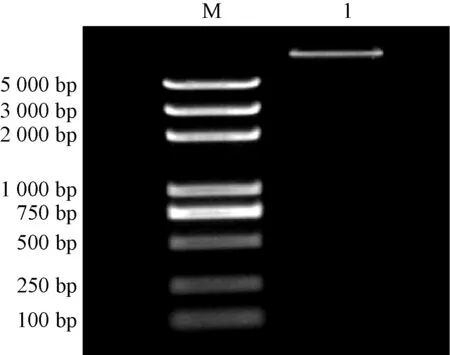
M,Marker 5 000 bp;1,NtSYP121圖6 NtSYP121-pBI121過表達載體構建
模板進行Real-time PCR反應,分析NtSYP121在各個部位的表達量,結果(圖7)表明,NtSYP121的表達量由高到低依次為根>花>葉>莖,其在根中的表達量是分別是花、葉、莖中表達量的15.0、20.2、26.4倍,這說明NtSYP121基因主要在煙草植株的根中表達,并且其表達存在組織特異性。
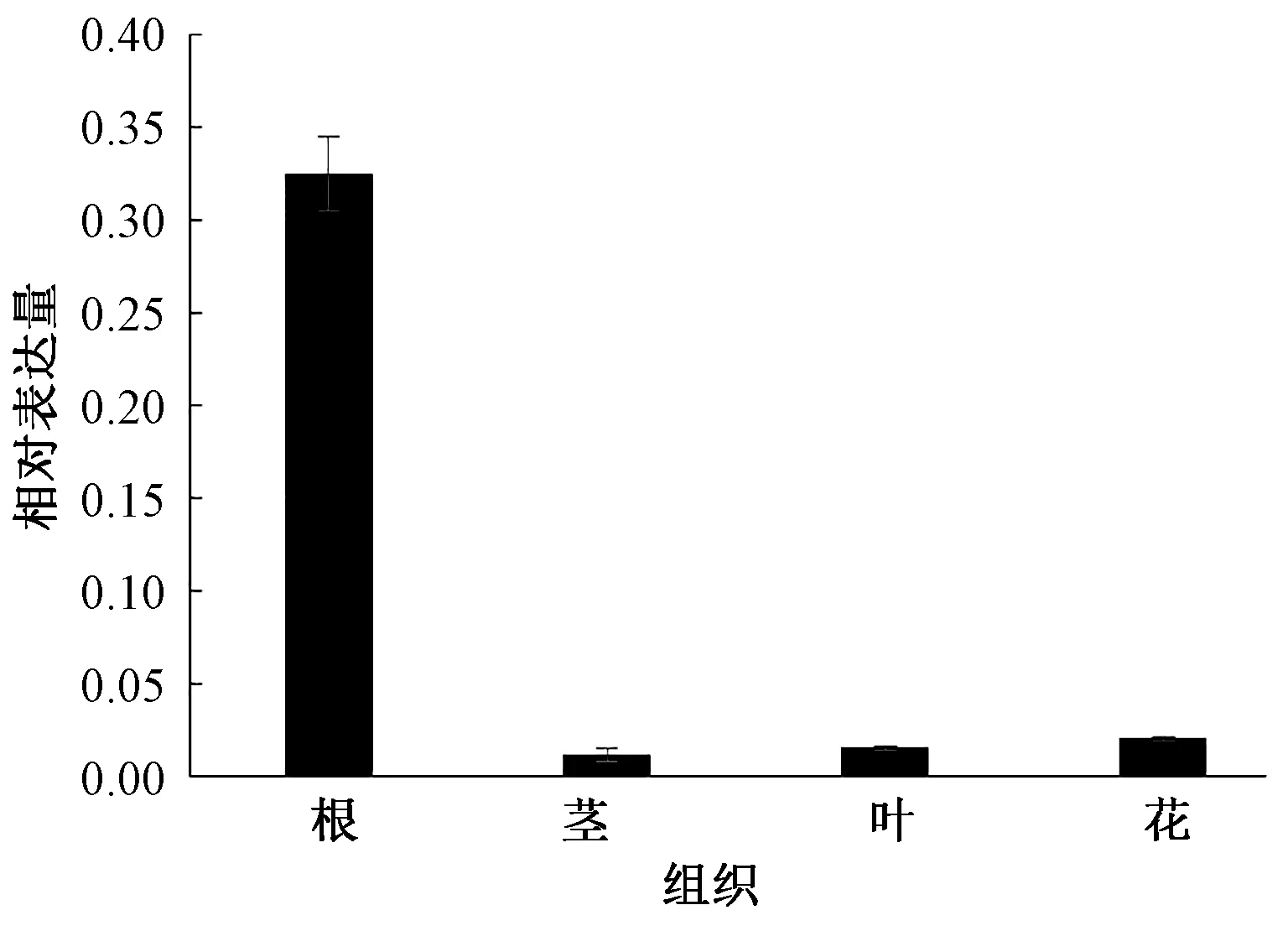
圖7 NtSYP121在不同組織中的相對表達量分析
2.8 NtSYP121在ABA和PEG處理下的表達
將煙草K326幼苗移苗至含有1 μmol·L-1ABA和5% PEG6000MS培養基上處理3、6、12、24 h,然后進行取樣提取RNA。采用Real-time PCR對NtSYP121在逆境脅迫下的表達模式進行分析。結果發現,在ABA處理后,NtSYP121在3 h的表達量上調,隨后在6 h的表達量下降且低于對照(0 h),在6 h和24 h表達量又逐漸上調,其中在24 h時NtSYP121的表達量上調到最大值,為對照(0 h)的1.72倍;在PEG處理后,NtSYP121在3 h表達量明顯增加,其中在24 h時該基因表達量達到最大值,為對照(0 h)的4.70倍。因此NtSYP121參與ABA和PEG脅迫生理過程(圖8)。
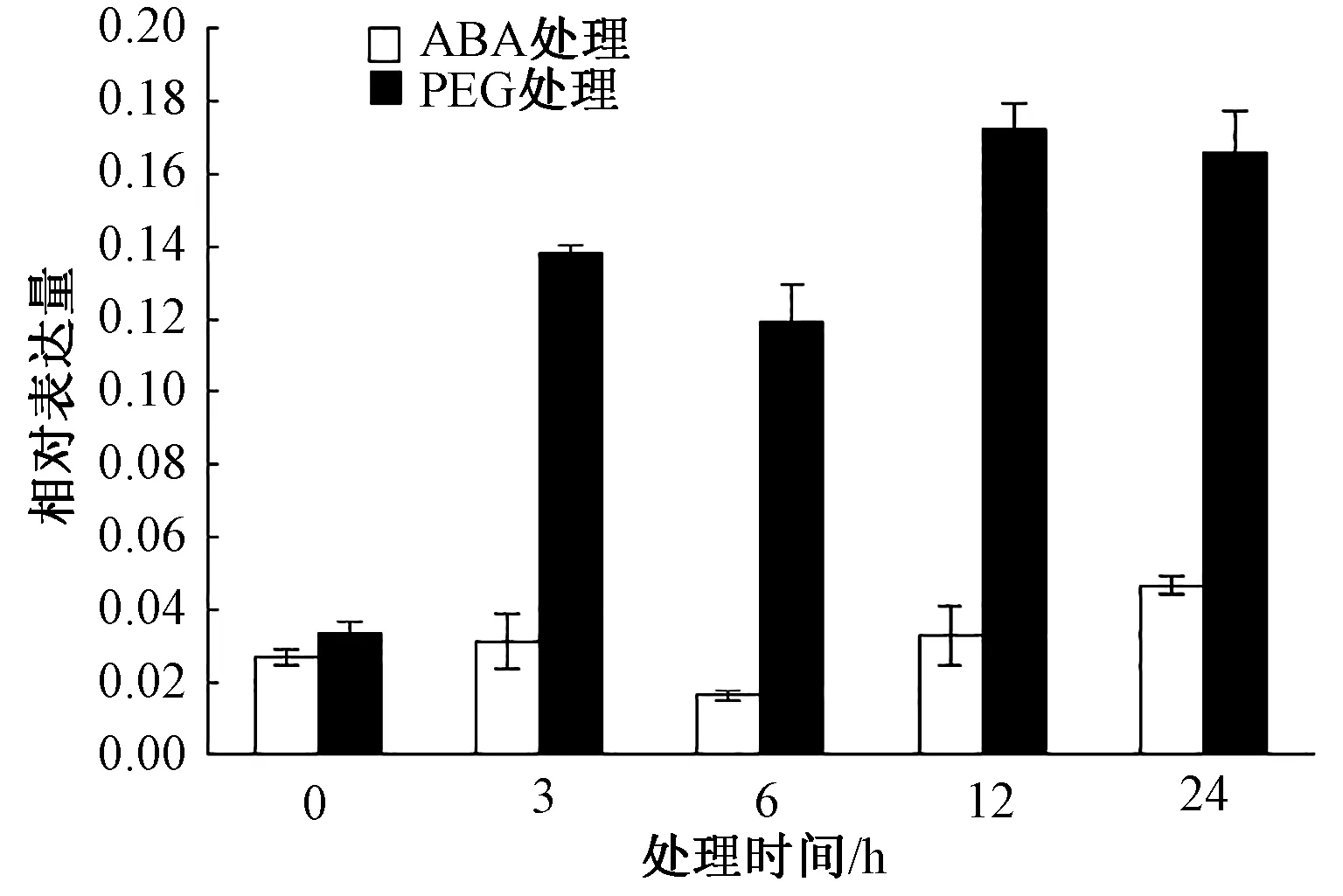
圖8 ABA和PEG處理下NtSYP121的表達模式分析
2.9 NtSYP121在高鹽和低鉀處理下的表達
把生長15 d的煙草幼苗轉移到高鹽和低鉀培養基上處理3、6、12和24 h,然后進行取樣提取RNA。采用Real-time PCR對NtSYP121在逆境脅迫下的表達模式進行分析,結果發現,在高鹽處理后,NtSYP121在3 h的表達量下降,僅為對照(0 h)的11%;隨后表達量上調,6 h時表達量上調為對照的74%;12 h及以后表達量又繼續下降。在低鉀處理3、6、12 h后,NtSYP121表達量都是下降的,12 h時最低,為對照(0 h)的2%;隨后24 h時表達量上調為對照的77%。上述結果表明高鹽和低鉀處理下NtSYP121表達量明顯降低(圖9)。
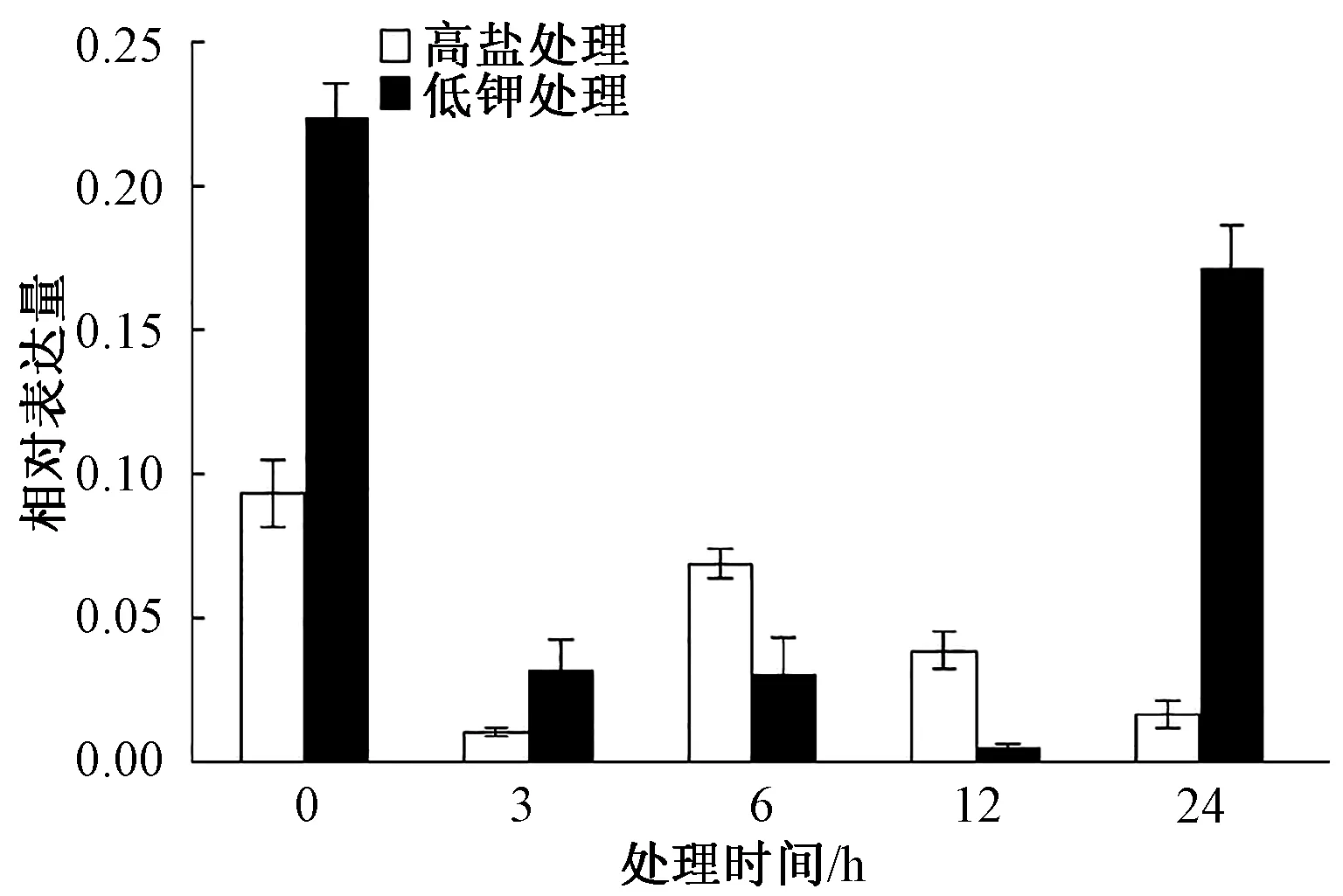
圖9 高鹽和低鉀處理下NtSYP121的表達模式分析
3 討論
本研究從普通煙草K326中克隆到一個Syntaxin家族成員NtSYP121的cDNA序列,其ORF為903 bp,編碼300個氨基酸。編碼蛋白的功能保守域分析,該基因編碼的蛋白具有SNARE-Syntaxin家族典型的結構。利用軟件分析該蛋白的亞細胞定位,表明該蛋白質定位在內質網膜上。而在Collins等[13]和Leyman等[14]對擬南芥和煙草的研究中,SYP121基因編碼的蛋白定位在質膜上;李文琦[15]對木薯MeSYP121蛋白進行亞細胞定位分析,發現其定位到高爾基體中。今后將通過定位實驗(如綠色熒光蛋白標記)來研究NtSYP121蛋白的定位,這對于其功能的研究具有重要的意義。組織表達分析結果表明,NtSYP121基因的表達具有組織特異性,在煙草K326的根中表達量最高,而在莖、葉、花中表達量很低,其中在莖中的表達量最低。Leyman等[14]在煙草Nicotiana的研究中也發現該基因所編碼的蛋白在根中表達量最高,而莖、葉、花中表達量較低,本試驗結果與前人研究結果一致,因此推測NtSYP121主要在煙草根中發揮功能。
植物經歷干旱脅迫時,ABA被普遍認為是一種干旱信號而傳遞干旱信息。逆境脅迫下,ABA通過信號轉導通路,誘導相關基因和蛋白表達,從而提高植物對多種逆境脅迫的抗性[16-17]。已有研究表明,ABA能提高植物對干旱脅迫的抗性[18-20]。在ABA(1 μmol·L-1)處理后,NtSYP121基因表達量表現為在3 h上升,在6 h時下降且低于對照,隨后該基因表達量又逐漸上升且高于對照,最后在24 h時表達量最高;Real-time PCR分析結果表明:PEG處理后,NtSYP121的表達受到顯著誘導,其中在12 h時該基因表達量最高;這與Leyman等[12]研究結果類似。在NaCl(200 mmol·L-1)和低鉀脅迫處理后,Real-time PCR結果表明NtSYP121基因的表達量與對照相比,呈下降趨勢,而在Leyman等[14]在煙草Nicotiana的研究中,使用Northern blot方法檢測該基因的表達量在NaCl(300 mmol·L-1)處理1 h升高,使用Western blot方法測得該蛋白的表達量在6 h明顯升高,而后逐漸降低,在24 h時表達量與對照沒有區別。導致試驗結果不同的原因可能是植物的生長時期,鹽處理濃度和檢測方法的不同。要明確NtSYP121參與的信號轉導途徑還需要進一步的試驗驗證。已成功構建NtCBL1基因的過量表達載體,后續工作可通過轉基因技術研究該基因的功能。
[1] STAEHELIN L A. The plant ER: A dynamic organelle composed of a large number of discrete functional domains[J].Plant Journal,1997,11(6):1151-1165.
[2] PRATELLI R,SUTTER J U,BLATT M R.A new catch in the SNARE[J].Trends in Plant Science,2004,9(4):187-195.
[3] BAND A M, KUISMANENE. Localization of plasma membrane t-SNAREs syntaxin 2 and 3 in intracellular compartmen-ts[J].BMC Cell Biology,2005,6(1):26.
[4] SANDERFOOT A A, RAIKHEL N V. The specificity of vesicle trafficking: Coat proteins and SNAREs[J].Plant Cell,1999,11(4):629-642.
[5] HONSBEIN A, SOKOLOVSKI S, GREFEN C, et al. A tripartite SNARE-K+channel complex mediates in channel-dependent K+nutrition in Arabidopsis[J].Plant Cell,2009,21(9): 2859-2877.
[6] GREFEN C, CHEN Z H, HONSBEIN A, et al. A novel motif essential for SNARE interaction with the K+channel KC1 and channel gating in Arabidopsis[J].Plant Cell,2010,22(9): 3076-3092.
[7] GEELEN D, LEYMAN B, BATOKO H, et al. The abscisic acid-related SNARE homolog NtSyr1 contributes to secretion and growth: evidence from competition with its cytosolic domain[J]. Plant Cell, 2002, 14(2):387-406.
[8] SUTTER J, CAMPANONI P,TYRRELL M, et al. Selective mobility and sensitivity to SNAREs is exhibited by the Arabidopsis KAT1 K+channel at the plasma membrane[J].Plant Cell, 2006,18(4):935-954.
[9] KWON C,NEU C,PAJONK S, et al. Co-option of a default secretory pathway for plant immune responses[J].Nature,2008,451(7180):835-840.
[10] MAEKAWA S, INADA N, YASUDA S, et al. The carbon/nitrogen regulator ARABIDOPSIS TOXICOS EN LEVADURA31 controls papilla formation in response to powdery mildew fungi penetration by interacting with SYNTAXIN OF PLANTS121 inArabidopsis[J].Plant Physiology,2014,164(2):879-887.
[11] KIYONO M, OKA Y, SONE Y, et al. Expression of the bacterial heavy metal transporter MerC fused with a plant SN-ARE, SYP121, inArabidopsisthalianaincreases cadmium accumulation and tolerance[J].Planta,2012,235(4):841-850.
[12] LEYMAN B, GEELAN D,QUINTERO F J, et al. A tobacco syntaxin with a role in hormonal control of guard cell ion channels[J].Science, 1999, 283(5401): 537-540.
[13] COLLINS N C,THORDAL-CHRISTENSEN H, LIPKA V, et al. SNARE-protein-mediated disease resistance at the plant cell wall[J].Nature,2003,425(6961):973-977.
[14] LEYMAN B,GEELEN D,BLATT M R. Localization and control of expression of Nt-Syr1,a tobacco SNARE protein[J].Plant Journal,2000,24(3):369-381.
[15] 李文綺.木薯SYP基因的克隆、表達和功能分析[D].石河子:石河子大學,2013.
[16] AARATI P,KRISHNAPRASAD B T, GANESHKUMAR, et al. Expression of an ABA responsive 21 kDa protein in finger millet (EleusinecoracanaGaertn.) under stress and its relevance in stress tolerance[J].Plant Science,2003,164(1):25-34.
[17] BECKER W, APELK. Differences in gene expression between natural and artificially induced leaf senescence[J].Planta,1993,189(1):74-79.
[18] 王瑋,李春香.水分脅迫下外源ABA對玉米幼苗根葉滲透調節的影響(簡報)[J].植物生理學通訊,2000,36(6):523-526.
[19] MAYABA M, BEEKETT R P, CSINTALAN Z, et al. ABA increases the desiccation tolerance of photosynthesis in the afromontane understory moss Atrichumandrogynum[J].Annals of Botany,2001,88(6):1093-1100.
[20] AGARWAL S,SAIRAM R K,SRIVASTAVA G C, et al. Changes in antioxidant enzymes activity and oxidative stress by abscisic acid and salicylic acid in wheat genotypes[J].Biologia Plantarum,2005,49(4):541-550.

