抑制番茄青枯病拮抗菌株的田間生防效果
王麗麗,李 洋,林樂志
(寧波市農業科學研究院,浙江 寧波 315040)
番茄青枯病,是由茄科勞爾氏菌(Ralstoniasolanacearum)引起的一種毀滅性的土傳細菌病害,是番茄上常見的維管束系統性病害之一,保護地、露地均可發生。南方及多雨年份發生普遍而嚴重。發病嚴重時造成植株整株死亡,導致嚴重減產甚至絕收。
青枯病菌在環境中變異較多,傳播途徑多樣,寄主范圍廣,對其防治比較困難[1-2],目前市場上還未有針對青枯病的專用特效藥。通過生物防治菌對其進行防治不失為一條既有效又環保的途徑,近年來,利用無致病力青枯菌、假單胞菌、芽孢桿菌、鏈霉菌、真菌、噬菌體等來防治番茄青枯病受到了廣大學者的關注。芽孢桿菌是多種植物病原菌的拮抗菌,有預防和控制植物病害的功效,能產生具有抗逆性的內生孢子(芽孢),能耐鹽、耐酸、耐高溫,且易于保存和運輸[3-4],因此利用芽孢桿菌防治番茄青枯病具有較明顯的優勢。
本試驗通過實驗室分離篩選得到的2株拮抗番茄青枯病病原菌的芽孢桿菌菌株進行田間應用,調查菌株對番茄青枯病的田間防控效果,從而明確菌株防控番茄青枯病的可能性。
1 材料與方法
1.1 材料
田間試驗在寧波市海曙區古林鎮天勝四不用農場選擇病情大致相同的區域進行。
試驗采用的拮抗菌采用實驗室前期分離篩選得到的W118(解淀粉芽孢桿菌)和W12(枯草芽孢桿菌),菌株發酵液含菌量為1億個·mL-1以上。其中,W118經中國微生物菌種保藏管理委員會普通微生物中心保藏(CGMCC No.12200)。參試番茄采用當地常規品種申粉8號。
1.2 處理設計
根據前期預試驗,混合菌株防控效果較單一的好,因此本試驗設置2個處理,分別為混合菌株發酵液處理(W12+W118)和清水對照(CK),重復3次。
田間觀察到番茄植株有青枯病發生時開始施用混合菌株發酵液,每隔7 d施用1次,每株番茄苗澆灌量為10 mL,對照施用等量清水,共計3次。
1.3 調查項目及方法
病情指數及防控效果調查。每次灌菌后統計各處理的病情指數和防控效果。番茄青枯病的分級標準為[5]:0級,植株正常;1級,植株葉片萎蔫程度不超過25%;2級,植株葉片萎蔫程度超過25%且不超過50%;3級,植株葉片萎蔫程度超過50%且不超過75%;4級,植株葉片萎蔫程度超過75%。
病情指數=Σ(病級數×該病級植株數)/(最大病級數×植株總株數)×100;
防控效果/%=(對照組病情指數-處理組病情指數)/對照病情指數×100。
根際土壤微生物數計數。細菌計數采用牛肉膏蛋白胨固體培養基,放線菌計數采用高氏I號合成培養基,真菌計數采用馬丁氏瓊脂培養基,病原菌計數采用SMSA(semi-selectivemedium, South Africa)培養基。相關培養基配方如下:
牛肉膏蛋白胨固體培養基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,瓊脂15~25 g,水1 000 mL,pH值7.4~7.6。
高氏I號合成培養基:可溶性淀粉20 g,KNO31.0 g,NaCl 0.5 g,MgSO4·7H2O 0.5 g,K2HPO40.5 g,FeSO4·7H2O 0.01 g,瓊脂粉10 g,蒸餾水1 000 mL,pH值7.2~7.4。配置時,先用少量冷水將淀粉調成糊狀,倒入煮沸的水中,邊攪拌邊加入其他成分,溶化后,補足水分至1 L。
馬丁氏瓊脂培養基:葡萄糖10 g,蛋白胨5 g,KH2PO41 g,MgSO4·7H2O 0.5 g,1/3 000孟加拉紅100 mL,瓊脂25 g,pH值自然,蒸餾水800 mL,115 ℃滅菌30 min,臨用前加入硫酸鏈霉素0.03 g。
SMSA培養基:胰蛋白胨10 g,甘油5 mL,酪蛋白氨基酸1 g,瓊脂粉15 g,蒸餾水1 000 mL。培養基冷卻至50 ℃時每250 mL加入1%的多粘菌素B 2.5 mL,1%的結晶紫125 μm,1%的四氮唑鹽1.25 mL,1%的桿菌肽625 μmol,0.1%的青霉素125 μmol,1%的氯霉素125 μmol,1%的放線菌酮2.5 mL。
1.4 數據處理
數據采用DPS 7.5軟件進行統計分析
2 結果與分析
2.1 對番茄青枯病的田間防控效果
從表1可知,W12和W118的混合菌株能防治田間番茄青枯病,1次灌菌后的防效為 25.6%,3次灌菌后的防效達 43.0%。
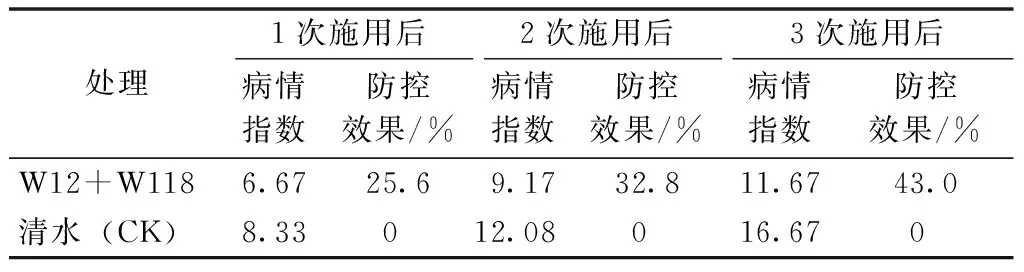
表1 拮抗菌株W12和W118混合發酵液對 番茄青枯病的田間防控效果
2.2 對植株根際土壤中可培養微生物數量的影響
由表2可知,施用混合菌株菌液對番茄植株根際土壤中可培養微生物有一定的影響,其中細菌、放線菌都有一定程度的增加,真菌、病原菌有一定程度的減少,使得土壤中微生物向著有益的方向發展[6],說明施用拮抗菌株對番茄植株根際微生物群落有改善作用。

表2 拮抗菌株W12和W118混合發酵液對 番茄植株根際土壤微生物數量的影響
3 小結與討論
試驗結果表明,高效拮抗菌(W12+W118)經發酵混合后用于田間,灌菌3次后的防治效果達到43.0%,說明施用拮抗菌能有效地防治田間番茄青枯病的發生。
施用生防菌不但可以影響番茄植株根際土壤中的病原菌數量,還可以調節土壤中其他微生物的數量結構。施用拮抗菌后,細菌、放線菌數量均較對照增加,病原菌、真菌數量較對照減少,說明根際土壤微生物區系向著更健康的方向發展。但是,通過調節土壤微生物生態來抑制土傳病害的方式,需要較長的時間,因此如要更好地防治青枯病,可能需要連續幾年施用拮抗菌,最終才使得土壤能夠通過自身的生態調節,達到抑制病害發生的目的[7]。
[1] GRIMAULT V, ANAIS G, PRIOR P. Distribution ofPseudomonassolanacearumin the stem tissues of tomato plants with diff erent levels of resistance to bacterial wilt [J].Plant Pathol, 2010, 43(4):663-668.
[2] SWANSON J K, YAO J, TANS-KERSTEN J, et al. Behavior ofRalstoniasolanacearumrace 3 biovar 2 during latent and active infection of geranium [J]. Phytopathol, 2005, 95(2):136-143.
[3] FRAVEL D R. Commercialization and implementation of biocontrol[J]. Annual Review of Phytopathology, 2005, 43(1): 65-87.
[4] SHODA M. Bacterial control of plant diseases[J]. Journal of Bioscie nce and Bioengineering, 2000, 89(6): 515-521.
[5] 方中達.植病研究方法[M].3版.北京:中國農業出版社,1998.
[6] BOTTOMLEY P J,YARWOOD R R,KAGEYAMA S A, et al. Responses of soil bacterial and fungal communities to reciprocal transfers of soil between adjacent coniferous forest and meadow vegetation in the cascade mountains of oregon[J]. Plant and Soil, 2006, 289(1/2):35-45.
[7] 李紅麗,郭夏麗,李清飛,等.抑制煙草青枯病生物有機肥的研制及其生防效果研究[J].土壤學報,2010,47(4):798-801.

